Introdução
Nos últimos anos, a incidência do linfoma não Hodgkin (LNH) aumentou a nível mundial, especialmente o linfoma extraganglionar primário1.
O trato gastrointestinal é o local mais frequentemente envolvido pelos linfomas extraganglionares, representando 30-40% de todos os casos extraganglionares e aproximadamente 4-20% de todos os linfomas não Hodgkin1.
Olinfoma primário gastrointestinal inclui todos os linfomas com origem aparente num local extraganglionar, mesmo na presença de doença disseminada, desde que o componente extraganglionar seja dominante2. A incidência anual deste tipo de linfomas é de 0,8 a 1,2 casos por 100.000 pessoas por ano3, sendo o linfoma difuso de grandes células B o mais comum4.
Caso clínico
Doente do sexo masculino de 78 anos, sem antecedentes pessoais relevantes, internado por hematoquézias com dois dias de evolução, sem outra sintomatologia acompanhante.
À admissão, apresentava-se hemodinamicamente estável, apirético, sem alterações particulares ao exame objetivo, nomeadamente hepatoesplenomegália ou adenopatias palpáveis.
Laboratorialmente salientava-se anemia normocítica normocrómica, com hemoglobina de 11,7g/dL na admissão, com descida até um mínimo de 9g/dL. Efetuou retosigmoidoscopia flexível que foi inconclusiva devido à presença de sangue e coágulos e endoscopia digestiva alta que foi normal. A colonoscopia total ao segundo dia de internamento não mostrou sangue no lúmen ou lesões da mucosa. Durante o internamento, não se verificou recidiva hemorrágica. Perante uma hemorragia digestiva obscura, foi realizada enteroscopia por videocápsula que revelou, no ileon distal, lesão endoluminal exofítica e irregular, com áreas ulceradas e friabilidade, suspeita de neoplasia (figuras 1 a 3).
A tomografia computorizada (TC) abdómino-pélvica demonstrou espessamento difuso do íleo terminal (figura 4), a presença de uma massa, com 40mmx28mm, em contacto com o cego (figura 5).
Repetiu colonoscopia com ileoscopia, confirmando o envolvimento do cego por uma lesão de características infiltrativas (não presente no primeiro exame) que foi biopsada. Em coloração de hematoxicilina-eosina, observava-se infiltração da lâmina própria por células redondas de tamanho grande. A análise imunohistoquímica foi positiva para CD20, CD10, bcl-2, bcl-6 e negativa para CAM5,2; CD3 e CD5, permitindo o diagnóstico de LNH difuso de grandes células, fenótipo B.
Da avaliação laboratorial complementar, destaca-se LDH 298U/L (valor de referência <248U/L).
Para o estadiamento da neoplasia, efetuou TC tóraco-abdominal que demonstrou envolvimento supra e infra diafragmática com conglomerados adenopáticos mediastínicos, mesentéricos e uma lesão nodular hipodensa no lobo esquerdo, com 4 cm de maior eixo, traduzindo envolvimento secundário pela doença de base, o que permitiu classificar a neoplasia no estadio IV, de acordo com a classificação de Lugano. Houve, portanto, progressão da doença do primeiro para o segundo exame imagiológico. O mielograma e a biopsia osteomedular não revelaram infiltração pelo linfoma.
O doente foi referenciado para a Consulta de Hematologia, e iniciou quimioterapia com rituximab, ciclofosfamida, doxorrubicina, vincristina e prednisona (R-CHOP).
Encontra-se atualmente no segundo ciclo. Não se verificou entretanto recidiva hemorrágica.
Discussão:
A definição de linfoma primário gastrointestinal mais aceite inclui todos os doentes que se apresentam com LNH com origem aparente num local extraganglionar, mesmo na presença de doença disseminada, desde que o componente extraganglionar seja clinicamente dominante2.
A incidência anual de linfomas gastrointestinais primários é de 0,8 a 1,2 casos por 100.000 pessoas por ano3.
Embora o linfoma possa envolver qualquer local do trato gastrointestinal, os locais mais frequentes são, por ordem de frequência, o estômago (55-70%1), seguido do intestino delgado (20%-35%1) e do cólon (5%-10%1)5.
A idade de apresentação varia com o local e o subtipo histológico do linfoma5. No entanto, a maior parte dos linfomas da orofaringe, estômago e colorretais surge em doentes com idades superior a 50 anos3.
Têm sido apontados alguns fatores de risco para o desenvolvimento deste tipo de linfomas, nomeadamente infeção por Helicobacter pylori6, Campylobacter jejuni, vírus da imunodeficiência humana, vírus Epstein-Barr6 , vírus da hepatite B, vírus linfotrópico de células T6 , doença celíaca, doença inflamatória intestinal e imunossupressão5.
A apresentação clínica é inespecífica, incluindo dispepsia, epigastralgias, dor abdominal, náuseas, vómitos, diarreia, perda ponderal, mal absorção, hemorragia, anemia, e em menor grau, ulceração, perfuração e intussusceção7.
A apresentação como hemorragia digestiva obscura (HDO) manifesta é rara, estando pucos casos reportados na literatura8.
A HDO manifesta ou oculta constitui uma das principais indicações da enteroscopia por videocápsula9; a capacidade diagnóstica global é de aproximadamente 50%, sendo maior na HDO manifesta (92,3%), comparativamente à HDO oculta (44,2%)10.
Os linfomas do intestino delgado surgem na cápsula como uma massa, pólipo ou úlcera, não se conseguindo distinguir de outras lesões11.
Uma vez que a VCE não permite a biopsia de lesões10, são necessários exames endoscópicos que permitam a recolha de material para exame histológico. No caso clínico apresentado, dada a localização da lesão, realizou-se colonoscopia com ileoscopia.
O subtipo histológico de linfoma mais comum no trato gastrointestinal é o LNH difuso de grandes células B4.
Este linfoma engloba um grupo heterogéneo de tumores que consistem em células B grandes, com nucléolo proeminente e citoplasma basófilo, com um padrão de crescimento difuso e uma fração de proliferação elevada (>40%)12.
As células tumorais no LNH difuso de grandes células B expressam quase sempre os marcadores pan-B, (CD19, CD20, CD22, CD79a) e são bcl-6 positivos; uma minoria expressa CD10 e CD54.
O estadiamento de Ann Arbor, desenvolvido e usado por rotina nos LNH ganglionares, é considerado inadequado para o estadiamento do linfoma gastrointestinal uma vez que não incorpora características relevantes específicas deste tipo de linfoma (nomeadamente a profundidade de envolvimento do tumor que se sabe que influencia o prognóstico). Deste modo, têm sido propostas algumas modificações deste sistema bem como outros sistemas alternativos. O sistema de estadiamento mais aceite é designado de Lugano13. De acordo com este sistema, há III estadios – I, II e IV (neste sistema de estadiamento, não há estadio III), sendo que no estadio I a doença está confinada ao trato gastrointestinal (I1- se tumor limitado à mucosa e/ou submucosa; I2 se há infiltração da muscular própria e/ou subserosa e/ou serosa) e no estadio IV há doença extraganglionar disseminada; o estadio II está subdividido em II1 se houver envolvimento apenas dos gânglios locai; II2 se envolvimento dos gânglios distantes; IIE se invasão de tecido/órgãos adjacentes14.
O tratamento dos doentes com linfoma primário intestinal permanece sob debate; a resseção cirúrgica seguida de quimioterapia parece ser a estratégia mais eficaz nos doentes com LNH difuso de grandes células B com doença localizada; no caso de doença disseminada, a quimioterapia com R-CHOP é a estratégia mais adequada15.
Vários fatores afetam o prognóstico do LNH difuso de grandes células B, nomeadamente a idade, o estadio da doença, o valor de lactato desidrogenase e o tratamento com quimioterapia7. Tem sido reportado um curso clinico mais agressivo na presença de sintomas sistémicos, linfadenopatia disseminada e valores elevados de lactato desidrogenase. Em contrapartida, os doentes com doença CD10+ têm apresentando uma maior taxa de sobrevida comparando com os doentes com linfoma CD10 negativos7.
Segundo o estudo efetuado por Kim et al, a taxa de sobrevida dos doentes com LNH difuso de grandes células B intestinal aos 3 anos foi de 47% na doença localizada e de 80% na doença disseminada15. A região ileocecal parece estar associada a melhor sobrevida comparativamente ao envolvimento do delgado ou cólon4.
Figura I

Enteroscopia por videocápsula: 5 horas e 42 minutos
Figura II
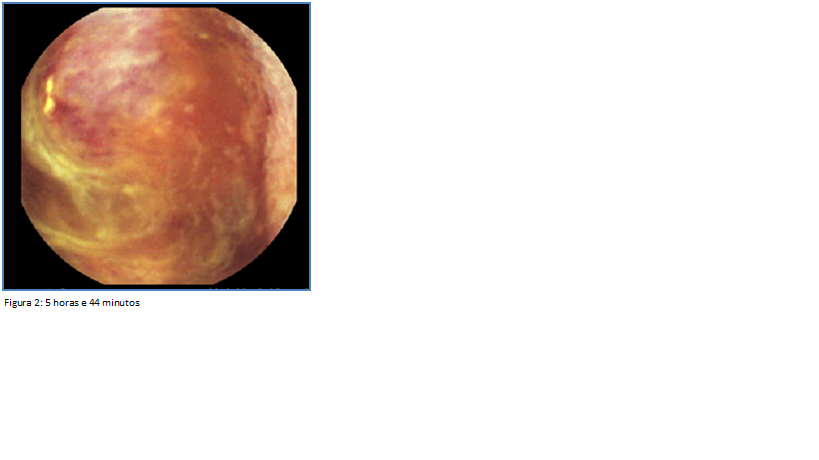
Enteroscopia por videocápsula: 5 horas e 44 minutos
Figura III

Enteroscopia por videocápsula: 5h50min
Figura IV

Tomografia computorizada abdómino-pélvica: Espessamento difuso do íleo terminal (seta)
Figura V

Tomografia computorizada abdómino-pélvica: Massa, com 40mmx28mm, em contacto com o cego (seta)
BIBLIOGRAFIA
1. Wang GB, Xu GL, Luo GY, Shan HB, Li Y, Gao XY, Li JJ, Zhang R. Primary intestinal non-Hodgkin´s lymphoma: A clinicopathologic analysis of 81 patients. World J Gastroenterol. 2011 Nov 7;17(41):4625-31
2. Krol AD, le Cessie S, Snijder S, Kluin-Nelemans JC, Kluin PM, Noordijk EM. Primary extranodal non-Hodgkin’s lymphoma (NHL): the impact of alternative definitions tested in the Comprehensive Cancer Centre West population-based NHL registry. Ann Oncol. 2003 Jan;14(1):131-9
3. Koch P, del Valle F, Berdel WE, Willich NA, Reers B, Hiddemann W, German Multicenter Study Group. Primary Gastrointestinal Non-Hodgkin’s Lymphoma: I. Anatomic and Histologic Distribution, Clinical Features, and Survival Data of 371 Patients Registered in the German Multicenter Study GIT NHL 01/92. J Clin Oncol. 2001, 19(18):3861-3873
4. Judith A. Ferry. Extranodal Lymphoma. Archives of Pathology & Laboratory Medicine. 2008 Apr;132 (4): 565-578
5. Ghimire P, Wu GY, Zhu L. Primary gastrointestinal lymphoma. World J Gastroenterol. 2011 Feb 14;17(6):697-707
6. Müller AM, Ihorst G, Mertelsmann R, Engelhardt M. Epidemiology of non-Hodgkin´s lymphoma (NHL): trends, geographic distribution, and etiology. Ann Hematol. 2005 Jan;84(1):1-12
7. Bautista-Quach MA, Ake CD, Chen M, Wang J. Gastrointestinal lymphomas: Morphology, immunophenotype and molecular features. J Gastrointest Oncol. 2012 Sep; 3(3): 209–225
8. Meister T, Schaefer IM, Domschke W. Diffuse large B-cell lymphoma of the small bowel as an unusual cause for recurrent obscure gastrointestinal bleeding: diagnosis by video capsule endoscopy. Clin Gastroenterol Hepatol. 2012 Nov;10(11):89-90
9. Swain P, Adler D, Enns R. Capsule endoscopy in obscure intestinal bleeding. Endoscopy 2005; 37: 655-659
10. Gupta R, Reddy DN. Capsule endoscopy: Current status in obscure gastrointestinal bleeding. World J Gastroenterol. 2007 Sep 14;13(34): 4551-4553
11. Pennazio M. Small-intestinal pathology on capsule endoscopy: spectrum of vascular lesions. Endoscopy. 2005; 37: 864-869
12. Freedman A, Aster, J. Epidemiology, clinical manifestations, pathologic features, and diagnosis of diffuse large B cell lymphoma, disponível em http://www.uptodate.com/contents/epidemiology-clinical-manifestations-pathologic features-and-diagnosis-of-diffuse-large-b-cell-lymphoma (Consultado a 31 de julho de 2013)
13. Freedman A. Management of gastrointestinal lymphomas, disponível em http://www.uptodate.com/contents/management-of-gastrointestinal-lymphomas (Consultado a 31 de julho de 2013)
14. Boot H. Diagnosis and staging in gastrointestinal lymphoma. Best Pract Res Clin Gastroenterol. 2010 Feb;24(1):3-12
15. Kim SJ, Kang HJ, Kim JS, Oh SY, Choi CW, Lee SI, et al. Comparison of treatment strategies for patients with intestinal diffuse large B-cell lymphoma: surgical resection followed by chemotherapy versus chemotherapy alone. Blood. 2011 Feb 10;117(6):1958-65






