Introdução
A pneumonia organizativa é um padrão histopatológico encontrado em múltiplas doenças pulmonares, algumas de etiologia identificável, outras não. De entre as causas conhecidas de pneumonia organizativa temos as doenças infecciosas, doenças do tecido conjuntivo e a iatrogenia. Os casos em que não é possível determinar a causa, denominam-se de Pneumonia Organizativa Criptogénica (POC), sendo este um diagnóstico de exclusão1.
Os agentes infecciosos envolvidos são variados, incluindo bactérias, vírus, parasitas e fungos, responsáveis pelo desencadear de um processo inflamatório descontrolado, mesmo após o seu desaparecimento1.
No que diz respeito à pneumonia organizativa iatrogénica, esta pode ser secundária a drogas ou radiação1. Aquela que se desenvolve após radiação tem sido descrita em doentes com carcinoma da mama submetidas a radioterapia2-9, no entanto, os mecanismos envolvidos neste processo não são totalmente conhecidos, apesar de se teorizar que possam ser imuno-mediados2,3.
A incidência da pneumonia organizativa após radioterapia ronda os 1,8-2,5% em três séries de doentes com carcinoma da mama submetidas a radioterapia após cirurgia4-6. Os sintomas são inespecíficos (tosse não produtiva, febre, mal-estar, fadiga, dispneia e perda de peso)1-3, surgindo 9 a 16 meses após radioterapia, afectando doentes com idade média de 60 anos1.
Ao contrário da clínica, as alterações radiológicas desta entidade são características, com opacidades alveolares periféricas, consolidativas ou em “vidro despolido”. Na maioria dos casos, numa fase inicial, surgem no pulmão irradiado, assumindo posteriormente um padrão migratório com atingimento de ambos os campos pulmonares1-2.
As provas funcionais respiratórias frequentemente apresentam alterações restritivas ligeiras a moderadas, com limitação proporcional da difusão de monóxido de carbono (DLCO). Em muitos doentes também é detetada hipoxemia arterial, com esforço ou em repouso1,2.
A biopsia pulmonar revela as características histológicas da pneumonia organizativa, isto é, proliferação excessiva de tecido de granulação nas pequenas vias aéreas, ductos alveolares e espaços aéreos, associada a inflamação crónica dos alvéolos subjacentes1,2.
O tratamento da pneumonia organizativa após radioterapia consiste em corticoterapia, permitindo uma rápida recuperação clínica e resolução radiológica, sem sequelas significativas1-2,7, ao contrário do que acontece na pneumonite rádica onde se encontram consolidações retrácteis associadas a bronquiectasias de tracção1. No entanto, com a redução ou suspensão da corticoterapia a recorrência é comum, acometendo cerca de 65% dos doentes, mas geralmente com boa resposta ao reinício de tratamento com corticoide1,7,8. Contudo, a duração e dose do tratamento a utilizar ainda não foi estabelecida, sendo que alguns autores defendem o uso de uma dose inicial de 0,75 a 1,5mg/Kg/dia, com diminuição progressiva nas semanas subsequentes, até um ano de tratamento1,8.
Caso clínico
Mulher de trinta e sete anos, internada por pneumonia adquirida na comunidade à direita, com hipoxemia, sem resposta à terapêutica em ambulatório.
Na anamnese a doente referia tosse não produtiva, toracalgia direita e dispneia para pequenos esforços com início cerca de duas semanas antes da admissão, motivo pelo qual já havia sido medicada com levofloxacina 750mg/dia em ambulatório. No entanto, quatro dias após início do antibiótico, desenvolveu febre (38,5ºC), astenia, anorexia e agravamento da dispneia, agora em repouso.
Dos antecedentes pessoais a referir carcinoma ductal invasor da mama direita, sem evidência de recidiva, para o qual fez quimioterapia neoadjuvante (adriamicina/ciclofosfamida) e adjuvante (paclitaxel semanal), mastectomia direita e radioterapia adjuvante (terminou tratamentos três meses antes do início da sintomatologia). Negava hábitos tabágicos e contacto com animais. Trabalhava como costureira e residia em habitação própria, com saneamento e água da rede pública. Sem antecedentes familiares de relevo.
À admissão apresentava-se apirética e hemodinamicamente estável, mas polipneica (frequência respiratória 30 ciclos por minuto). À auscultação pulmonar com murmúrio vesicular presente bilateralmente, mas diminuído à direita, e crepitações na metade inferior do hemitórax direito.
Radiologicamente apresentava hipotransparência na metade inferior do hemitórax direito e analiticamente insuficiência respiratória hipoxémica (paO2 61mmHg, FiO2 0,21), anemia normocítica normocrómica (11,2g/dL) e proteína C reactiva aumentada (24,85mg/dL), mas sem leucocitose (8.200 Leuc/uL).
Iniciou antibioterapia (piperacilina/tazobactam 4,5g 8/8h e amicacina 1g 24/24h), enquanto se completava estudo. No entanto, a doente manteve-se febril e com agravamento radiológico constatado em tomografia computorizada (TC) torácica - áreas de densificação em “vidro-despolido” e de consolidação com broncograma aéreo que envolviam todos os lobos pulmonares direitos, de predomínio periférico (Fig. 1a) - sendo colocada a hipótese de pneumonite rádica.
Fez broncofibroscopia, sem alterações morfológicas, estruturais ou anatómicas, com lavado bronco-alveolar sem evidência de infecção ou neoplasia. Serologias (VIH, VHB, VHC, Paul-Bunnel, Waaler Rose, VDRL, Widal, Wright), estudo imunológico, prova de Mantoux e marcadores tumorais negativos. Hemoculturas (aeróbios e anaróbios) e cultural de expectoração (bactérias, fungos, Ziehl-Neelsen) estéreis.
Nesta fase, assumiu-se o diagnóstico de pneumonite rádica, iniciando corticóide (1mg/Kg/dia), com melhoria sintomática e radiológica, tendo alta medicada e orientada para consulta externa.
Na consulta repetiu TC, ainda a fazer corticóide, que revelou discreta densificação em “vidro despolido” envolvendo os lobos superior e inferior direitos, traduzindo provável pneumonite já praticamente resolvida (Fig. 1b), pelo que iniciou desmame progressivo, após um mês de terapêutica.
Cerca de duas semanas após suspensão da terapêutica recorreu à consulta por agravamento da tosse seca, dispneia, anorexia e cansaço fácil. Auscultatoriamente apresentava murmúrio vesicular preservado bilateralmente, mas com crepitações dispersas. Analiticamente mantinha-se sem leucocitose, mas com anemia (11,3 g/dL), e gasometricamente com insuficiência respiratória hipoxémica (paO2 66mmHg, FiO2 0,21). Realizou TC torácica que evidenciou várias consolidações com broncograma aéreo e infiltrados em "vidro despolido", bilaterais e atingindo praticamente todos os lobos pulmonares (Fig. 1c).
Face às alterações radiológicas e antecedentes de radioterapia, foi colocada a hipótese de pneumonia organizativa após radioterapia, tendo-se realizado biópsia pulmonar cirúrgica que revelou infiltrado inflamatório linfoplasmocitário intersticial, com alguns agregados linfoides, hiperplasia de pneumócitos e, nos espaços alveolares, material fibrinóide e infiltrado inflamatório polimórfico, lesões características de pneumonia organizativa (Fig. 2). Estas alterações repercutiram-se na função pulmonar com o desenvolvimento de um síndrome ventilatório restritivo moderado, com diminuição ligeira da difusão de monóxido de carbono (Capacidade Vital Forçada 69%, DLCO 79.8%).
Iniciou então corticoterapia que manteve durante um ano (primeiros três meses com prednisolona 1mg/Kg/dia, com posterior desmame lento), apresentando melhoria clínica e resolução radiológica (Fig. 1d). Atualmente mantém-se assintomática e sem necessidade de tratamentos subsequentes.
Conclusão
A radioterapia causa lesão pulmonar que pode resultar em pneumonite e/ou fibrose. A pneumonite ocorre 4 a 12 semanas após exposição, e é caracterizada pelo desenvolvimento insidioso de tosse seca, dispneia, toracalgia, febre e fadiga, identificando-se, na radiografia torácica, opacidades alveolares restritas ao local irradiado. As lesões ligeiras podem resolver sem tratamento, no entanto, as mais graves geralmente evoluem para fibrose, 6 a 12 meses após o tratamento3,10-12.
A clínica da pneumonia organizativa após radioterapia é semelhante à da pneumonite rádica, no entanto, os aspectos radiológicos e prognóstico são distintos. Radiologicamente é caracterizada por infiltrados pulmonares bilaterais, e geralmente migratórios, e o tratamento consiste em corticoterapia de longa duração, culminando na resolução das alterações radiológicas, sem sequelas pulmonares, mas com elevado risco de recorrência1-2,7,8. Nestes aspectos a pneumonia organizativa após radioterapia assemelha-se mais à POC do que à pneumonite rádica1-2.
Nesta doente cumpriram-se os critérios definidos por Crestani B et al2 para pneumonia organizativa após radioterapia, isto é, radioterapia por carcinoma mamário nos 12 meses prévios, sintomas gerais e inespecíficos com mais de 2 semanas de evolução, infiltrados pulmonares para além da área irradiada (bilaterais) e ausência de outra causa específica identificável (exclusão de doença infecciosa e sistémica). Foi ainda possível confirmar histologicamente o padrão de pneumonia organizativa.
Casos de pneumonia organizativa após radioterapia para carcinoma mamário têm sido descritos na literatura internacional desde 19952--9, sempre com boa resposta à corticoterapia, apesar do elevado risco de recorrência7.
A doente apresentada mantém-se assintomática e sem alterações radiológicas após a suspensão da corticoterapia, no entanto, o seu seguimento é mandatório face ao risco de recorrência.
Este caso vem relembrar que nos doentes com antecedentes de radioterapia, a presença de infiltrados pulmonares, unilaterais ou bilaterais, obriga à inclusão de pneumonite rádica e pneumonia organizativa após radioterapia no diagnóstico diferencial.Figura I
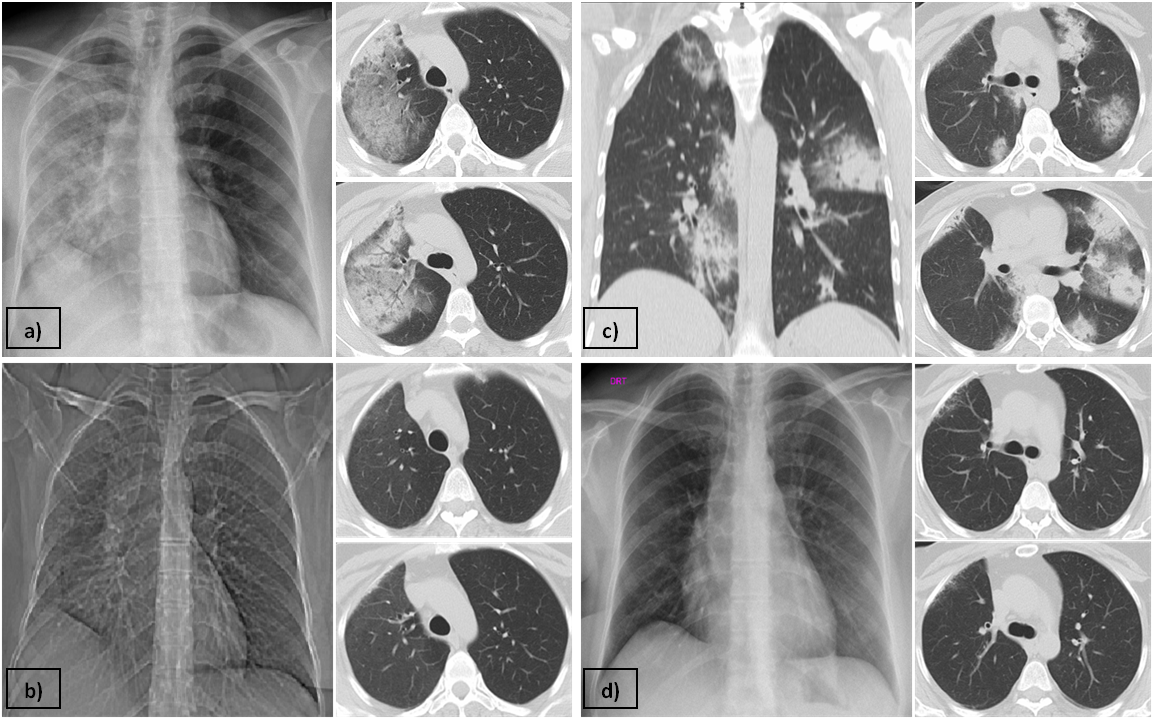
TC torácicas realizadas durante o internamento: a) Primeira TC com áreas de densificação em “vidro-despolido” e de consolidação com broncograma aéreo envolvendo todos os lobos pulmonares direitos, de predomínio periférico (natureza infeciosa/pneumonite rádica), associando-se a ligeiro desvio homolateral do mediastino. b) TC realizada após início de corticoterapia apresentou discreta densificação em “vidro despolido” envolvendo o LSD e LID e densificação adjacente da pleura, com algumas bronquiectasias associadas (provável pneumonite rádica praticamente resolvida). C) TC após suspensão de corticoterapia revelou várias consolidações e infiltrados em “vidro despolido” com broncograma aéreo, bilateralmente e atingindo praticamente todos os lobos (processo inflamatório/infeccioso). d) TC após reinício de corticoterapia apresentou opacidades retículo-nodulares a nível do LMD justa-pleurais (fibrose devido a radioterapia prévia). Sem imagens nodulares visíveis a nível do parênquima pulmonar.
Figura II
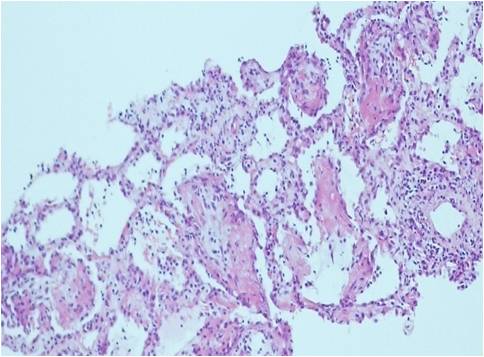
Histologia do fragmento de biópsia pulmonar cirúrgica revelou infiltrado inflamatório de predomínio linfoplasmocitário, com alguns agregados linfoides, no interstício, hiperplasia de pneumócitos e material fibrinóide e infiltrado inflamatório polimórfico nos espaços alveolares.
BIBLIOGRAFIA
1. Cordier JF. Cryptogenic organising pneumonia. Eur Respir J 2006; 28: 422–446.
2. Crestani B, Valeyre D, Roden S, et al. Bronchiolitis obliterans organizing pneumonia syndrome primed by radiation therapy to the breast. Am J Respir Crit Care Med 1998; 158: 1929–1935.
3. Isobe K, Uno T, Kawakami H, et al. A Case of Bronchiolitis Obliterans Organizing Pneumonia Syndrome with Preceding Radiation Pneumonitis after Breast-conserving Therapy. Jpn J Clin Oncol 2004; 34(12): 755–758.
4. Takigawa N, Segawa Y, Saeki T, et al. Bronchiolitis obliterans organizing pneumonia syndrome in breast conserving therapy for early breast cancer: radiation induced lung toxicity. Int J Radiat Oncol Biol Phys 2000; 48: 751–755.
5. Miwa S, Morita S, Suda T, et al. The incidence and clinical characteristics of bronchiolitis obliterans organizing pneumonia syndrome after radiation therapy for breast cancer. Sarcoidosis Vasc Diffuse Lung Dis 2004; 21: 212–218.
6. Ogo E, Komaki R, Fujimoto K, et al. A survey of radiation-induced bronchiolitis obliterans organizing pneumonia syndrome after breast conserving therapy in Japan. Int J Radiat Oncol Biol Phys 2008; 71: 123-131.
7. Stover DE, Milite F, Zakowski M. A newly recognized syndrome: radiation-related bronchiolitis obliterans and organizing pneumonia. A case report and literature review. Respiration 2001; 68: 540–544.
8. Fumagalli G, Sanguinetti CM . Cryptogenic organizing pneumonia after radiotherapy for breast cancer. Multidisciplinary Respiratory Medicine 2010; 5(6): 432-436.
9. Bayle JY, Nesme P, Bejui-Thivolet F, Loire R, Guerin JC, Cordier JF. Migratory organizing pneumonitis ‘‘primed’’ by radiation therapy. Eur Respir J 1995; 8: 322–326.
10. Rosiello RA, Merrill WW. Radiation-induced lung injury. Clin Chest Med 1990; 11(1): 65-71.
11. Abid SH, Malhotra V, Perry MC. Radiation-induced and chemotherapy-induced pulmonary injury. Curr Opin Oncol 2001; 13(4): 242-248.
12. Akita K, Ikawa A, Shimizu S, et al. Criptogenic Organizing Pneumonia After Radiotherapy For Breast cancer. Breast Cancer 2005; 12(5): 243-247.

