Introdução
Os timomas são os tumores mais frequentes do mediastino anterior, cerca de 20%, com incidência de 0,15 casos por cada 100.000 habitantes1. Apresenta-se tipicamente de uma de três formas: 1) incidentaloma em doente assintomático, 2) sintomas locais torácicos ou 3) durante investigação de síndrome paraneoplásico (SP). Os SP incluem a miastenia gravis, lúpus eritematoso sistémico (LES), aplasia pura da série vermelha, anemia aplástica. No entanto as dermatoses são raras. Quadro de imunodeficiência com infecções de repetição, síndrome de Good (SG), também tem sido observado. O desafio clínico do tratamento do timoma reside na possibilidade de surgir simultâneamente doença autoimune e imunodeficiência. A associação de SG com pênfigo vulgar é extremamente rara com apenas um caso descrito previamente na literatura2.
Caso clínico
Mulher de 58 anos de idade, com vários episódios de candidíase oral desde há cerca de 1 ano, tendo efectuado múltiplas terapêuticas antifúngicas sem remissão do quadro. Recorre ao serviço de urgência por apresentar placas esbranquiçadas no dorso e bordo lateral da língua associada a odinofagia. Nega disfagia, febre, suores nocturnos, dispneia, perda ponderal, alterações do trânsito gastrointestinal ou genitourinário. Sem hábitos tabágicos, alcoólicos ou medicamentosos à excepção dos antinfúngicos. Ao exame objectivo destaque apenas para placas brancas aderentes e dispersas na mucosa oral, sem adenopatias cervicais ou axilares palpáveis. A doente é internada para estudo de candidíase oral recorrente.
O estudo inicial consistiu na realização de avaliação analítica com HbA1C, serologias víricas com VIH e RPR, electroforese de proteínas, estudo imunológico e radiografia torácica. A endoscopia digestiva alta permitiu excluir candidíase esofágica.
A presença na radiografia torácica de uma hipotransparência no mediastino anterior motivou um pedido de TC cervico-toraco- abdominal que revelou uma grande lesão sólida mediastínica da loca tímica, lobulada com 11 cm de diâmetro, sem adenopatias ou hepatoesplenomegalia (fig. 1 e 2).
Entretanto até à realização da biópsia da massa foram pedidos alguns marcadores biológicos para diagnóstico e follow-up tais como catecolaminas e seus produtos de degradação, hormona adrenocorticotrópica, função tireóideia, calcemia e PTH, β2 Microglobulina, α-fetoproteina e β-HCG. Resultados dentro dos valores de referência.
Laboratorialmente a destacar hipogamaglobulinemia 0,64g/dl com diminuição de IgG (680 mg/dl), linfopenia CD19+ e ANAs e antidsDNA positivos com consumo de complemento (tabela1).
Foi efectuada biópsia aspirativa da massa ecoguiada cujo resultado histológico revelou neoplasia com áreas de células fusiformes e áreas células redondas com escasso citoplasma, imunorreativas para CK 8/18 e em proporções variáveis para CK 19, EMA e CD 20, compatível com timoma com áreas tipo AB.
O estadiamento neste tipo de tumores é pós cirúrgico para correcta avaliação da invasão da cápsula3. Sendo assim, a doente foi submetida a timectomia total. A peça histológica revelou timoma encapsulado tipo AB com invasão focal da cápsula, sem invasão do tecido adjacente, com estadiamento Masaoka IIA.
Perante um caso de timoma com hipogamaglobulinemia associado a candidíase oral recorrente admite-se o SG e após timectomia inicia pulsos de imunoglobulina endovenosa (IGIV) (400 mg/Kg/mês) e fluconazol 200 mg oral durante 2 semanas. Constata-se desaparecimento das lesões orais após o 2º ciclo de IGIV com subida de IgG. Ao 3º mês aparecimento de lesões vesiculares exuberantes dolorosas não pruriginosas no palato, mucosa lingual e no local da esternotomia, com sinal de Nikolsky positivo (fig. 3). O exame histopatológico revela acantólise suprabasal com formação de vesícula intraepidérmica e a imunofluorescência directa revela presença de depósitos reticulares de IgG e C3 na camada inferior da epiderme compatível com o diagnóstico de Pênfigo Vulgar (PV) (fig. 4). Inicia tratamento de remissão com corticoterapia oral na dose de 1mg/Kg/d durante 1 mês com melhoria franca das lesões. Após um ano de follow up, necessidade de realizar azatioprina e posteriormente micofenolato de mofetil associado a corticoterapia para controlo da sintomatologia.
Discussão
A associação de imunodeficiência e timoma foi pela primeira vez reconhecida em 1954 por Robert Good4. Nos últimos anos tem sido documentado em 40% dos timomas uma forte associação com síndromes paraneoplásicos, nomeadamente miastenia gravis, hipogamaglobulinemia, pênfigo vulgar e neoplasias como linfoma não Hodgkin ou carcinoma colorectal5. A hipogamaglobulinemia ocorre em menos de 5% dos casos, a maioria mulheres, no entanto em cerca de 10% dos casos de hipogamaglobulinemia adquirida têm um timoma associado6. No caso apresentado a presença da tríada candidíase oral recorrente, massa mediastínica anterior e hipogamaglobulinemia alertou para o diagnóstico do SG. O SG é uma entidade rara e subdiagnosticada talvez pela falta de critérios de diagnóstico e testes genéticos actualmente validados. Define-se pela associação do timoma, geralmente do tipo fusocelular, com imunodeficiência por déficit de células B, hipogamaglobulinemia e imunidade celular. A sua apresentação habitual é a partir dos 40 anos, não existe predomínio de sexo e em 80% dos casos surge 5 anos após o diagnóstico de timoma.
A hipogamaglobulinemia, história de infecções oportunísticas como CMV ou candidíase mucocutânea, infecções sinopulmonares recorrentes são factores de alerta para SG. Em relação ao caso apresentado a recorrência de uma infecção oportunística como a candidíase oral associado a um défice de IgG e linfócito B CD19+, embora com valores de linfócitos T CD 4+ e CD8+ e resposta mitótica normais, pareceu-nos enquadrar-se no diagnóstico da imunodeficiência combinada – humoral e celular. Reflexão será necessária para interpretar a positividade dos ANAs e antidsDNA. A doente actualmente não cumpre critérios para LES, no entanto existem casos descritos de LES e timoma7. Durante o follow up a doente mantém-se clinicamente sem critérios de LES e com os títulos de anticorpos a descer.
Os doentes com SG apresentam infecções recorrentes por bactérias encapsuladas, fungos e vírus, como resultado de defeitos na imunidade celular e humoral. O primeiro caso de associação de timoma com pênfigo vulgar foi descrito em 1964 por Kough8. Desde esta altura o número de casos relatados têm vindo a aumentar. Takeshita9 apresentou um caso de pênfigo foliáceo e timoma. As lesões cutâneas e o anticorpo anti-desmogleina 1 melhoraram após timectomia. O PV é uma doença auto-imune rara, potencialmente fatal, que atinge pele e mucosas, caracterizada pela presença de anticorpos do tipo IgG dirigidos a proteínas de adesão epidérmicas, as desmogleínas 1 e 3, resultando na perda de adesão celular entre os queratinócitos. Os doentes desenvolvem erosões ou bolhas flácidas nas mucosas e/ou na pele. Cerca de 90% dos doentes têm envolvimento oral. A realização de pressão na pele aparentemente normal próxima à lesão induz ao descolamento epidérmico (sinal Nikolsky) que indica actividade da doença. O diagnóstico de PV, no nosso caso, foi sugerido pelo sinal Nikolsky positivo mas confirmado pelo exame histológico com acantólise suprabasal e pela imunofluorescência directa que demonstrou depósitos IgG e complemento na superfície dos queratinócitos em toda a epiderme. Não foi realizado o teste de ELISA para doseamento das desmogleínas. Com o aparecimento de lesões de pênfigo na mucosa oral admitiu-se a possibilidade da candidíase oral ter “camuflado” uma manifestação anterior de PV. Sendo assim, uma biópsia da mucosa oral numa fase inicial poderia ter conduzido a um diagnóstico mais precoce.
A presença simultânea de um quadro de imunodeficiência e de auto imunidade levou-nos a investigar na literatura esta associação curiosa. Actualmente sabe-se que o timo desempenha um papel crucial na imunidade celular ao produzir linfócitos T funcionais e ao induzir a tolerância do self, através do balanço entre a produção das células T efectoras e reguladoras. A associação de doença auto-imune, neoplasias e status de imunodeficiência com o timoma sugere que existe concomitantemente defeitos na imunidade celular. O exacto mecanismo que explica o fenómeno de autorreactividade associado ao timoma ainda se mantém por explicar, no entanto atribuiu-se actualmente ou à auto-indução das células T no tecido do timo anormal ou à supressão das células T reguladoras que controlam a auto-imunidade10.
A timectomia é o tratamento recomendado sendo a ressecção completa um dos mais importantes factores prognósticos. O prognóstico de sobrevivência aos 5 anos varia de 96% para o estádio I, 86% para o estádio II, 69% para o estádio III e 50% para o estádio IV. Enquanto na miastenia gravis a timectomia tem efeito curativo, no SG não resolve as alterações imunológicas inerentes11. Em alguns casos poderá mesmo agravar a hipogamaglobulinemia. A utilização de IGIV tem melhorado outcomes por reduzir as infecções em 37,5%, as hospitalizações e diminuição da utilização de antibioterapia.
O prognóstico do SG é pior do que a agamaglobulinemia ligada ao X (ALX) e a imunodeficiência comum variável (ICV). Enquanto 70% dos SG sobrevivem aos 5 anos de diagnóstico, nos ALX e CVID sobrevivem 100%. As principais causas de morte foram atribuídas às infecções, doenças auto imunes ou complicações hematológicas. O timoma só por si não foi considerado a causa do excesso da mortalidade12.
Este caso é um exemplo da diversidade de manifestações paratímicas com presença simultânea de autoimunidade e imunodeficiência. Este parece ser apenas o segundo caso que reflecte a tríade timoma, hipogamaglobulinemia e pênfigo vulgar1.
Quadro I
Exames complementares de diagnóstico
| Hemograma | |
| Hemoglobina (g/dl) | 14,1 |
| VGM/HGM (fL) | 95,2/30,2 |
| Leucócitos (x10⁹/L) | 9,06 |
| Neutrófilos (%) | 74,7 |
| Linfócitos (%) | 19 |
| Plaquetas (x10⁹/L) | 227 |
| Bioquímica | |
| VS (mm) | 37 |
| Glucose (mg/dl) | 98 |
| Ureia/creatinina (mg/dl) | 25/0,69 |
| Na+, K+, Cl⁻ (mmol/l) | 147/4,5/105 |
| AST/ALT/GGT (U/L) | 15/14/12 |
| PCR (mg/dl) | 0,110 |
| Electroforese de proteinas | |
| Albumina | 4,0 |
| Alfa 1 (g/dl) | 0,51 |
| Alfa 2 (g/dl) | 0,77 |
| Beta 1 (g/dl) | 0,48 |
| Beta 2 (g/dl) | 0,23 |
| Gama (g/dl) | 0,64 |
| Autoimunidade | |
| ANA | + até diluição de 1/320 |
| Ac. anti-DS-DNA | 731 UI/mL |
| ENA (SSA,SSB,SM, RNPSM,HS70,JO1) | - |
| AMA/ASMA/Anticoagulante lúpico | - / -/- |
| C3 | 70 |
| C4 | 12 |
| CH50 | 54,6 |
| Serologias | |
| Anti-VIH 1/2 | - |
| AgHBs/Anti-HBs | -/- |
| AgHBe/Anti-HBe | -/- |
| Anti-HBc IgM | - |
| Anti-VHC | - |
| RPR | - |
| Doseamento de Imunoglobulinas | |
| IgG (mg/dl) | 680 |
| IgA (mg/dl) | 207 |
| IgM (mg/dl) | 166 |
| K (mg/dl) | 666 |
| L (mg/dl) | 456 |
| K/L | 1,46 |
| Cadeias Leves Livres K | 8,3 |
| Cadeias Leves Livres L | 13,2 |
| Imunofenotipagem | |
| Linfócitos CD3 + | 85,0 % |
| Linfócitos T CD4+ | 48,4 % |
| Linfócitos T CD8+ | 25,5 % |
| Linfócitos CD19+ | 3,1 % |
| Linf. CD3 – CD56+ | 8,5 % |
Figura I
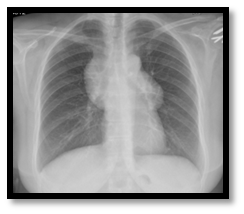
Teleradiografia torácica postero anterior com alargamento do mediastino.
Figura II
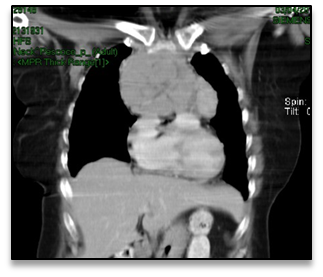
TAC torácico com massa mediastínica da loca tímica, com diâmetro transversal de 11cm
Figura III
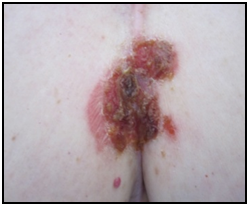
Lesões eritematocrostosas no local da esternotomia
Figura IV
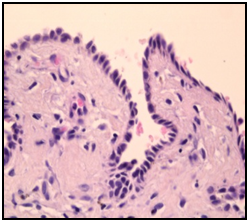
Acantólise suprabasal com formação de vesícula intraepidérmica
BIBLIOGRAFIA
1) E.A. Engels, R.M. Pfeiffer, Malignant thymoma in the United States: demographic patterns in incidence and associations with subsequent malignancies, Int. J. Cancer 105 (2003) 546–551.
2) Safai B, Gupta S, Good RA. Pemphigus vulgarisassociated with a syndrome ofimmunodeficiencyandthymoma: a case report. Clin Exp Dermatol. 1978 Jun;3(2):129-34
3) Kim DJ, Yang WI, Choi SS, et al. Prognostic and clinical relevance of the World Health Organization schema for the classification of thymic epithelial tumors: a clinicopathologic study of 108 patients and literature review. Chest 2005; 127:755.
4) Good RA. Agammaglobulinaemia—a provocative experiment of nature.Bulletin of the University of Minnesota 1954;26:1–19
5) Engels EA (2010) Epidemiology of thymoma and associated malignancies. J Thorac Oncol 5(10 suppl 4):S260–S265
6) Masaoka A, Hashimoto T, Shibata K, et al. Thymomas associated with pure red cell aplasia. Histologic and follow-up studies. Cancer 1989; 64:1872.
7) Mevorach D, Perrot S, Buchanan NM, Khamashta M, Laoussadi S, Hughes GR,et al. Appearance of systemic lupus erythematosus after thymectomy: four case reports and review of the literature.Lupus1995;4:33–7
8) Kough, R. H. and Barnes, W. T. (1964). Thymoma associated with erythroid aplasia, bullous skin eruption and the LE cell phenomenon, a report of a case. Annals of Internal Medicine, 61, 308.
9) Takeshita K, Amano M, Shimizu T, Oyamada Y, Abiko T, Kobayashi K, et al. Thymoma with pemphigus foliaceus. Intern Med.2000;39:742–7.
10) Pennington DJ, Silva-Santos B, Silberzahn T et al (2006) Early events in the thymus affect the balance of effector and regulatory T cells. Nature 444:1073–1077
11) Souadjian JV, Enriquez P, Silverstein MN, et al. The spectrum of diseases associated with thymoma: coincidence or syndrome. Arch Intern Med. 1974; 134:374–379
12) Hermaszewski RA, Webster AD. Primary hypogammaglobulinaemia: a survey of clinical manifestations and complications. Q J Med 1993;86:31–42

