Introdução
A hipertensão arterial pulmonar (HAP) associada à infecção pelo vírus da imunodeficiência humana (VIH) é uma complicação rara, com uma prevalência de 0,5%,1,2,3,4 mas importante dado incidir 6 a 25 vezes mais nesta população3,4 sem depender do grau de imunodepressão 2,3,4,5 ou da fase de infecção,2,6 sendo que o papel da terapêutica anti-retroviral (TARV) é ainda controverso.3,4,7,8
Esta associação foi documentada pela primeira vez em 1987 por Kim e Factor4,5,6,9 e encontra-se no primeiro grupo da classificação de Evian-Veneza (Figura I).1,10,11
O tempo de instalação é cerca 27 meses após o diagnóstico da infecção viral, afectando jovens, com idade média de 33 anos,3,5 e 1,5 a 5 vezes mais o sexo masculino2,4,5,6 (ao contrário da hipertensão pulmonar (HTP) primária que predomina nas mulheres).6 A taxa de mortalidade é também mais elevada neste grupo de doentes,5,12 sendo a HAP um preditor independente de morte. A sobrevida média é muito variável nos diversos estudos e depende da classe funcional da New York Heart Association (de 84% a 3 anos nas classes I e II até 28% a 3 anos nas classes III e IV).1,3,4 Em Portugal os dados relativos à sua prevalência são escassos.
O seu mecanismo fisiopatológico, embora desconhecido, parece estar relacionado com a persistente activação imune1 e é atribuído um papel às proteínas virais TAT (Transactivador transcripcional), glicoproteina GP120 e Nef (Factor regulador negativo),3,5,12 conduzindo, no seu conjunto, às lesões plexiformes vasculares características da HAP grave.5 Factores do hospedeiro como determinados alelos relacionados com antigénios de histocompatibilidade de classe II (DR52 e DR6) e certas citocinas, podem ter também um papel etiológico.3,5,6
Para o diagnóstico é necessária a exclusão de outras causas, nomeadamente de patologia cardíaca esquerda, pulmonar, tiroideia, auto-imune, trombo-embolismo crónico e anemia.1,6,10 É importante relembrar que alguns fármacos da TARV (ritonavir, indinavir,lamivudina, abacavir e atazanavir)7 e outras condições muitas vezes associadas (infecção pelos vírus da Hepatite B e C e o uso de algumas drogas) podem causar HTP.1,3,4,6
A instituição de TARV apenas pela presença de HAP com o objectivo de protelar a progressão da patologia pulmonar em doentes sem outros critérios para início de terapêutica antiretrovírica é ainda um tema controverso.3,4,5,6,11
Caso Clínico
Mulher de 41 anos, solteira, caucasiana, funcionária num lar, com co-infecção VIH1-VHC (genotipo 1) conhecida desde 1999, sob TARV (lopinavir/ritonavir, didanosina e lamivudina) com boa adesão terapêutica, sem internamentos prévios. Salienta-se o uso de drogas endovenosas no passado, tabagismo mantido (22 UMA) e síndrome depressiva sob terapêutica com paroxetina. Em fim de Março de 2012 iniciou quadro de tosse produtiva, febre e dispneia de esforço de agravamento progressivo. Após resposta parcial à antibioterapia efectuada durante 7 dias (amoxicilina + ácido clavulânico e claritromicina) manteve queixas de tosse seca, cansaço e dispneia em repouso. Epidemiolgicamente sem história de sintomatologia semelhante em contactos próximos, viagens recentes ou convivência com animais domésticos. A meio de Maio de 2012, por toracalgia pleurítica, recorreu ao Serviço de Urgência onde realizou gasometria arterial (com hipoxémia isolada de 63 mmHg) e Ecocardiograma com dilatação das cavidades cardíacas direitas e HTP grave. Teve alta com prescrição de oxigenoterapia domiciliária. Duas semanas depois, a 28 de Maio de 2012, foi internada electivamente para investigação etiológica do quadro. À admissão apresentava-se vigil, colaborante, corada, anictérica e hidratada. Eupneica em repouso sem aporte de oxigénio. TA 109/78mmHg, FC 73bpm, TT 35.9ºC, SpO2 98%. IMC 18.6Kg/m2, perímetro abdominal 79cm. Tiróide palpável sem alterações, lesões de Herpes labial, ausência de algumas peças dentárias, sem sinais de candidíase oral. Sem adenopatias periféricas. Auscultação cardíaca com tons rítmicos sem sopros ou extra-tons e pulmonar com murmúrio vesicular globalmente diminuído, sem ruídos adventícios. No abdómen destacava-se esplenomegália de 3cm, indolor, sem sinais de ascite e membros inferiores sem edemas, com sinais de insuficiência venosa superficial. Sem alterações no exame neurológico. Perante o quadro clinico foi inicialmente colocada a hipótese diagnostica de trombo-embolismo pulmonar. Dos exames complementares de diagnóstico realizados, a destacar Hb 12.7g/dl, HTC 37.3%, VGM 88.9fl, HCM 30.2pg, Leucócitos 3.800x10^6/L, sem inversão da fórmula leucocitária, trombocitopenia de 119.000 (valores sobreponíveis aos prévios), VS 90mm, TP 97%, INR 1.0, aPTT 42.0”, D-dímeros 21.0ng/mL (VR<230ng/mL), BNP 54pg/mL (VR<100pg/mL). Glicémia 103mg/dl, Ureia 42mg/dl, Creatinina 0.9mg/dl, uricémia 7.2mg/dl e ionograma sem alterações. Colesterol Total 186mg/dL, Col. HDL 33mg/dL, Col. LDL 85mg/dL, Triglicéridos 341mg/dL. AST 44, ALT 37U/L, Fosfatase alcalina 151U/L, GGT 172U/L, LDH 478U/L, Bilirrubina total 1.1mg/dL, alfa-Fetoproteina 4.87ng/mL, amilasémia de 169U/L. O exame sumário da urina revelou-se inocente. Na electroforese de proteínas revelava 9.3g/dL de proteínas totais com albumina 31.0UI e hipergamaglobulinémia de base larga. O estudo da função tiroideia e de auto-imunidade foram normais. A salientar também: Carga viral VIH 1 <50 cópias/mL (Brunched DNA), CD4+ 397céls(17%), RNA VHC 2x10^6UI/mL (PCR em tempo real). A radiografia torácica apresentava índice cardio-torácico aumentado e ingurgitamento hilar bilateral (Figura II). Electrocardiograma com ritmo sinusal, FC 63bpm, bloqueio incompleto de ramo direito e ondas T invertidas em V3, V4, DII, DIII e aVF (Figura III). A doente realizou Ecografia abdominal que demonstrou marcada hepatomegália (20cm), de ecoestrutura discretamente heterogénea, sem ectasia das vias biliares ou alterações pancreáticas e esplenomegália de 15cm (já documentada previamente), sem ascite. No Ecocardiograma observava-se dilatação das cavidades direitas (área AD 24,56mm), com hipertrofia ventricular, insuficiência tricúspide grave e pressão sistólica da artéria pulmonar (PSAP) 82mmhg, bem como movimento paradoxal do septo. Salienta-se a ausência de alterações das cavidades esquerdas, de derrame pericárdico e uma função sistólica global conservada. A veia cava inferior apresentava-se dilatada e sem colapso. Dos parâmetros estimativos da função ventricular direita destacava-se um índice de excentricidade de 1,5, uma excursão sistólica do anel da tricúspide (ESAT) de 20,9mm e um índice de Tei 0,716, assim como um tempo de aceleração pulmonar 77,36s. NA Angio-Tomografia Computorizada e Tomografia Computorizada Torácica de Alta Resolução (TCAR) apresentava dilatação do tronco da artéria pulmonar (33 e 37mm respectivamente) e do ramo esquerdo, sem trombos visualizados até às artérias segmentares, cardiomegália à custa das cavidades direitas (Figuras IV) e excluindo doença do interstício pulmonar. A Cintigrafia não revelou alterações da ventilação-perfusão pulmonar. Durante o internamento iniciou terapêutica oral com nifedipina 20mg bid, furosemida 40mg e espironolactona 25mg, com alguma melhoria clinica. À data da alta, encontrava-se na classe funcional II da OMS,1,10 tendo sido referenciada à Consulta de HTP para decisão de início de terapêutica. Realizou cateterismo que revelou uma pressão média da artéria pulmonar de52mmHg, débito cardíaco de 3,8L/min e índice cardíaco de 2,60 L/min/m², estimando-se uma pressão de encravamento da artéria pulmonar de 8mmHg. Na prova de reactividade vascular aguda a resposta ao iloprost foi negativa (Quadro I). A doente é actualmente seguida em consulta de Infecciologia e de HTP e, em Outubro 2012, por agravamento, iniciou terapêutica com ambrisentano 5mg/dia, com melhoria sintomática um ano depois, mantendo, no entanto, parâmetros ecocardiográficos sobreponíveis.
Discussão
Perante uma doente com os antecedentes previamente referidos que se apresenta com quadro de dispneia e cansaço de esforço, hipoxémia e sinais indirectos ecocardiográficos de hipertensão pulmonar foram inicialmente investigadas as causas que poderiam estar na sua origem. A angio-TC e a cintigrafia permitiram a exclusão de trombo-embolismo central ou periférico. A TCAR permitiu descartar a hipótese de doença do interstício pulmonar e a dilatação do tronco da artéria pulmonar, de calibre superior a 3cm, comprovou mais uma vez a gravidade da HTP. Foram ainda investigadas outras causas como a doença tiroideia e auto-imune, sendo que a hipótese diagnóstica mais provável era uma HTP secundária à infecção VIH. Apesar da PSAP estimada ser muito elevada, este parâmetro não tem implicação prognóstica. De entre os factores de mau prognóstico apresentados pela doente salientam-se a dilatação grave da artéria pulmonar nos exames imagiológicos, a hiperuricémia, a dilatação auricular direita e disfunção ventricular (estimada pelo Índice de TEI e ESAT) no ecocardiograma, o índice cardíaco inferior a 2L/min/m2 e a pressão na aurícula direita superior a 12mmHg, sendo ainda de referir a negatividade do teste de reactividade vascular.10 Por outro a a doente encontrava-se em classe II da OMS e não apresentava derrame pericárdico, BNP elevado (>180pg/mL), amplitude da onda p>0,25mV ou episódios prévios de síncope, factores estes que se associam a uma diminuição da sobrevida.1,10 O resultado positivo da prova de reactividade vascular aguda é o factor prognóstico mais importante, permite ainda estimar qual a resposta à terapêutica específica para a HAP e se será benéfico a sua implementação.6,5,10
Relativamente à terapêutica farmacológica específica nestes doentes, deverão ser tidas em conta as interacções farmacológicas com a TARV (por exº o sildenafil)3,10,11 e o seu uso ser cauteloso em patologias concomitantes como a doença hepática (bosentano,6,11,12 ambrisentano, sitaxsentano), a cardiopatia esquerda ou doença estrutural pulmonar,10 sendo controverso o papel da anticoagulação.3,5,10
Conclusão
O diagnóstico de HAP-VIH implica um elevado índice de suspeição e deve ser considerado em qualquer doente com infecção VIH que inicia quadro de dispneia.4,5,6,11 Contudo é controversa a recomendação do seu rastreio em todos os doentes, dado a sua incidência ser, apesar de tudo, reduzida.8,10 São necessários mais estudos para compreender até que ponto o grau de imunossupressão ou a carga viral têm implicações prognósticas favoráveis no VIH-HAP para avaliar a necessidade de introdução mais precoce da TARV.
Quadro I
Cateterismo Diagnóstico
| Hemodinâmica | Oximetria |
| Ventrículo Esquerdo 117/8mmHg | Artéria Pulmonar 65% 11,93 vol% |
| Aorta 117/60/82mmHg | Aorta 94,9% 17,42 vol% |
| Aurícula Direita 5mmHg | Resistências: |
| Artéria Pulmonar 90/31/52mmHg | Pulmonar Total 13,68 |
| Ventrículo Direito 90/5mmHg | Artéria Pulmonar 11,58 |
| Débito cardíaco 3,8L/min | Sistémicas 20,26 |
| Índice cardíaco 2,60 L/min/m² |
Figura I

ALK-1: Activin receptor-like Kinase 1 gene, THH: telangiectasia hemorrágica hereditária
Figura II
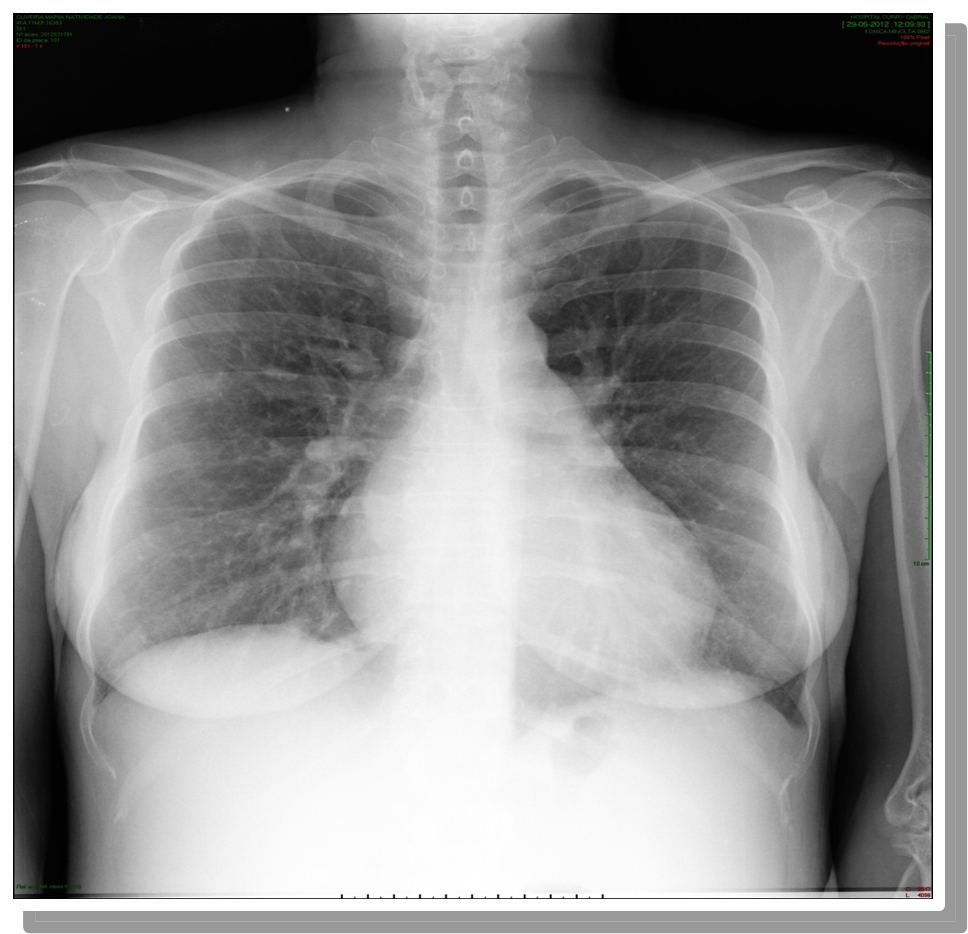
Teleradiografia torácica PA onde se evidencia aumento do Índice Cardio-torácico, com reforço hilar à direita, sem alterações pleuro-parenquimatosas.
Figura III
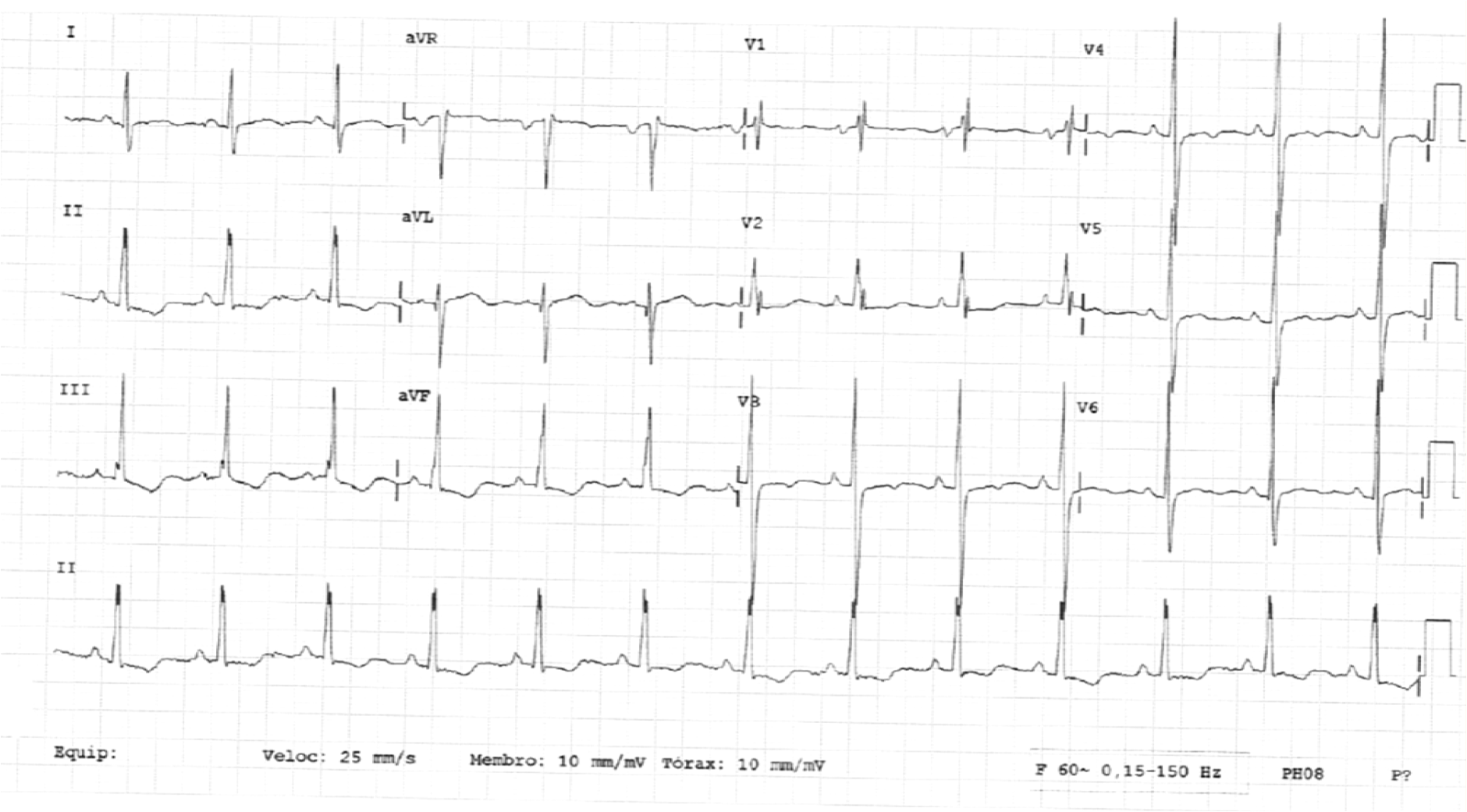
Electrocardiograma com ritmo sinusal, FC63bpm, bloqueio incompleto de ramo direito e ondas T invertidas em V3, V4, DII, DIII e aVF.
Figura IV
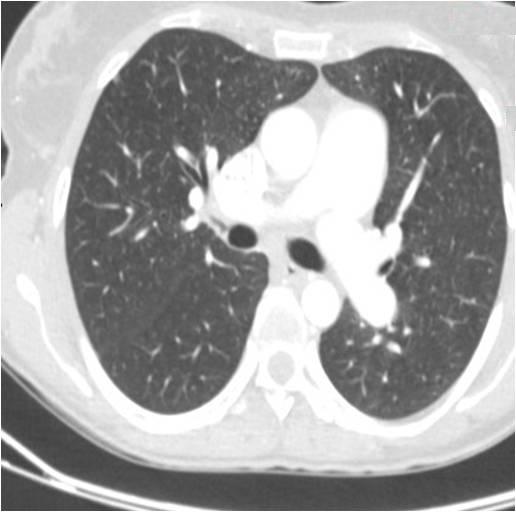
Imagem de Angio-TC Tóracica que revela dilatação da artéria pulmonar esquerda.
BIBLIOGRAFIA
Bibliografia
1. The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Guidelines for the diagnosis and treatment of pulmonary hypertension. European Heart Journal. 2009;30:2493-2537.
2. Speich R, Jenni R, Opravil M, et al. Primary pulmonar hpertension in HIV infection. Chest. 1991; 100:1268-71
3. Mendes A A, Roncal C, Costa V, Japyassu F, Oliveira F, Sepúlveda D, et al. Hipertensão pulmonar associada à síndrome da imunodeficiência adquirida: apresentação de cinco casos e revisão da literatura. Rev Soc Bras Med Trop. 2009 Jul-Ago. 42(4):452-457
4. Sitbon O, Lascoux-Combe C, Delfraissy JF, Yeni PG, Raffi F, De Zuttere D, Gressin V, Clerson P, Sereni D, Simonneau G. Prevalence of HIV-related pulmonary arterial hypertension in the current antiretroviral therapy era. Am J. Resp Crit Care Med 2008;177:108-113
5. Mehta NJ, Khan IA, Mehta RN, Sepkowitz DA. HIV-Related Pulmonary Hypertension: analytic Review of 131 Cases. Chest. 2000;118:1133-1141
6. Petrosillo N, Stefania C. A Hipertensão Arterial Pulmonar nos Pacientes Infectados Pelo HIV, PVRI Review (Portuguese). 2010 Jan-Jul;2(1):42-44
7. Wang X, Chai H, Lin PH, Yao Q, Chen C. Roles and mechanisms of HIV protease inhibitor Ritonavir and other anti-HIV drugs in endothelial dysfunction of porcine pulmonary arteries and human pulmonary artery endothelial cells. Am J Pathol. 2009;174:771-781
8. Marshaleen Henriques-Forsythe M. HIV-Associated Pulmonary Arterial Hypertension, Screening for HIV-associated PAH is important to ensure early intervention; Chest Physician. 2011 Jun; 6(6):16
9. Kim KK, Factor SM. Membranoproliferative glomerulonephritis and plexogenic pulmonary arteriopathy in a homosexual man with acquired immunodeficiency syndrome. Hum Pathology 1987;18:1293-1296
10. Reis A, Rocha N, Barros R, Martins A, Oliveira F, Diogo A, Marinho da Silva A, Alvares S, Shiang T, Castro G, Agapito A. Recomendações para a abordagem clínica do doente com hipertensão pulmonar. Revista da Sociedade Portuguesa de Medicina Interna. 2010 Jan-Mar; 17 Sup 1:5-40.
11. Friese G, Steinmüller M, Ghofrani A. HIV-associated Pulmonary Hypertension. HIV Medicine 2007. 15th Edition. Flying Publisher. 627-635; disponível em: http://www.hivmedicine.com/hivmedicine 2007.pdf
12. Sitbon O, Gressin V, Speich R, et al. Bosentan for the treatment of human immunodeficiency virus-associated pulmonary arterial hypertension. Am J Resp Crit Care Med. 2004;170(11):1212-7

