Introdução
A febre escaro-nodular (FEN) foi descrita pela primeira vez em 1910, por Conor e Bruch, na Tunísia. Designada também por febre exantemática mediterrânica, febre botonosa ou “febre da carraça”, foi identificada em Portugal 20 anos depois, por Ricardo Jorge. A doença é endémica nos países da bacia do Mediterrâneo e sul da Europa, constituindo a rickettsiose mais frequente em Portugal
1. É mais prevalente no Alentejo
2,3, apresentando uma incidência maior nos meses de Junho a Setembro. Os agentes etiológicos responsáveis por esta patologia são duas estirpes do complexo
R. conorii:
R. conorii Malish e
R. conorii Israeli. A FEN é uma doença de notificação obrigatória, mas estima-se que mais de metade dos casos que ocorrem no nosso país não sejam notificados
3. A carraça do cão -
Rhipicephalus sanguineus - é o principal vetor e reservatório de
R. conorii, sendo o Homem um hospedeiro acidental. Após a picada do vetor infectado ocorre uma inflamação no local de inoculação, seguida de necrose - “tache noir”. O período de incubação é de três a sete dias, seguido de uma fase prodrómica que cursa com mialgias, febre, cefaleias, fotofobia, alterações gastrointestinais e exantema maculopapular não pruriginoso, que não poupa a palma das mãos e a planta dos pés. A grande maioria dos doentes tem uma evolução benigna, mas estão descritos óbitos associados a esta patologia
3. O diagnóstico da FEN é habitualmente clínico e baseado nas alterações previamente descritas
4,5,6. Contudo, segundo a Circular Normativa nº3/DSIA de 1999 da DGS, os casos suspeitos devem ter confirmação laboratorial
3. A imunofluorescência indirecta (IFA) é a técnica de eleição na deteção de anticorpos anti-rickettsia e a confirmação do diagnóstico deve ser realizada com base na deteção de seroconversão em duas amostras consecutivas com o intervalo de tempo de 2-3 semanas
8. Para a confirmação de espécie ou da estirpe de rickéttsia envolvida são indispensáveis os testes laboratorias directos, como o isolamento do agente por inoculação em células de cultura in-vitro ou deteção molecular do agente por PCR (reação em cadeia de polimerase). Para além da remoção do vetor, a antibioterapia de primeira linha recomendada é doxiciclina 100 mg 12/12h por via oral durante 7 dias. Os esquemas alternativos incluem a ciprofloxacina, a claritromicina e o cloranfenicol. Os doentes críticos, como por exemplo, com diabetes mellitus, idosos, alcoólicos, neoplasias, défices de glicose 6-fosfato desidrogenase (G6PD), insuficiência cardíaca, renal ou doença hepática crónica, representam cerca de 5 a 6%
7, sendo recomendado tratamento com doxiciclina e.v. numa dose inicial de 200 mg seguidas de 100 mg 12/12h
7.
Caso clínco Os autores descrevem o caso de uma mulher de 30 anos, caucasiana, doméstica, natural do Brasil, residente no Sul de Portugal, que recorreu ao Serviço de Urgência (SU) do Hospital da sua área de residência, em Julho de 2013, por febre e rash cutâneo generalizado. Sem antecedentes pessoais e familiares relevantes, sem hábitos etanólicos, tabágicos ou toxifílicos. Relativamente ao contexto epidemiológico a doente residia num apartamento com saneamento básico, ingeria água da rede e tinha um cão como animal de estimação. Negava qualquer picada de insecto ou carraça. Três dias após ter desparasitado o cão inicia quadro de febre e odontalgia, pelo que recorreu ao dentista, sendo medicada com amoxicilina+ácido clavulâmico e nimesulide. Por iniciativa própria, abandonou o tratamento passados 2 dias, dado o agravamento clínico - rash cutâneo, mialgias, artralgias, náuseas, vómitos e diarreia, que atribuiu a toma do antibiótico. Porém, sem alguma medicação em ambulatório durante 3 dias, agravou o estado geral e a sintomatologia acima citada e a doente recorre ao SU tendo ficado internada. Ao exame objectivo encontrava-se vigil, orientada no tempo e espaço, com parâmetros vitais normais. Sem outras alterações para além do exantema maculo-papular generalizado com envolvimento das palmas das mãos e plantas dos pés, não sendo encontrada escara de inoculação. Analiticamente apresentava hemoglobina de 14 g/dL, leucócitos 3.500/uL, plaquetas 61.000/uL, aspartate aminotransferase 467 U/L, alanina aminotransferase 365 U/L, lactato desidrogenase 1836 U/L, ureia 49 mg/dL, creatinina 1.29 mg/dL, sódio 134 mmol/L, potássio 4.71 mmol/L e proteína C reactiva elevada 261.6 mg/L. Colocada a hipótese diagnóstica de febre escaro-nodular, iniciou doxiciclina 100 mg de 12/12 horas por via oral. Ao segundo dia de internamento o quadro clínico evoluiu com hipotensão, sem resposta aos fluídos, admitindo-se choque séptico com falência multiorgânica. Foi transferida para a Unidade de Cuidados Intensivos (UCI), substituida a doxiciclina oral pela endovenosa e foi associado ceftriaxone 2 gr/dia e.v. Passadas 24 horas, ocorre insuficiência respiratória global com necessidade de ventilação mecânica invasiva e hipotensão severa – instituido suporte aminérgico em dose elevada, posteriormente suspensa ao 5º dia de internamento. Manteve suporte ventilatório durante 10 dias. Por apresentar também oligoanúria e acidose metabólica foi instituída técnica de substituição renal, mantida durante 48 horas. A doente ficou apirética ao 12º dia de UCI, tendo cumprido um total de 21 dias com doxiciclina 100 mg de 12/12 horas (primeiras 24 horas via oral e restante dias endovenoso) e ceftriaxona 2g/dia (5 dias). As culturas revelaram-se negativas. No 4º dia de UCI apresentou quadro de isquémia das mãos e pés, bilateralmente (Figuras 1 e 2). Iniciou alprostadilo, mantendo agravamento da isquemia, com necrose e mumificação. Perante a gravidade do quadro e após avaliação por Cirurgia Plástica, Reconstrutiva e Estética, é transferida para o Serviço de Cirurgia Geral, sendo submetida a posterior amputação electiva (Figuras 3 e 4). A confirmação laboratorial do diagnóstico foi conseguida numa amostra do soro colhida na admissão e enviada para o Centro de Estudos de Vectores e Doenças Infecciosas. Embora não tenham sido detetados anticorpos anti-rickettsia, foi identificada a presença de ADN de rickettsia por PCR. A sequenciação do fragmento amplificado confirmou tratar-se de uma infecção por
Rickettsia conorii estirpe
israeli. A doente teve alta no início de Outubro 2013, sendo referenciada para uma unidade de reabilitação.
Discussão A grande maioria dos doentes tem uma evolução benigna, estando as formas graves relacionadas com a presença de determinadas comorbilidades já citadas anteriormente. No entanto, neste caso em questão, mesmo a doente não apresentar factores de risco, verificou-se uma evolução grave da doença. O diagnóstico é clínico e baseado na tríade clássica - febre, exantema e escara de inoculação (nem sempre presentes), associados a sintomatologia inespecífica como cefaleias, mialgias, artalgias e alterações gastrointestinais. O contexto epidemiológico (época do ano, contacto com cães, atividades ao ar livre) e as alterações analíticas (trombocitopénia; anemia; leucocitose ou leucopénia, aumento das transaminases e bilirrubinas, hiponatrémia, elevação da ureia e creatinina) são uma ferramenta útil para estabelecer um diagnóstico clínico precoce e instituir a terapêutica específica. A ausência de escara de inoculação, de que é exemplo este caso, pode ser um obstáculo para o diagnóstico correto, apesar de história epidemiológica, clínica e as alterações analíticas serem muito sugestivas de febre escaro-nodular. Segundo os estudos realizados em Portugal, na Itália e em Israel, nos doentes com rickettsiose por estirpe
R. conorii israeli é comum a ausência de escara de inoculação
9,10,11 . Num estudo português, só 38% doentes infectados com estirpe Israeli apresentaram escara comparativamente com 60% dos doentes infectados com a estirpe Malish
12. No caso clínico descrito, a associação de inflamação do dente do siso e a utilização de antibiótico com aparecimento de rash cutâneo, que erroneamente foi interpretado pela própria doente como consequência da antibioterapia, motivaram a vinda tardia ao SU, provocando uma evolução mais arrastada e grave no curso clínico da doença. As rickettsias são bactérias com tropismo para células endoteliais dos vasos periféricos motivo pelo qual os doentes podem desenvolver um quadro de vasculite generalizada. Neste caso a isquémia das extremidades, no contexto da vasculite por Rickettsia, poderá ter sido agravada pelas doses elevadas de aminas vasoativas, necessárias para a estabilidade hemodinâmica da doente. Em relação ao diagnóstico definitivo de FEN, sabe-se que as técnicas serológicas confirmam a suspeita clínica ao identificar tratar-se de uma infecção por uma Rickettsia do grupo das febres exantemáticas embora não permitam distinguir a espécie/estirpe envolvida. Para o conseguir são imprescindiveis as ferramentas moleculares, como a PCR com sequenciação do fragmento amplificado, que identificam a espécie de Rickettsia responsável pela doença. Pelo facto dos resultados da IFA terem sido negativos para a pesquisa de anticorpos anti-Rickettsia e perante a gravidade do caso e a necessidade de confirmação do diagnóstico de rickettsiose foi solicitado ao laboratório a realização de PCR nessa mesma amostra de soro (por ser a única de fase aguda e como tal a mais sensível e específica). O facto deste caso se apresentar com um quadro de sépsis grave, com grande quantidade de microrganismos em circulação, determinou que a deteção do DNA da bactéria no soro fosse possível, tendo permitido a identificação do agente envolvido:
Rickettsia conorii estirpe
israeli, confirmando assim o diagnóstico clínico. Este caso mostra a importância de um diagnóstico clínico atempado de maneira a evitar complicações decorrentes desta patologia.
Figura I
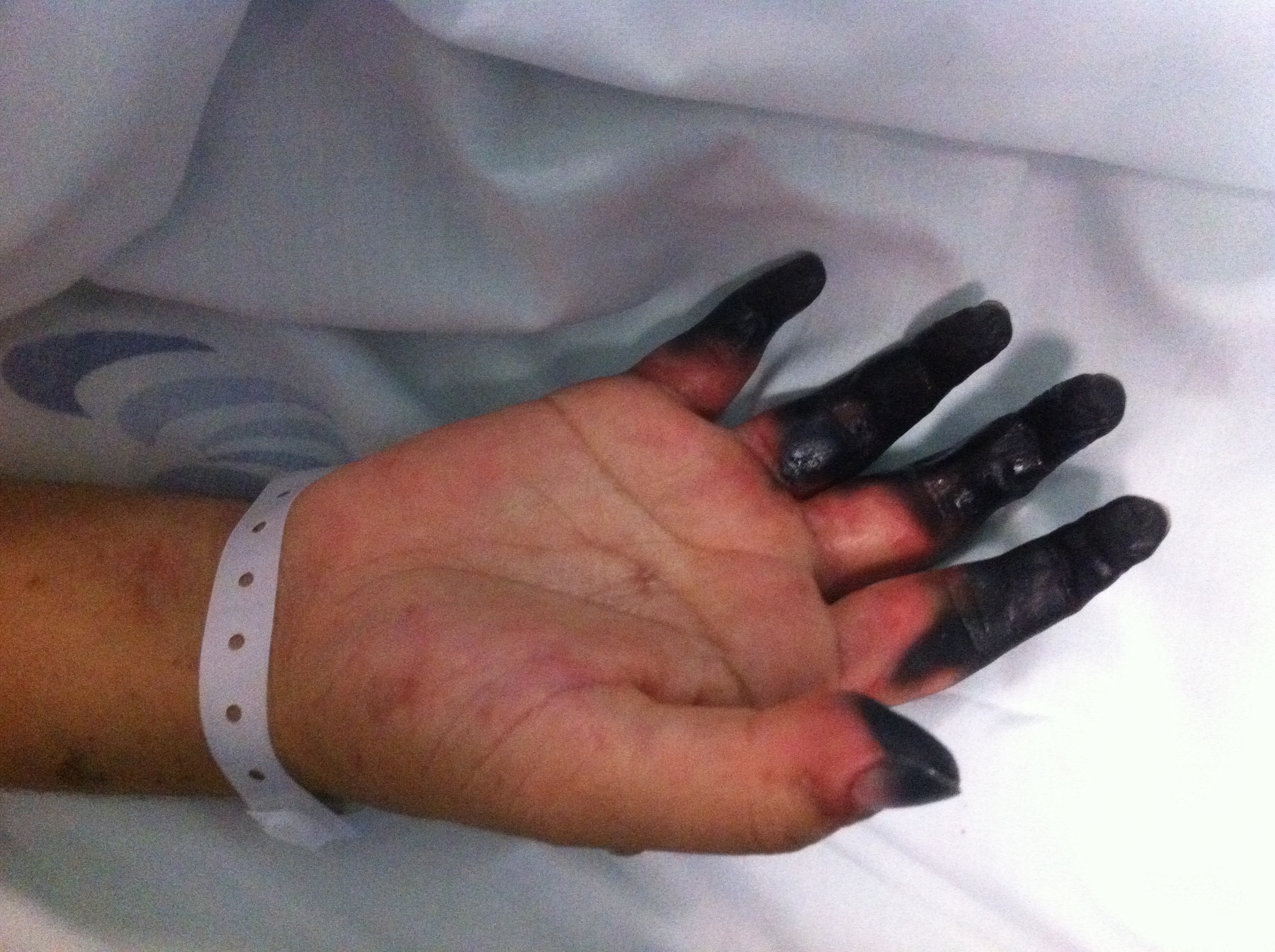
Mão direita com necrose
Figura II

Pés com isquémia e necrose
Figura III
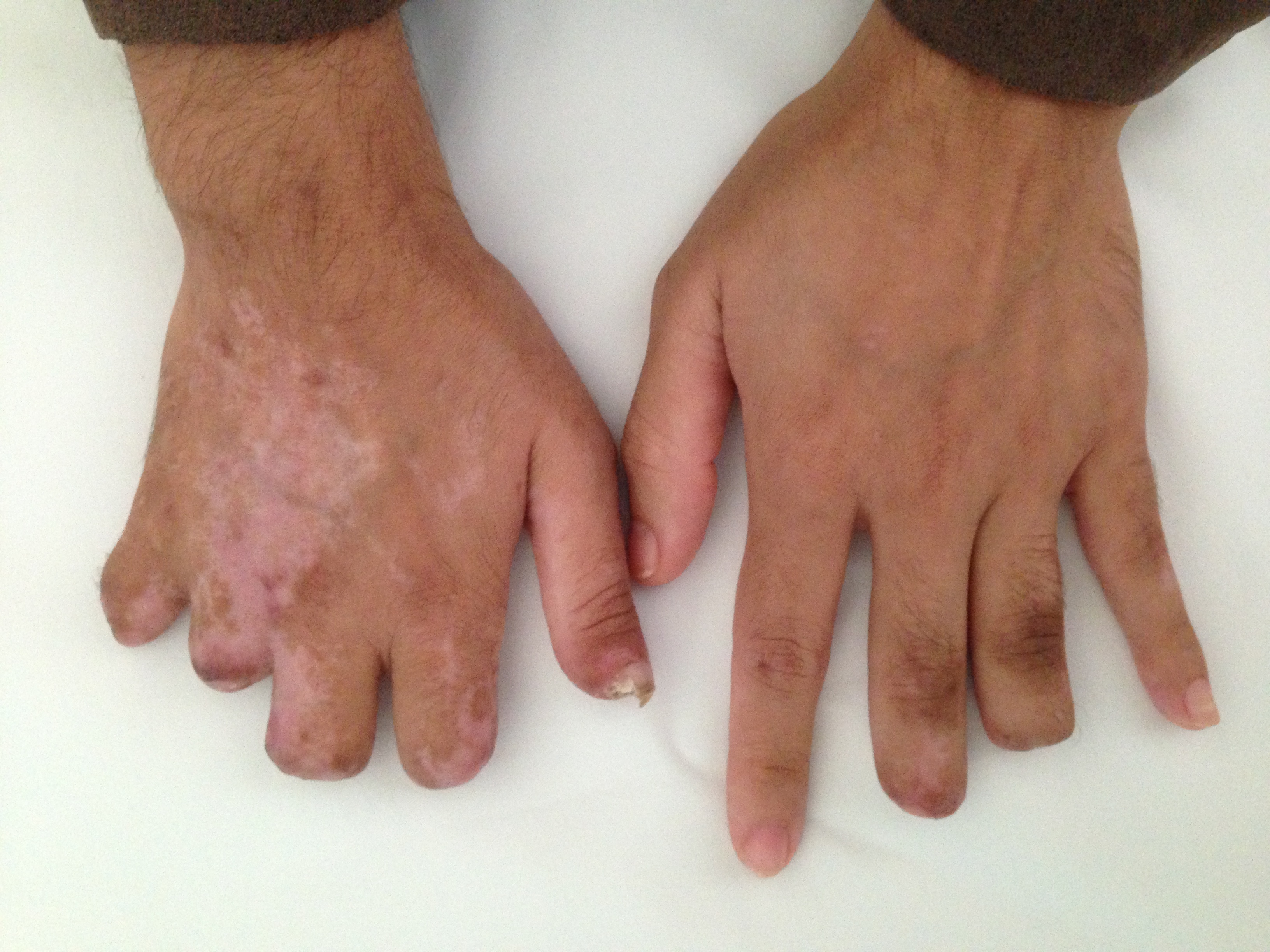
Amputação dos 2º,3º,4º e 5º dedos da mão direita; 3º e 4º dedos da mão esquerda
Figura IV

Amputação trans-tibial dos membros inferiores
BIBLIOGRAFIA
1. Morais JD, Bacellar F, Filipe A, Azevedo F. Isolamento e Caracterização de Rickettsia conorii num caso clínico fulminante, sem escara de inoculação nem exantema.Revista Portuguesa Doenças Infecciosas 1996;19: 110-116.
2. Pocas J, Bacellar F, Filipe A. Clinica e Diagnóstico Laboratorial da Febre Escaro-Nodular.Med Interna.2002;9:52-56.
3. Sousa R, S Nobrega, Bacellar F, Torgal J. Sobre a Realidade da Febre Escaro-nodular em Portugal.Acta Med Porto.2003;16:429-436.
4. Louro E, Campos A, J Leitão, Carvalho A, Santos R, Reis C, et al.Febre Escaro-Nodular: uma zoonose benigna?.Rev Soc Med Porta Interna de 2006;13 (1) :14-18
5. Rovery C, Brouqui P, Raoult D. Questions on Mediterranean spotted fever a century after its discovery.Emerg Infect Dis.de 2008; 14:1360-1367
6. Mims C, Dockrell H, Goering R, Roitt I, Wakelin D, edição Zuckerman M. Medical Microbiology.3rd.EUA: Mosby;2004.p.386-389
7. Font-Creus B, Bella-Cueto F, Espejo-Arenas E, Vidal-Sanahuja R, Munoz-Espin T, Nolla-Salas M, et al.Mediterrânean spotted fever: a cooperative study of 227 cases.Rev Infect Dis.985; 7 (5) :635-42.
8.Guidelines for the diagnosis of tick-borne bacterial diseases in Europe. P. Brouqui, F. Bacellar, G. Baranton, R. J. Birtles, A. Bjoe¨rsdorff, J. R. Blanco, G. Caruso*, M. Cinco, P. E. Fournier, E. Francavilla, M. Jensenius, J. Kazar, H. Laferl, A. Lakos, S. Lotric Furlan, M. Maurin, J. A. Oteo, P. Parola, C. Perez-Eid, O. Peter, D. Postic, D. Raoult, A. Tellez, Y. Tselentis and B. Wilske Members of ESCAR (ESCMID Study Group on Coxiella, Anaplasma, Rickettsia and Bartonella) and the European Network for Surveillance of Tick-Borne Diseases (EC QLK2-CT-2002-01293)
9. Dieder Raoult, Philippe Parola.Rickettsial Diseases 22/03/2013 pag 130
10. Sousa R, S Dória, Bacellar F, Torgal J. Mediterrânean spotted fever in Portugal: risk factors for fatal outcome in 105 hospitalized patients.Ann NY Acad Sci2003;990:285-94.
11. Miriam Weinberger, Avi Keysary, Judith Restinga, Ronit Zaidenstein Avi Itzhaki, Carmela Strenger, Moshe Leitner, Christopher D. Paddock, e Marina E. Eremeeva. Fatal Rickettsia conorii subsp.israelensis infection, Israel. Infectious Diseases Unit, Assaf Harofeh Medical Center, Zerifin 70300, Israel.Emerging Infectious Diseases (Fator de Impacto: 6,79) .06/2008;14 (5) :821-4 DOI: 10.3201/eid1405.071278
12. Rita de Sousa, Ana França, Sónia Dória Nóbrega, Adelaide Belo, Mario Amaro, Tiago Abreu, José Poças, Paula Proença, José Vaz, Jorge Torgal, Bacellar Fátima, Nahed Ismail, David H. Walker.Host-and Microbe-Related Risk Factors for and Pathophysiology of Fatal Rickettsia conorii Infection in Portuguese Patients.





