Introdução: A doença de Buerger (DB) é uma doença vascular inflamatória que afeta preferencialmente as extremidades dos membros de jovens fumadores(1). Apesar da inegável associação com o tabaco, a etiologia permanece desconhecida, assim como orientações para o diagnóstico definitivo e tratamento(2). Carateriza-se pela presença de trombos inflamatórios no leito vascular, compostos por linfócitos, neutrófilos, células gigantes e ocasionalmente microabcessos (3).
O único tratamento reconhecidamente eficaz é a descontinuação do consumo tabágico (2), especulando-se o papel de outros fármacos como os derivados das prostaglandinas, bosentan e o rituximab, a par de novas terapêuticas de neovascularização(4).
Caso clínico: Doente do sexo masculino, 54 anos, nacionalidade portuguesa, recorre ao serviço de urgência (SU) por quadro de poliartralgias de ritmo mecânico sem sinais de artrite, com 15 dias de evolução. Como antecedentes pessoais significativos refere-se tabagismo ativo (› 30 UMA). Foi medicado inicialmente com anti inflamatórios não esteroides sem melhoria dos sintomas. Por persistência do quadro, associado a febre (37.4 - 38ºC), de predomínio vespertino, com 3 dias de evolução, recorre novamente ao SU sendo internado para estudo. Negava sudorese profusa, tosse ou expectoração, alterações intestinais, rigidez matinal, alterações mucosa oral, xerostomia, xeroftalmia, sintomas oculares como hiperemia e fotossensibilidade. Sem queixas sugestivas de fenómeno de Raynaud. Sem viagens recentes ou alterações dos hábitos alimentares.
O exame objetivo foi normal, exceto temperatura auricular de 38,2º Celsius, dor e limitação funcional ao nível dos cotovelos, das articulações metacarpofalângicas e interfalângicas distais e proximais bilateralmente e cianose distal do 4º dedo de ambas as mãos. Sem sinais de artrite e de fenómeno de Raynaud.
Analiticamente salienta-se, velocidade de sedimentação de 48 mm, leucocitose de 19,0 x 109 u/L, sem neutrofilia, proteína C reativa de 7.6 mg/dL, dislipidémia mista (desconhecida até à data) com colesterol total de 218 mg/dL, LDL 158 mg/dL e triglicéridos de 223 mg/dL. O estudo imunológico, incluindo fator reumatoide, ANAs, anti-DNA, ANCA, crioglobulinas, anti-centrómero, anti-Scl 70, complemento e anticorpos antifosfolipidicos, foi negativo. Serologias virais de hepatites e vírus de imunodeficiência humana negativos, assim como todos os exames culturais bacteriológicos de urina e sangue. Da evolução em internamento, destaca-se apirexia desde 4º dia mantendo queixas de poliartralgias. Teve alta clínica sendo referenciado a consulta externa de medicina.
Em reavaliação de ambulatório uma semana após alta, constata-se apirexia mantida e persistência das queixas articulares. Nessa consulta observa-se quadro de Raynaud e acrocianose digital dos pés e mãos sugestivo de isquemia tecidular (figura I e II). Testada a patência vascular da mão através do teste de Allen, constata-se resultado patológico (figura III).
Da investigação em ambulatório efetuou capilaroscopia em que se descreve: “ número de capilares diminuídos com densidade e distribuição não regulares, dismorfias em número significativo associadas a zonas mais avasculares, hemorragia e focos sugestivos de neoangiogenese. Alterações compatíveis com Raynaud secundário não esclerodérmico, vasculite? ”. Fez Ecocardiograma que não revelou alterações, Eco doppler carotídeo, vertebral e arterial dos membros superiores e inferiores onde se concluiu “doença arteriosclerótica ou uma doença do tipo vasculítica ao nível das artérias de menor calibre”.
Realizou angiografia dos membros em que se descreve também oclusão da peroneal, tibial posterior esquerda e tibial posterior direita, não se visualizando artérias das arcadas palmares por espasmo (figura IV e V). Fez angioplastia da ilíaca externa direita por estenose deste vaso, iniciando terapêutica com amlodipina e antiagregação dupla (clopidogrel e aspirina), mantendo estatina previamente prescrita após alta do internamento.
Após discussão com cirurgião vascular, foi proposto ciclo terapêutico com Vasoprost® durante 21 dias, constatando-se melhoria significativa do quadro, estando até á data presente sem recorrência do quadro clínico.
Discussão:
Na presença de um caso típico de DB, estabelecer a hipótese de diagnóstico não é difícil. Contudo, temos de ter em consideração que não existem sinais, sintomas, alterações radiológicas ou analíticas específicas e patognomónicas de DB. Simultaneamente não existem critérios diagnósticos uniformes, sendo necessário excluir vasculites associadas a autoimunidade ou a outras condições cardiovasculares (5).
No que concerne a autoimunidade, tem de ser excluído Lupus eritematoso sistémico, a Síndrome antifosfolipídica e Esclerose sistémica, salientando-se a variante da Esclerodermia e a síndrome de CREST (Calcinose, Fenómeno Raynaud, Dismotilidade Esofágica, Esclerodactilia, Telangiectasias). Para exclusão dos referidos diagnósticos importa realçar a componente clínica, que no caso em particular não era sugestiva de nenhuma entidade assim como investigação laboratorial com estudo de autoimunidade que era negativo.
As vasculites sistémicas a considerar incluem: a vasculite reumatoide, poliartrite nodosa, Granulomatose com poliangeite, Sindrome Churg-Strauss e crioglobulinémia. De forma genérica e independentemente da natureza dos vasos (grande, médio ou pequeno calibre), são quadros que apresentam resultados serológicos positivos, nomeadamente, ANCA e ANA positivo e complemento baixo, VS elevada, atingimento de órgão alvo, p. ex. renal, pulmonar, ocular e quando presente a nível articular, apresentam-se com sinais de artrite(6). Esta hipótese foi abandonada dado o estudo imunológico negativo e evolução clínica no nosso caso.
Nas causas cardiovasculares, foi excluída por ecocardiograma a hipótese cardioembólica como fonte de lesões distais. Outra causa a considerar será a arteriosclerose. Neste caso, pouco provável, tendo presente apenas como fatores de risco o tabagismo ativo (critério comum às duas entidades, DB e arteriosclerose) e a dislipidemia “de novo” com valores pouco significativos. Salienta-se a ausência de comorbilidades associadas como a Diabetes e Hipertensão. Tipicamente os doentes com DB tem “phlebitis migrans” e fenómeno de Raynaud, aspetos praticamente ausentes na arteriosclerose mesmo nos casos graves(7). Os membros superiores são envolvidos em cerca de 50% dos casos na DB, com atingimento de 3 membros ou mais, ao contrário de 14 % na arteriosclerose e um atingimento multisegmentar mais raro (7).
Nos exames complementares realizados, nomeadamente a angiografia, é descrito padrão típico de DB evidenciando interrupções arteriais súbitas. A capilaroscopia e o ecodoppler dos membros descrevem uma doença de pequenos vasos e focos de neoangiogenese, dados a favor de DB.
Na literatura existem diversas referências a critérios diagnósticos para a DB. Os mais usados são os de Shionoya e os de Papa e al, baseando-se numa escala de pontuação.
Shionoya descreve vários itens necessários para afirmar o diagnóstico, nomeadamente(8):
- História de tabagismo
- Início antes dos 50 anos
- Oclusões infra-popliteas
- Envolvimento ou “phlebitis migrans” dos membros superiores
- Sem outros fatores de risco para a arteriosclerose excepto tabagismo
A abordagem diagnóstica proposta por Papa e al, usa uma escala de probabilidade (figura VI)(9).
O caso em particular, cumpre 3 a 4 dos critérios de Shionoya, resultando em diagnóstico provável (5 pontos) ou muito provável (6 pontos) com os critérios de Papa, dependendo da valorização do diagnóstico da dislipidémia após o início do quadro, assim como valores pouco significativos para a exuberância da clinica apresentada.
No que diz respeito ao tratamento, a única medida reconhecidamente eficaz é a descontinuação do consumo tabágico(2). O papel dos antiagregantes plaquetários como a aspirina e clopidogrel e vasodilatadores não está estabelecido e de momento não é recomendado (10). Os antagonistas dos canais de cálcio diidropiridínicos como o verapamil e nifedipina parecem ser benéficos se existir vasospasmo (11). No caso dos derivados das prostaglandinas, existem estudos que relatam franca melhoria das lesões distais e diminuição das taxas de amputação (12).
O prognóstico respeitante às taxas de amputação de dedos, é pior na DB do que as várias formas de arteriosclerose ou artrite imune necrotizante. A progressão para amputação está altamente relacionada com o consumo de tabaco, sendo a progressão da doença marcadamente benigna em quase todos os pacientes que conseguem abster-se com sucesso do mesmo. O risco de amputação é praticamente nulo após uma média de 8 anos de cessação tabágica (5).
Conclusão:
A DB é uma entidade complexa, de etiologia e fisiopatologia pouco esclarecida. O Diagnóstico é clínico, mas a ausência de critérios diagnósticos bem definidos e universais dificulta o processo. Existem 4 aspetos fundamentais na DB:
1) achados clínicos compatíveis com esta condição: isquémia digital sem envolvimento de outros órgãos
2) Identificação do padrão típico de envolvimento vascular na angiografia
3) Exclusão de outras doenças que possam simular a DB
4) Confirmação da presença do fator de risco major para a DB – exposição ao Tabaco
O presente caso parece cumprir em absoluto estas 4 condições, associado a elevada probabilidade nas escalas de pontuação (Shionoya, Papa e al).
A natureza distal do padrão da doença e envolvimento dos membros superiores são dois grandes argumentos para diferenciar a DB de arteriopatias arterioscleróticas. No entanto estas duas entidades partilham fatores de risco e fisiopatologia, sendo legítima a dúvida se o doente apresentado poderá ter apenas uma das duas entidades- DB ou arteriosclerose ? Será sempre uma pertinente questão.
Figura I

Lesões distais dos membros superiores sugestivo de isquemia
Figura II

Lesões distais dos membros superiores sugestivo de isquemia
Figura III
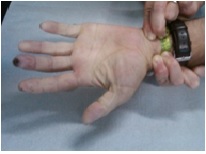
Teste de Allen com resultado patológico
Figura IV
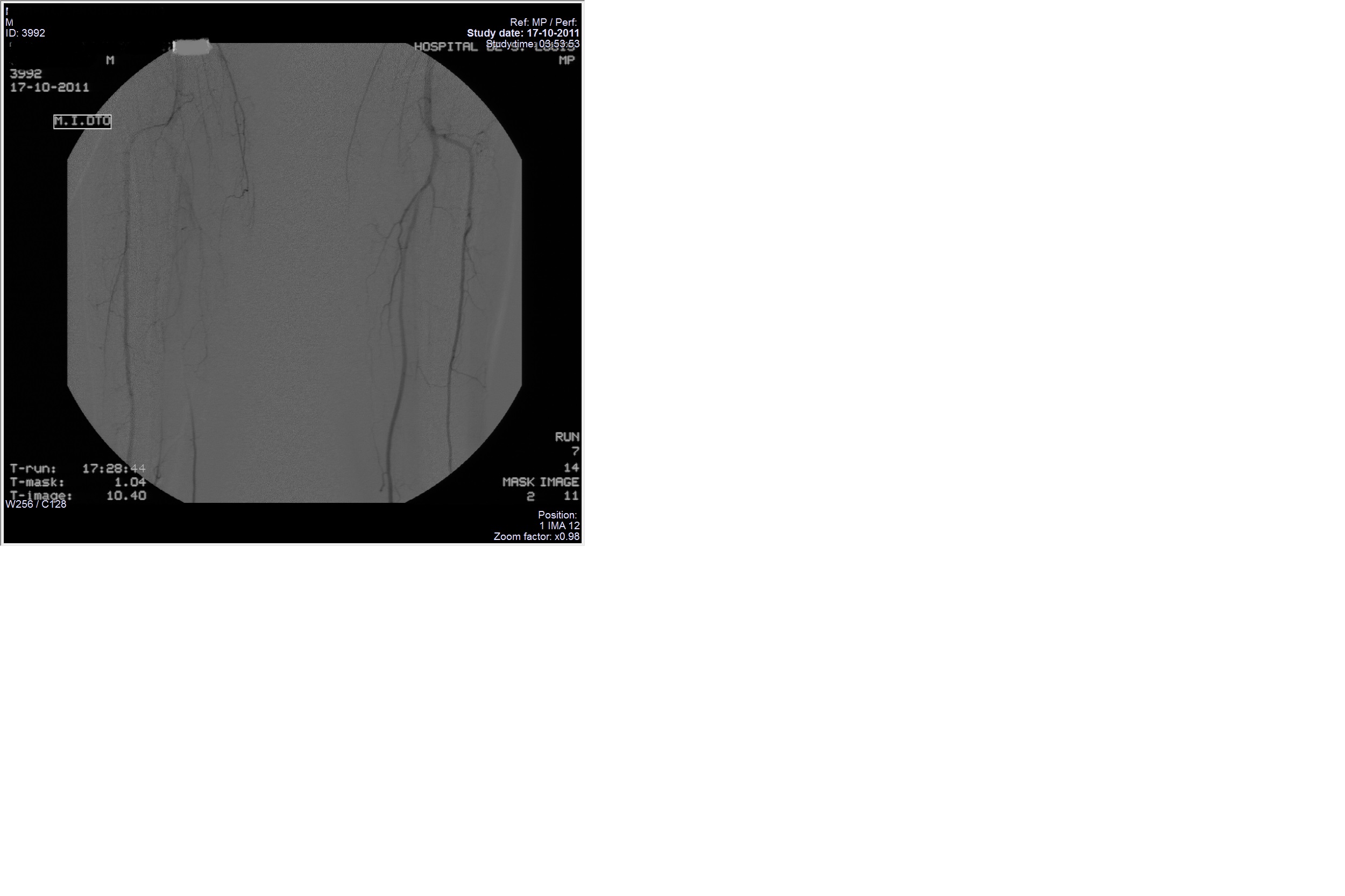
Angiografia dos membros inferiores com resultados compatíveis com estenose da ilíaca externa direita descrevendo também oclusão da peroneal, tibial posterior esquerda e tibial posterior direita
Figura V
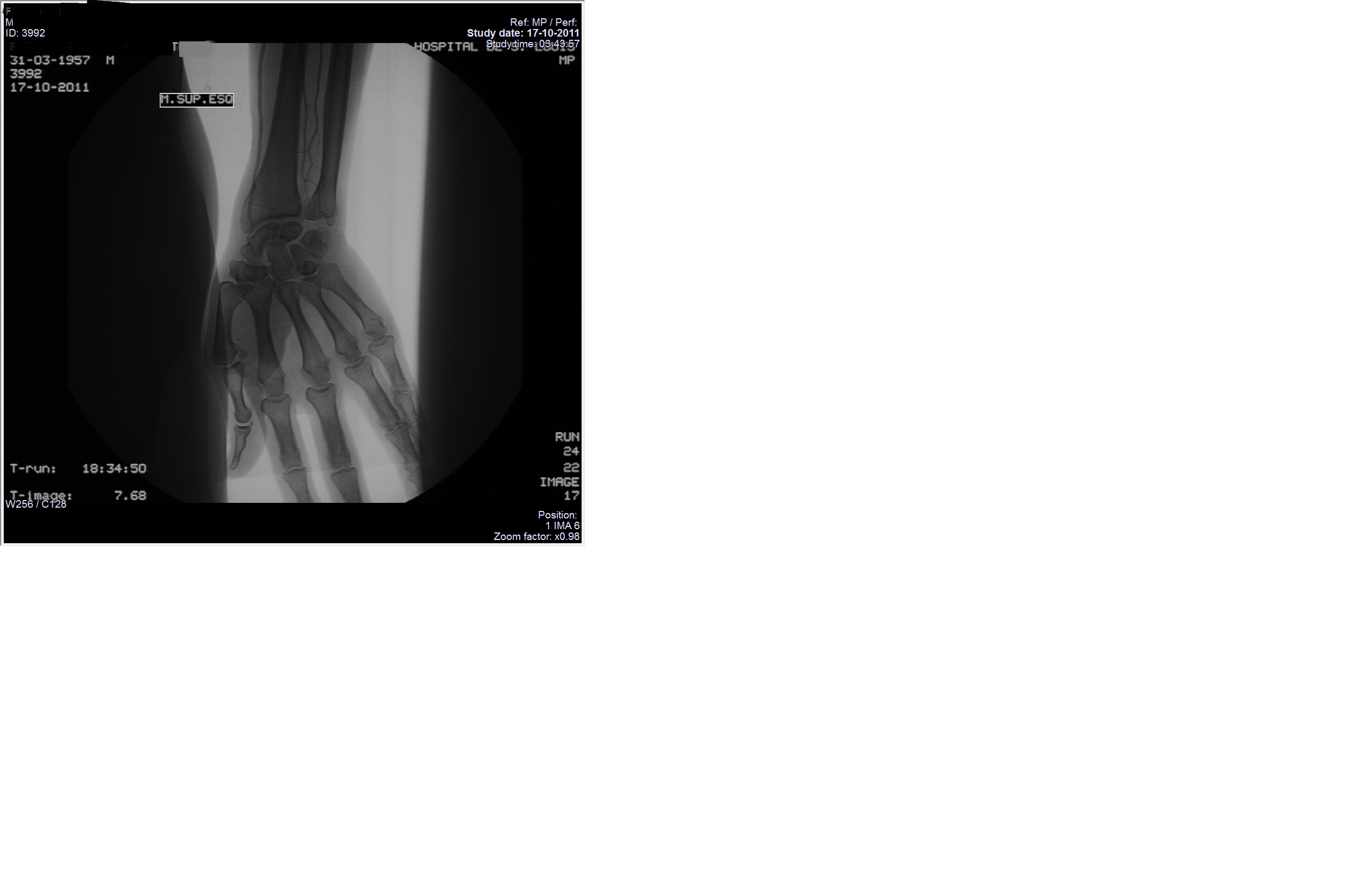
Angiografia dos membros superiores não se visualizando artérias das arcadas palmares por espasmo
Figura VI
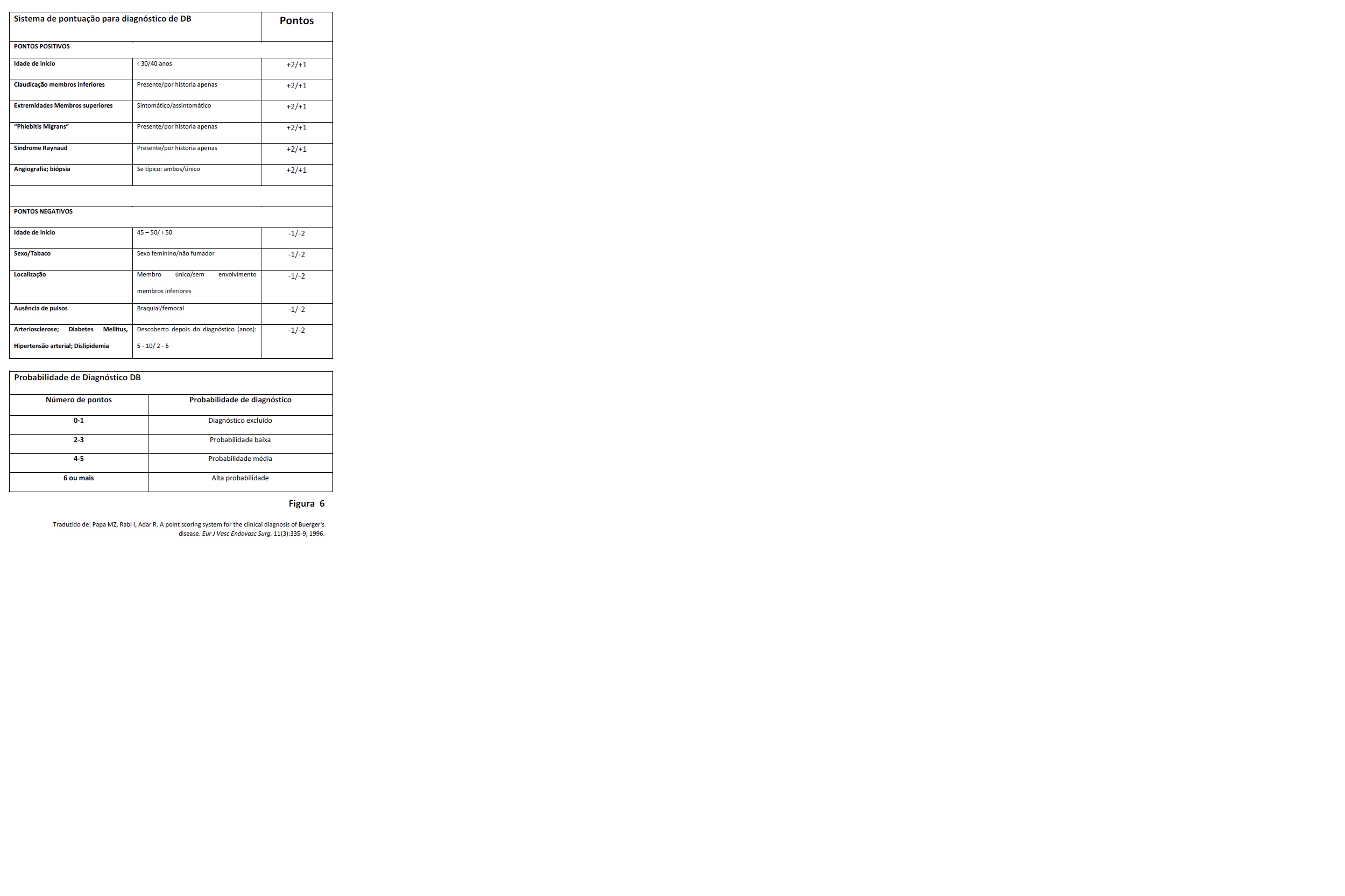
Abordagem diagnóstica proposta por Papa e colegas usando escala de probabilidade (Traduzido de: Papa MZ, Rabi I, Adar R. A point scoring system for the clinical diagnosis of Buerger´s disease. Eur J Vasc Endovasc Surg. 11(3):335-9, 1996.)
BIBLIOGRAFIA
1 - Roncon-Albuquerque R, Serrão P, Vale-Pereira R, Costa-Lima J, Roncon-Albuquerque R Jr. Plasma catecholamines in Buerger´s disease: effects of cigarette smoking and surgical sympathectomy. Eur J Vasc Endovasc Surg. 24(4):338-43, 2002.
2- LR, Espinoza. Buerger´s disease: thromboangiitis obliterans 100 years after the initial description. Am J Med Sci. 337(4):285-6, 2009.
3- Piazza G, Creager MA. Thromboangiitis obliterans. Circulation 2010; 121:1858.
4 - Lara-Hernández R, Lozano-Vilardell P, Cordobés-Gual J. Novel therapies of non-revascularizing peripheral arterial occlusive disease: therapeutic angiogenesis. Med Clin (Barc). 131(17):665-9, 2008.
5 - Sr., Mills JL. Buerger´s disease in the 21st century: diagnosis, clinical features, and therapy. Semin Vasc Surg. 16(3):179-89, 2003.
6- Ozaki S. Vasculitis update: Diagnosis and treatment. Arerugi. 2006; 55:1497-503.
7 – Rodney A. White, Larry H. Hollier, Chapter 8 Buerger´s Disease, Vascular pathology anh physiology, Massachusetts USA Blackwell future Blackwell Publishing, 2005, 92 – 100
8- S, Shionoya. Diagnostic criteria of Buerger´s disease. Int J Cardiol. 66 Suppl 1:S243-5; discussion S247, 1998.
9 - Papa MZ, Rabi I, Adar R. A point scoring system for the clinical diagnosis of Buerger´s disease. Eur J Vasc Endovasc Surg. 11(3):335-9, 1996.
10 – Vijayakumar A, Tiwari R, Prabhuswamy V.K., Thromboangiitis Obliterans (Buerger’s Disease)—Current Practices. Hindawi Publishing Corporation, International Journal of Inflammation Volume 2013, Article ID 156905
11- J. P. Bagger, P. Helligsoe, F. Randsbaek, H. H. Kimose, and B. S. Jensen, “Effect of verapamil in intermittent claudication: a randomized, double- blind, placebo-controlled, cross-over study after individual dose-response assessment,” Circulation, vol. 95, no. 2, pp. 411–414, 1997.
12 - A. K. Bozkurt, K. Cengiz, C. Arslan et al., “A Stable prostacyclin analogue (iloprost) in the treatment of Buerger’s disease: a prospective analysis of 150 patients,” Annals of Thoracic and Cardiovascular Surgery, vol. 19, no. 2, pp. 120–150, 2013.







