INTRODUÇÃO
Os tumores do estroma gastrointestinal (GIST) são tumores do mesênquima com origem a nível da parede do trato gastrointestinal, mesentério, epíplons e retroperitoneu1, sendo que 50-60% das lesões são provenientes do estômago, 20-30% do intestino delgado, 10% do intestino grosso, 5% do esófago e 5% de outros locais da cavidade abdominal 2,3.Representam menos de 1% das neoplasias malignas gastrointestinais, diferenciando-se de outros tumores do mesenquima pela sua imunoreactividade para o antigénio CD 117, produto da expressão do KIT (um receptor com actividade tirosina cinase) 1,4.
O termo GIST foi utilizado pela primeira vez em 1983 por Mazur e Clark, sendo a origem celular destas neoplasias atribuída à célula intersticial de Cajal 5.
A exacta incidência dos GIST é desconhecida, estimando-se que se aproxime dos 10-20 casos por cada milhão de habitantes 2,6. A maioria dos doentes encontra-se entre a 5ª e 7ª década de vida, parecendo haver um ligeiro predomínio em indivíduos de sexo masculino 4.
A apresentação clínica dos pacientes portadores de GIST é variável, correlacionando-se principalmente com o tamanho da lesão. Aproximadamente 10-30% dos doentes são assintomáticos. A presença de uma massa abdominal, dor abdominal ou hemorragia digestiva são as manifestações clínicas mais comuns destes tumores 1,4.
CASO CLÍNICO Os autores apresentam o caso de uma doente do sexo feminino, de 71 anos, raça caucasiana que se dirigiu ao serviço de urgência por quadro de vómitos esporádicos e dispepsia desde há cerca de um ano com agravamento na última semana. Referia além disso, dor no hipocôndrio direito, obstipação, anorexia e emagrecimento de cerca de 8 Kg no último mês. Como antecedentes pessoais apresentava diabetes mellitus tipo 2, hipertensão essencial, síndrome vertiginoso e insuficiência venosa dos membros inferiores. Estava medicada em ambulatório com metformina 1000 mg, Gliclazida 30 mg, Omeprazol 40 mg, beta-histina 24 mg e Ramipril 5 mg. Os antecedentes familiares eram irrelevantes. Negava hábitos tabágicos e alcoólicos. Ao exame objectivo apresentava-se consciente, colaborante, orientada no tempo e no espaço, apirética e normotensa. Pele e mucosas coradas e hidratadas. Auscultação cárdio pulmonar sem alterações. O abdómen apresentava-se mole, depressível, com dor á palpação profunda no epigastro e no hipocôndrio direito. Palpava-se uma massa no hipocôndrio esquerdo e epigastro, com extensão à região infra umbilical, não móvel, de consistência pétrea e de grandes dimensões (aproximadamente 10 cm de dímetro). Não apresentava edemas periféricos. Analiticamente, apresentava leucocitose (32,37 × 103/µL), com 10% de neutrófilos em bastão e 3% de metamielócitos e PCR de 5,6 mg/dl. Ainda no serviço de urgência realizou ecografia abdominal que mostrou volumosa massa heterogénea na região epigástrica de difícil caracterização ecográfica e vesícula biliar litiásica, sugerindo estudos complementares. A doente foi então internada no serviço de medicina interna. Efectuou Endoscopia Digestiva alta que visualizou deformação da pequena curvatura do corpo por compressão extrínseca muito provável. Foram realizadas biópsias que se demonstraram negativas para lesões neoplásicas. Realizou TAC Abdomino-Pélvico que confirmou a presença de volumosa massa heterogénea na pequena curvatura gástrica, de contornos lobulados com cerca de 15×10 cm, com conteúdo hidro-aéreo no interior com 9×8 cm. Estes aspectos sugerem tratar-se de lesão neoformativa (com origem na parede gástrica mas comportamento exofítico) complicada de abcesso intralesional como se demonstra na figura 1. Foi instituída a tabela terapêutica com metoclopramida, sucralfato, omeprazol, paracetamol e meropenem. A suspeita de lesão neoformativa levou à realização de eco-endoscopia que mostrou massa volumosa (maior que 10 cm), em grande parte extraparietal, estendendo-se desde o corpo proximal até ao bulbo duodenal, com implantação na parede gástrica. Predominantemente sólida, com áreas heterogéneas, hipoecoicas, em relação com áreas necróticas na parte distal da lesão, compatível com GIST (pelo comportamento exofitico) com áreas de transformação. Após sete dias de antibioterapia realizou-se TAC Abdominal de controlo que revelou diminuição da área abcedada intra-lesional e confirmou ausência de doença localmente invasiva, assim como ausência de lesões secundárias. A doente foi submetida a terapêutica cirúrgica, tendo sido realizada gastrectomia total com montagem em Y de Roux e colecistectomia retrógrada (figura 2). O estudo macroscópico da peça revelou volumoso tumor de 16,2×15×7,5 cm com extensas áreas cavitárias de contudo necrótico. Ao exame histológico observou-se tumor fusocelular de crescimento expansivo que cresce na espessura da camada muscular própria, ulcera a mucosa e não envolve a serosa. Constituído por células fusiformes dispostas em feixes curtos com estroma hialino e com extensas áreas de hemorragia e necrose. Apresentava pleomorfismo celular moderado observando-se 7-8 mitoses/50c.g.a.. Não se identificaram metástases ganglionares nem implantes peritoneais. No estudo imunohistoquímico observou-se positividade para c-Kit e ausência de expressão de desmina. Concluiu-se, pois, tratar-se de um GIST do estômago de alto risco (pT4, N0, RO). Dado que o imatinib tem indicação na doença localmente avançada, a doente foi proposta para o tratamento standard de 400 mg por dia, no mínimo, durante 3 anos, não tendo sido registadas até ao momento reacções adversas. A doente é seguida em ambulatório em consulta de Medicina Interna, Cirurgia Geral e Oncologia. DISCUSSÃO O caso clínico apresentado diz respeito a uma entidade pouco frequente com repercussões clínicas importantes relacionadas com o seu potencial maligno. Este caso refere-se a uma doente admitida no serviço de urgência por quadro de vómitos e dispepsia, forma de apresentação atípica dos GIST, neste caso, muito relacionada com o tamanho da massa independentemente da histologia. A localização gástrica dos GIST, tal como no presente caso clínico, é reconhecidamente a mais comum 1. As biópsias da lesão gástrica não foram no nosso caso clínico, como não são na maioria dos casos, conclusivas para o diagnóstico, assumindo a eco-endoscopia um papel primordial no diagnóstico e estadiamento loco-regional, ao identificar uma massa volumosa, extra parietal, com implantação na parede gástrica, concluindo-se, por este meio complementar de diagnóstico, tratar-se de um provável GIST. Os critérios eco-endoscópicos que permitem eventualmente, identificar os tumores com maior risco de malignidade passam pela associação de algumas das seguintes características: tamanho do tumor, irregularidade dos bordos extraluminais e luminais, eco heterogeneidade, presença de espaços quísticos e existência de nódulos linfáticos com mais de 10 mm 7. Relativamente ao caso em análise, admitimos tratar-se de um GIST localizado à parede gástrica, com potencial de malignidade indeterminado, estando indicada ressecção cirúrgica 8. Também os critérios baseados na histologia não são absolutamente fiáveis na diferenciação entre GIST benignos e malignos, podendo apresentar um padrão misto (10%), epitelióide (20%) e fusocelular (70%), sendo este último o tipo histológico do caso descrito. Contudo, a relevância em termos prognósticos, destes três tipos histológicos não é conhecido 8. Em 2001, o consenso da National Institute of Health, definiu como critérios morfológicos para avaliar o potencial maligno o tamanho do tumor e o número de mitoses por 50 high power fields (HPF) (Quadro I) 1,9. No nosso caso clínico, histologicamente confirmou-se a hipótese diagnóstica de GIST ao ser identificada imunoreactividade para o CD117, podendo ser classificado como de risco elevado (16,2 cm de diâmetro e mais de 5 mitoses/HPF). O tratamento padrão para pacientes com GIST não metastático é a ressecção cirúrgica completa da lesão, sendo necessária uma técnica cirúrgica meticulosa, visando prevenir a rotura tumoral durante a ressecção, o que teria impacto adverso no prognóstico 10,11,12. Muitos pacientes apresentam recidiva apesar da ressecção cirúrgica completa do tumor primário 10. A descoberta do STI571 (imatinib) revolucionou o tratamento do GIST, por ser a primeira terapia a agir especificamente na alteração molecular responsável pela etiologia da doença. O conhecimento de mutações proporcionou o desenvolvimento de uma droga com alvo molecular definido que interfere na actividade tirosina quinase dos receptores kit 13. Recentemente, o imatinib passou a ser considerado para terapia adjuvante após ressecção completa do tumor primário, podendo prevenir ou retardar a recidiva e consequentemente prolongar a sobrevida 14,15. Existem no entanto, situações em que o imatinib não é tolerado ou em que há progressão tumoral sob terapêutica, estando indicada nestes casos como terapêutica de segunda linha o sutinib, uma molécula que actua através de múltiplos inibidores da tirosina quinase. Recomenda-se um seguimento a longo prazo, embora não haja recomendações específicas relativas à melhor estratégia a adoptar 8. Neste caso e com um seguimento de 1 ano, têm sido efectuados endoscopia digestiva alta e TAC Abdominal de 6 em 6 meses, sem evidência de recorrência local ou de lesões secundárias à distância. CONCLUSÃO Relata-se o caso clínico de uma doente com quadro clínico de vómitos e emagrecimento com origem num GIST gástrico complicado com abcesso intra-lesional. Salienta-se a importância da eco-endoscopia no diagnóstico e estadiamento loco-regional deste tipo de tumores. Muitas questões ainda necessitam de resposta, porém à luz do conhecimento actual, sabe-se que a ressecção cirúrgica é o principal tratamento do GIST e que a cirurgia isolada é um tratamento insuficiente para lesões avançadas. É necessário a realização de estudos que respondam qual o possível benefício do tratamento adjuvante em pacientes portadores de GIST com mau prognóstico.Quadro I
Quadro I: Factores relacionados com o potencial de malignidade dos GISTs
| Risco | Tamanho (cm) | Mitoses/50HPF |
| Muito Baixo | < 2 | <5 |
| Baixo | 2-5 | <5 |
| Intermédio | <5 5-10 >5 | 6-10 <5 >5 |
| Alto | >10 Qualquer | Qualquer >10 |
Quadro I: Factores relacionados com o potencial de malignidade dos GISTs
Figura I
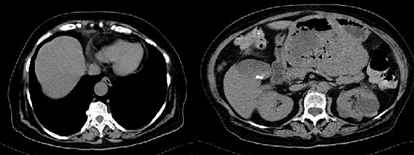
Figura 1: Tomografia computorizada abdomino-pélvica evidenciando a presença de volumosa massa heterogénea na pequena curvatura gástrica, de contornos lobulados com cerca de 15×10 cm, com conteúdo hidro-aéreo no interior com 9×8 cm. Estes aspectos sugerem tratar-se de lesão neoformativa (com origem na parede gástrica mas comportamento exofítico) complicada de abcesso intralesional.
Figura II
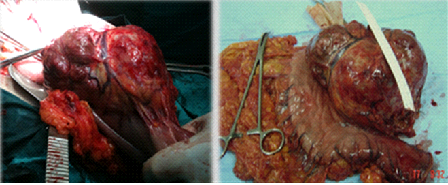
Figura 2: Técnica Cirúrgica: Gastrectomia total e colecistectomia retrógrada
BIBLIOGRAFIA
1 Davila RE, Faigel DO. GI Stromal tumors. Gastrointest Endosc 2003, 58: 80-88.
2 Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Congley BJ, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol. 2002; 33(5): 459-65.
3 Miettinen M, Majidi M, Lasota J. Pathology and diagnosis criteria of gastrointestinal stromal tumors (GISTs): a review. Eur J Cancer 2002; 38 Suppl 5: S 39-51.
4 Nowain A, Bhakta H, Pais S, Kanel G, Verma S. Gastrointestinal stromal tumors: Clinical profile, pathogenesis, treatment strategies and prognosis. J Gastroenterol Hepatol. 2005; 20: 818-24.
5 Saund MS, Demetri GD, Ashley SW. Gastrointestinal Stromal tumors (GISTs). Curr Opin Gastroenterol 2004; 20: 89-94.
6 Dematteo RP, Heinrich MC, El-Rifai WM, et al. Clinical Management of Gastrointestinal Stromal tumors: Before and after SIT- 571. Human Pathology 2002; 33:466-477.
7 Polkowski M. Endoscopic Ultrasound and Ultrasound-Guided Fine –Needle Biopsy for the Diagnosis of Malignant Submucosal Tumors. Endoscopy 2005; 37: 613-694.
8 Blay JY, Bon Valot S, Casali P, et al. Consensus meeting for management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Annals of Oncology 2005; 16: 566-578.
9 Nickl NJ. Gastrointestinal stromal tumors: new progress, new questions. Curr Opin Gastroenterol. 2004; 20: 427-516.
10 Ng EH, Pollock RE, Munsell MF, Atikson EN, Romsdahl MM. Prognostic factors influencing survival in gastrointestinal leiomyosarcomas: implications for surgical management and staging. Ann Surg 1992; 215: 68-77.
11 Connolly EM, Graffney E, Reynolds JV. Gastrointestinal Stromal Tumors. Br J Surg 2003; 90: 1178-86.
12 Yan H, Marchettini P, Acherman YI, Gething SA, Brun E, Sugarbaker PH. Prognostic assessment of gastrointestinal stromal tumor. AM J Clin Oncol 2003; 26:221-8.
13 DeMatteo RP, Maki RG, Antonescu C, Brennan MF. Targeted molecular therapy for cancer: the application of STI 571 to gastrointestinal stromal tumor. Curr Probl Surg 2003; 40(3):133-93.
14 Van Oosterom AT, Judson I, Verweij J, Stroobants S, di Paola ED, Dimitrijevic S, et al. Safety and efficaccy of imatinib (STI 571) in metastatic gastrointestinal stromal tumors: a phase I study . Lancet 2001; 358: 1421- 3.
15 Demetri GD, Von Mehren M, Blanke CD, Van den Abbeele AD, Eisenberg B, Roberts PJ, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 2002; 347: 472-80.

