Introdução:
O linfoma extranodal é a forma de apresentação de cerca de 40% dos doentes com linfoma1,2. Esta forma de apresentação é mais frequente nos linfomas não Hodgkin e o trato gastrointestinal é o mais frequentemente envolvido correspondendo a cerca de 40% de todos os linfomas não Hodgkin extranodais, 4-20% de todos os casos de linfomas não Hodgkin e a cerca de 1-4% de todas as neoplasias gastrointestinais malignas3. Cerca de 90% dos linfomas gastrointestinais são do tipo não Hodgkin e da linhagem B. Apesar da região mais frequentemente envolvida ser o estômago, seguindo-se o intestino delgado e região ileo-cecal, virtualmente qualquer órgão ou tecido pode ser afetado. O envolvimento do cólon é observado em cerca de 10-20% de todos os linfomas gastrointestinais4,5.
O linfoma não Hodgkin difuso de grandes células é o subtipo histológico mais frequente nos adultos sendo responsável por cerca de 25% dos casos. O linfoma de Burkitt é um subtipo raro no adulto ocorrendo em apenas 1 -2 % dos casos. O local de apresentação mais frequente é o abdómen1,5. Linfadenopatias retroperitoneais e mesentéricas, por vezes calcificadas, ascite e envolvimento gastrointestinal são as principais formas de apresentação. A linfomatose peritoneal é incomum, parecendo ser mais frequente quando o linfoma é de apresentação gastrointestinal ou na forma de linfadenopatias abdominais. O diagnóstico diferencial deve ser feito com outras entidades nomeadamente peritonite tuberculosa e carcinomatose peritoneal1,6.
Caso-clínico:
Homem de 67 anos, ex-fumador, com diabetes mellitus, dislipidemia e gastrite crónica, medicado habitualmente com vildagliptina/metformina (50 mg/1000 mg), pravastatina 20 mg e pantoprazol 40 mg, foi internado no Serviço de Medicina Interna após ter recorrido ao Serviço de Urgência a 02 de Maio de 2014 por quadro de astenia, anorexia, emagrecimento, hipersudorese, enfartamento pós prandial e dor abdominal com agravamento progressivo em semanas. Negava febre, vómitos ou alteração do trânsito intestinal. Tinha realizado, há cerca de 2 anos, estudo endoscópico (endoscopia digestiva alta e colonoscopia total) que não apresentaria alterações. Ao exame objetivo era de salientar abdómen distendido, sem sinais de irritação peritoneal. Analiticamente apresentava anemia microcítica, velocidade de sedimentação (VS) aumentada, hipoproteinemia, hipoalbuminemia, desidrogenase láctica (DHL) e proteína C reativa (PCR) elevadas (figura 1). A função renal e o ionograma não apresentavam alterações relevantes. A ecografia abdominal revelou sinais sugestivos de hepatopatia crónica e ascite de pequeno-médio volume. A tomografia computorizada abdominal apresentava imagem sugestiva de espessamento parietal do ângulo hepático do cólon/transição do transverso e do antro gástrico, e ascite de pequeno volume com aspeto micronodular e alguma densificação dos planos adiposos mesentéricos, particularmente na topografia do grande omento e nas porções dependentes, com ligeiro espessamento parietal de algumas ansas indiciando ascite maligna.Os marcadores víricos (hepatite B, hepatite C e vírus da imunodeficiência humana) foram negativos. Realizou estudo endoscópico. A endoscopia digestiva alta não mostrou alterações significativas e as biópsias realizadas apresentaram alterações compatíveis com gastrite crónica e metaplasia intestinal focal sem displasia ou malignidade. A colonoscopia total mostrou uma imagem ulcerada no ângulo hepático que foi submetida a biópsias (figura 2).
A paracentese diagnóstica revelou líquido peritoneal de aspeto seroso (figura 3).
Pelo valor elevado da adenosina desaminase (ADA) no líquido peritoneal e para excluir possível tuberculose realizou teste de Mantoux e doseamento de quantiferão que foram negativos. A pesquisa de PCR Mycobacterium tuberculosis no líquido peritoneal foi negativa. Tentou-se realizar biópsia peritoneal que não foi possível por aparentemente não apresentar material acessível.
Entretanto chegou o resultado preliminar histopatológico da lesão ulcerada do cólon que foi compatível com linfoma. Neste contexto, foi realizado aspirado medular cujo resultado citológico mostrou invasão medular por linfoma de Burkitt, corroborado por citometria de fluxo. Perante este resultado o diagnóstico de linfoma de Burkitt com linfomatose peritoneal ganhou peso tendo iniciado terapêutica nas primeiras 24h com ciclofosfamida e prednisolona seguida de R-hiper-CVAD (rituximab, ciclofosfamida, vincristina, doxorrubicina, dexametasona) adaptado com omissão de vincristina pelo risco de toxicidade autonómica.
Embora agendada optou-se por suspender a realização da biópsia peritoneal uma vez que o diagnóstico já tinha sido estabelecido, e a sua realização poderia levar a atraso no início da terapêutica, para além dos riscos inerentes aquele procedimento.
Após estabelecer-se o diagnóstico e, tendo já sido efetuados todos os exames de estadiamento, verifica-se que estamos perante um estadio IV-B com elevado risco prognóstico (score 4) de acordo com oInternational Prognostic Index(IPI) para Linfomas não Hodgkin agressivos, com uma sobrevida livre de doença estimada de 57,1% ao ano e sobrevida global estimada de 60% aos 3 anos.
Apresentou evolução favorável até à data.
Discussão:
O linfoma de Burkitt é raro no adulto tendo uma prevalência de 1-2%. A sua apresentação na forma de linfomatose peritoneal é ainda mais rara5.
O espessamento do peritoneu acompanhado de DHL elevada sugeria carcinomatose peritoneal; porém o doente tinha colonoscopia recente sem lesões. Por outro lado a presença de ADA elevada no líquido peritoneal fazia suspeitar da presença de tuberculose peritoneal; no entanto os exames realizados não confirmaram o diagnóstico. Além disso, o valor de ADA pode estar aumentado em situações de linfoma.
O doente não apresentava alterações particulares no hemograma, para além da anemia, nem no esfregaço de sangue periférico e a tomografia computorizada não revelou linfoadenopatias.
O omento é pobre em elementos linfáticos pelo que a linfomatose peritoneal habitualmente é rara e o mecanismo de disseminação não está completamente esclarecido. Pensa-se que poderá ser via ligamento gastrocólico, mesocólon transverso (fronteira onde o nosso doente apresentava a lesão) e superfície peritoneal visceral. A linfomatose peritoneal pode ser facilmente confundida com a carcinomatose peritoneal e é impossível a sua diferenciação com base apenas nos achados imagiológicos. Em alguns casos a citologia consegue detetar células linfóides no líquido peritoneal e assim estabelecer o diagnóstico1,6,9. No caso apresentado o líquido peritoneal não revelou células malignas.
Quando não se consegue obter o diagnóstico de outra forma poderá optar-se pela realização de uma laparotomia1,9. No entanto, nos casos de diagnóstico de linfoma já estabelecido, principalmente em situações rapidamente progressivas ou avançadas, a laparotomia deixa de ter relevância.
A DHL sérica está frequentemente elevada no linfoma e nos casos de linfoma gastrointestinal o valor de DHL sérica à admissão parece ser um fator de prognóstico independente. No entanto, no que se refere à DHL no líquido peritoneal, não há estudos que sustentem a sua relação com a linfomatose peritoneal6,7.
A ADA é uma enzima de degradação das purinas necessária à maturação e diferenciação das células linfóides. Tem estado relacionada com alta sensibilidade e especificidade (>95%) para diagnóstico de tuberculose peritoneal quando detetada no líquido ascítico. A ADA pode estar elevada em situações não infeciosas associadas com linfocitose do líquido peritoneal incluindo neoplasias (linfoma, adenocarcinoma e leucemia) e doenças do tecido conjuntivo (lúpus eritematoso sistémico e artrite reumatóide)8,9.
O linfoma contribui com 15-20% das neoplasias do intestino delgado e 20-30% de todos os linfomas gastrointestinais primários sendo o íleo o local mais frequentemente atingido. Contrariamente ao adenocarcinoma, o linfoma parece ter um envolvimento de múltiplos segmentos. O doente pode apresentar-se clinicamente com dor abdominal, náuseas, vómitos, perda de peso e disfunção intestinal (enteropatia de perda proteínas e/ou síndrome de mal-absorção), e menos frequentemente com perdas hemáticas gastrointestinais. Clínica de obstrução e/ou perfuração intestinal é menos frequente. O linfoma não-Hodgkin difuso de grandes células B é o subtipo histológico que ocorre mais frequentemente quando há envolvimento do cólon ou recto1,10,11. No linfoma de Burkitt o local de apresentação mais frequente é o abdómen. Linfadenopatias retroperitoneais e mesentéricas por vezes calcificadas, ascite e envolvimento gastrointestinal são formas de apresentação. Dos poucos casos existentes na literatura, a presença de linfomatose peritoneal correlaciona-se mais com os linfomas com envolvimento gastrointestinal ou com linfoadenopatias abdominais12.
No caso do doente apresentado os achados imagiológicos foram importantes direcionando-nos para a realização de colonoscopia e posterior diagnóstico.
Conclusão:
Os autores apresentam um caso raro de linfomatose peritoneal num doente com linfoma de Burkitt do trato gastrointestinal. A linfomatose peritoneal, apesar de pouco estudada pela sua reduzida frequência, parece estar associada a manifestação rara de tipos histológicos de linfoma mais agressivos com envolvimento sistémico e deterioração clínica rápida. É pois de importância crucial a valorização deste aspeto com vista a um início de tratamento tão rápido quanto possível e desta forma se proporcionar melhoria significativa do prognóstico.
Figura I
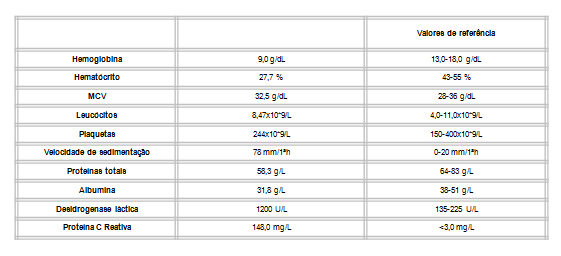
Dados laboratoriais
Figura II
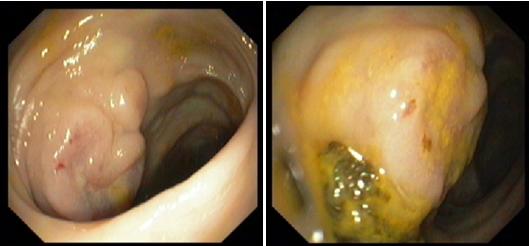
Lesão observada no ângulo hepático do cólon durante colonoscopia total.
Figura III
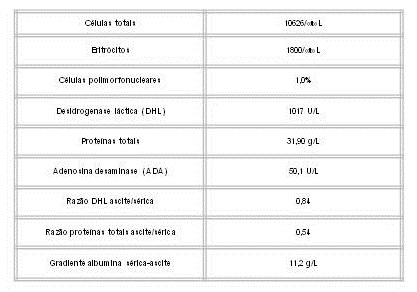
Análise do líquido peritoneal
BIBLIOGRAFIA
1. Curakova E., Genadieva-Dimitrova M., Misevski J., Caloska-Ivanova V., Andreevski V., Todorovska B., Isahi U., Trajkovska M., Misevska P., Joksimovic N., Genadieva-Stavric S., Antovic S., Jankulovski N., NonHodgkin`s limphoma with peritoneal localization. Case Reports in Gastrointestinal Medicine. Aticle ID, 2014: 1-8
2. Metser U., Goor O., Lerman H., Naparstek E., Even Sapir E., Pet-CT of extranodal lymphoma. American Journal of Roentgenology, vol. 182, nº6, 2004: 1579-1586
3. Moller M. B., Pedersen N. T., Christensen B. E., Diffuse large B-cell lymphoma: clinical implications of extranodal versus nodal presentation – a population-based study of 1575 cases. British Journal of Haematology, vol. 124, nº2, 2004: 151-159
4. Cho I. J., Park M. Y., Jang S. N., Kwon B. J., Nam H. S., Park K. W., Jang E. C. et all. A case of primary colonic lymphoma with peritoneal carcinomatosis and pleural effusion. Korean J Gastrointest Endosc, vol 33, 2006: 887-8
5. Morton L. M., Wang S. S., Devesa S. S., Hartge P., Weisenburger D. D., Linet M. S., Lymphoma incidence patterns by WHO subtype in the United States. Blood, vol 107, nº1, 2006: 265-276
6. Kim Y. G., Baek J. Y., Kim S. Y. et al. Peritoneal lymphomatosis confounded by prior history of colon cancer: a case report. BMC Cancer, vol.11, article 276, 2011
7. Fasola G., Fanin R., Gherlinzoni F. et al. Serum LDH concentration in non-Hodgkin`s lymphomas. Relationship to histologic type, tumor mass and presentation features. Acta Haematologica, vol.72, nº4, 1984:231-238
8. Laniado-Laborin R., Adenosine deaminase in the diagnosis of tuberculosis pleural effusion: is it really an ideal test? A word of caution. Chest, vol.127, nº 2, 2005: 417-418
9. Weng S. C., Wu C. Y., Lymphoma presenting as peritoneal lymphomatosis with ascites. Journal of the Chinese Medical Association, vol.17, nº12, 2008: 646-650
10. Ghimire P., WU G. Y., Zhu L., Primary gastrointestinal lymphoma. World Journal of Gastroenterology, 2011: 697-707
11. Bairey O., Ruchlemer r., Shpilberg O., Non-Hodgkin`s lymphomas of the colon. Israel Medical Association Journal, vol.8, nº 12, 2006: 832-835
12. Musallam K. M., Taher A. T., Shamseddine A. I., Burkitt´s lymphoma of the colon and bronchi: three case reports. Cases Journal 2008, 1:15.




