A insuficiência hepática aguda pode ser causada por ingestão de cogumelos que contêm hepatotoxinas, entre as quais as amatoxinas. Ainda que a incidência exata de intoxicação por cogumelos não seja conhecida, sobretudo atendendo ao elevado número de casos não reportados, a intoxicação por amatoxinas é um problema global, dada a sua facilidade de acesso e distribuição alargada (1). Cerca de 50 a 100 casos fatais são descritos anualmente na europa ocidental, sendo menos frequentes nos estados unidos (2). A intoxicação por amatoxinas é causada pelas espécies de cogumelos Amanita, Galerina e Lepiota, sendo que a maioria dos casos fatais é atribuída ao cogumelo Amanita Phalloides, facilmente confundido com cogumelos de ingestão comum (3). Contudo, a informação e educação sobre os seus efeitos nocivos permanece escasso (4).
Mecanismo da toxicidade por Amanita e patofisiologia da lesão hepática
A toxicidade por Amanita Phalloides está relacionada com dois tipos de toxinas: as phallotoxinas e amatoxinas. As primeiras promovem distúrbios na membrana celular dos enterócitos, causando os sintomas de náuseas, vómitos e diarreia, comum à maior parte dos pacientes (3, 5). Ainda que a sua hepatotoxicidade seja elevada, as phallotoxinas não são absorvidas no intestino, pelo que não chegam ao fígado (5). Entre as amatoxinas, a α e β amanitinas são as responsáveis pela maior parte dos efeitos tóxicos do cogumelo, não sendo destruídas ao cozinhar. As doses consideradas letais são extremamente baixas, sendo que 0.1 mg por kg de peso pode ser fatal, sendo suficiente a ingestão de apenas um cogumelo. As amanitinas são absorvidas através do epitélio intestinal e unem-se debilmente às proteínas séricas. O fígado é o principal órgão afetado por ser o primeiro destino das amatoxinas após a absorção, produzindo-se nos hepatócitos necrose centrotubular extensa (5, 6). Cerca de 60% da α amanitina absorvida é excretada na bílis e devolvida através da circulação enterohepática (5). Outros órgãos são suscetíveis à sua toxicidade, nomeadamente os rins. Contudo, danos celulares também podem ser encontrados no pâncreas, glândulas adrenais e testículos (7). As amanitinas interagem diretamente com a enzima ARN polimerase II nas células eucarióticas inibindo a sua transcrição, resultando no declínio progressivo do ARN mensageiro, síntese proteica inadequada e morte celular (8).
Manifestações clínicas e diagnóstico
O quadro clínico após intoxicação por Amanita Phalloides pode variar desde uma apresentação subclínica até um quadro fulminante e letal. Consequentemente, nem todos os pacientes intoxicados por Amanita Phalloides irão desenvolver insuficiência hepática aguda com um desenlace fatal. A severidade da intoxicação depende da quantidade de toxinas ingeridas e do tempo decorrido entre a ingestão e início do tratamento. Assim, a intoxicação por Amanita Phalloides pode ser dividida em quatro períodos consecutivos (1, 2):
Fase latente: Uma vez que as toxinas não são irritantes por si só, a fase inicial é habitualmente assintomática, decorrendo entre as 8 e 40 horas pós-ingestão (média 10 horas).
Fase gastrointestinal: Caracterizada por surgimento de náuseas, vómitos, dor abdominais tipo cólica e diarreia secretória severa, que pode incluir conteúdo sanguinolento. Esta fase pode ser suficientemente severa para resultar em distúrbios ácido-base, alterações eletrolíticas, hipoglicemia, desidratação e hipotensão. Esta fase dura entre 12 e 24 horas.
Fase convalescente: O terceiro período, também apelidado de “lua-de-mel”, caracteriza-se pela regressão dos sintomas gastrointestinais às 36 a 48 horas pós ingestão. Apesar da melhoria aparente, os efeitos das toxinas continuam a danificar tanto o fígado como os rins, resultando na alteração progressiva das transaminases séricas (alanina aminotransferase - ALT e aspartato aminotransferase - AST) e desidrogenase láctica (LDH), terminando frequentemente com a instauração de icterícia.
Fase de insuficiência hepática aguda: A fase tardia, muitas vezes fatal, decorre habitualmente entre as 48 horas e 96 horas pós-ingestão (9). Aqui, as transaminases séricas aumentam significativamente, acompanhando a deterioração das funções hepática e renal, resultando em hiperbilirrubinemia, coagulopatia, hipoglicemia, acidose metabólica, encefalopatia hepática e síndrome hepatorenal (10). A disfunção multiorgânica, coagulação intravascular disseminada, trombose mesentérica, convulsões e morte podem acontecer entre 1 e 3 semanas pós ingestão.
O diagnóstico baseia-se num levantamento cuidadoso da história clínica e sintomas, podendo ser confirmado por exames laboratoriais. A primeira tarefa é estabelecer a ligação entre a apresentação clínica e a ingestão de cogumelos, uma vez que esta associação pode ser comprometida pelo atraso no aparecimento de sintomas. A descrição dos cogumelos ingeridos, o ambiente onde foram colhidos, o número e tipo de espécies ingeridas, a forma de conservação, preparação culinária e sintomatologia noutros indivíduos que tenham ingerido a mesma refeição são pontos – chave da anamnese. As amanitinas são resistentes ao calor e mantêm-se ativas mesmo após longos períodos de conservação. Estes aspetos poderão ser úteis no diferencial diagnóstico, nomeadamente excluindo contaminações bacterianas ou por outro tipo de tóxicos.
A análise dos níveis de amatoxinas séricas não está disponível para uso clinico. O único teste específico existente em alguns países europeus e nos estados unidos é a deteção de amatoxinas na urina. Este teste apenas confirma ou excluí o diagnóstico, não sendo útil para estratificar a severidade da intoxicação (11). Finalmente, a identificação dos cogumelos não ingeridos por um biólogo pode tornar-se crucial para o diagnóstico.
Opções de tratamento
Não existe antídoto específico para as amatoxinas e a eficácia clínica dos tratamentos descritos para a intoxicação por Amanita Phalloides permanece desconhecida pela inexistência de estudos randomizados. A abordagem destes pacientes consiste numa abordagem imediata, tratamento de suporte, intervenções específicas e transplante renal (2, 12).
1 Abordagem imediata: Consiste em procedimentos de descontaminação tais como lavagem gástrica e irrigação intestinal, estando muito dependentes de uma execução antecipada. Dado que o período assintomático costuma passar despercebido pela longa latência dos sintomas, estas intervenções têm uma utilidade reduzida.
2 Tratamento de suporte: Deve ser dirigido a corrigir a desidratação, os distúrbios hidroelectrolíticos e a acidose metabólica característica da fase gastrointestinal.
3 Intervenções específicas:
Procedimentos de desintoxicação: Consistem em duas abordagens distintas: na redução da absorção intestinal e promoção da sua excreção. Entre estas incluem-se a administração repetida de carvão ativado com o intuito de evitar a reabsorção das toxinas pela circulação enterohepática; a aspiração gastroduodenal através de entubação nasogástrica; o reforço da diurese de forma a promover a excreção urinária; procedimentos de purificação extracorporal. O tratamento com o Molecular Adsorbent Recirculating System (MARS) foi recentemente descrito (13). O MARS consiste numa técnica dialítica modificada que mimetiza as funções biológicas da membrana do hepatócito, transferindo metabólitos tóxicos entre a corrente sanguínea e um compartimento dialítico específico para o efeito. Este método demonstrou melhorar a função hepática mas a sua eficácia na intoxicação por Amanita Phalloides não está definitivamente comprovada. Ainda assim, é globalmente aceite que esta técnica pode ser útil nos estádios precoces da doença (14).
Outras terapêuticas: Estudos retrospetivos sugerem que tanto a silibinina como a N-acetilcisteína podem ser eficazes na abordagem de doentes intoxicados por Amanita Phalloides (2, 12). A silibinina (derivado solúvel da silimarina) compete com as amatoxinas pelo transporte transmembranar inibindo a penetração das amanitinas nos hepatócitos, tendo assim um efeito protetor. As doses recomendadas são 20 a 50 mg/kg/dia endovenoso, sendo que o tratamento deve ser mantido entre 48 a 96 horas. A silimarina também pode ser administrada via oral, em dose entre 1.4 a 4.2 g/dia. A penicilina G aparenta possuir um mecanismo de ação semelhante, removendo a amanitina das proteínas de ligação para as plasmáticas, promovendo assim a sua excreção. A penicilina G é usada em administração endovenosa contínua (1,000,000 IU/kg no primeiro dia e após 500,000 IU/kg nos dois dias seguintes) (15). O uso de N-acetilcisteína foi também sugerido como tendo um efeito protetor antioxidante a nível hepático, sendo que a sua eficácia não está comprovada. A N-acetilcisteína é administrada na forma endovenosa, usualmente em dextrose 5%. A dose sugerida é de 150 mg/kg em 15 minutos, seguido de 50 mg/kg em 4 horas e 100 mg/kg em 16 horas.
4 Transplante hepático e fatores influenciadores de prognóstico
A taxa de mortalidade após intoxicação por Amanita Phalloides varia entre 10 a 20% (12), sendo o prognóstico mais reservado em crianças. Os pacientes que desenvolvam lesão hepática aguda severa devem ser propostos para transplante, existindo duas opções cirúrgicas: transplante hepático ortóptico e transplante parcial auxiliar. O maior desafio nestes doentes é encontrar o melhor timing para o transplante: se demasiado cedo, existirão casos em que os pacientes poderiam ter sobrevivido sem o transplante evitando-se o impacto na qualidade de vida; se demasiado tarde, o paciente poderá falecer enquanto aguarda um dador adequado. Os critérios para transplante hepático mostram-se no quadro I. Denote-se que apenas os critérios de Ganzert foram elaborados especificamente para intoxicação por Amanita Phalloides (2) (quadro I – critérios para transplante hepático).
ObjetivosO objetivo principal é descrever quatro casos de intoxicação por Amanita Phalloides ocorridos na Unidade Hospitalar de Bragança.
Material e métodosDescrição de quatro casos clínicos de intoxicação acidental ocorridos em membros da mesma família por cogumelos posteriormente identificados como Amanita Phalloides.
ResultadosCaso I: Criança do género feminino de 5 anos de idade, sem antecedentes patológicos conhecidos, é admitida ao Serviço de Urgência com 12 horas de evolução de sintomatologia gastrointestinal, nomeadamente vómitos frequentes (inicialmente alimentares), acompanhados de diarreia muco sanguinolenta, tendo tido mais de dez dejeções no período pré-admissão. Apresentava ainda sinais de desidratação, sonolência e prostração, acompanhados de ausência de febre.
Foi admitida a Internamento de Pediatria onde apresentou evolução analítica desfavorável, com elevação significativa do nível de transaminases (ALT até 495 e AST até 245 vezes acima do limite superior da normalidade), prolongamento do tempo de protrombina superior a 135 segundos, acompanhados de disfunção neurológica grave e necessidade de referenciação emergente para transplante hepático ao 3º dia de internamento (quadro II - Evolução analítica entre os dias 1 e 3 de Internamento).
Foi apenas ao terceiro dia que houve conhecimento e confirmação micológica por perito, após análise laboratorial de três exemplares dos cogumelos obtidos na mesma colheita. Tendo também em consideração as semelhanças com os quadros de apresentação clínica da restante família, diagnosticou-se a intoxicação por Amanita Phalloides.
O tratamento até à data de transferência consistiu em fluidoterapia, ceftriaxone (1gr E.V./dia), penicilina G cristalizada (2.000.000 U/dia), acetilcisteína (1gr E.V./dia) e fitomenadiona (10 mg E.V.). Apesar da gravidade do caso, não foram utilizadas as técnicas de diálise extracorporal anteriormente descritas, nomeadamente o MARS.
A paciente foi submetida ao primeiro transplante hepático no dia seguinte à transferência intra-hospitalar, complicado de trombose portal que implicou novo transplante após três dias. Posteriormente, iniciou de processo de rejeição do enxerto a partir de Janeiro de 2012, tendo a biopsia hepática revelado hepatite peri-portal e lobular com lesão ductal associada. À data de realização deste trabalho, a paciente mantém-se clinicamente estável com seguimento em Consulta Externa.
Caso II: Feminino de 67 anos (reformada, previamente professora), antecedentes de Insuficiência Cardíaca estádio II New York Heart Association (NYHA) de etiologia valvular, Pancreatite Crónica Litiásica e alergia ao contraste iodado, é admitida em Unidade de Cuidados de Nível Intermédio – Serviço de Urgência.
Na admissão, apresentava sintomatologia gastrointestinal, nomeadamente vómitos alimentares, dejeções diarreicas e disfunção neurológica aguda com quadro de agitação psicomotora com necessidade de sedação. Analiticamente, apresentava alterações da função renal e hepática, com registo de ALT 34 vezes e AST 8 vezes superior ao normal (quadro II).
Casos III e IV: Os restantes adultos, masculino de 34 anos (comerciante) e feminino de 41 anos (engenheira agrónoma), sem antecedentes patológicos conhecidos, apresentavam, além da sintomatologia gastrointestinal desidratação sem outras queixas acompanhantes. Analiticamente, destaca-se prolongamento do valor de tempo de protrombina em 10 segundos (Figura 1: Evolução dos Tempo de Protrombina nos quatro casos)
Os 3 adultos foram tratados agressivamente com fluidoterapia, carvão ativado (50 gr de 4 em 4 horas), acetilcisteína, penicilina G (1 milhão de unidades/kg de peso/dia) e silibinina (20 mg/kg de peso/dia) com evolução clínica e laboratorial favoráveis tendo alta hospitalar entre o 5º e 8º dias de internamento.
Em nenhum dos casos foi possível efetuar o doseamento urinário dos níveis de toxinas.
Discussão/ConclusãoA presunção diagnóstica à entrada no caso da criança foi de gastroenterite aguda, dado o quadro de vómitos e dejeções abundantes com características mucosas e sem sangue. No entanto, e ao contrário dos restantes casos, houve progressão clinica desfavorável rápida e fulminante, para falência hepática aguda com disfunção neurológica, com necessidade de referenciação da doente para transplante hepático urgente. A insuficiência hepática aguda decorrente de intoxicação por Amanita Phalloides em crianças tem um prognóstico reservado, com taxas de mortalidade descritas entre 80 a 90% na ausência de transplante hepático (16). Contudo, a magnitude da elevação das transaminases assim como como a rapidez do seu declínio não são úteis para estabelecer prognóstico (17). A quantidade de toxina ingerida por kg de peso corporal parece ter contribuído para a gravidade clinica e progressão fulminante da insuficiência hepática na criança, comparativamente à dos adultos.
Em relação aos três adultos, o diagnóstico também não foi estabelecido na apresentação inicial, dada a pouca especificidade da sintomatologia gastrointestinal. A paciente de 67 anos evoluiu de forma favorável apesar do quadro neurológico leve, sem défices neurológicos focais, critérios de encefalopatia hepática grave ou coma hepático. Contudo, realça-se que a encefalopatia hepática não é entendida como um requisito único absoluto para a decisão a favor de transplante hepático.
A hipótese de intoxicação foi apenas colocada após o controlo analítico e quando se estabeleceram semelhanças nas histórias entre os quatro membros da família. Assim, foi com base nos critérios analíticos de alarme e evolução desfavorável, sobretudo pelo quadro de prostração e agravamento do estado geral no caso da criança que foram consideradas outras possibilidades diagnósticas menos frequentes.
Conforme descrito, a evidência sobre as medidas terapêuticas a adotar nestes casos é muito limitada (3). Nomeadamente, denota-se a inexistência de estudos interventivos randomizados que comprovem a eficácia de qualquer das abordagens sugeridas. No entanto, são globalmente aceites os quatro tipos de medidas (18), nomeadamente abordagem imediata, tratamento de suporte, medidas específicas como penicilina ou silibinina, técnicas de depuração extracorporal e finalmente transplante hepático (1, 2, 19).
A descrição de casos graves e fatais por intoxicação por Amanita Phalloides tem vindo a aumentar nos últimos anos (1), sendo a sua incidência habitualmente maior nos meses de Novembro e Dezembro (20). A informação acerca de exposição e intoxicação a substâncias naturais é muitas vezes insuficiente e incorreta devendo ter os clínicos elevado nível de suspeição, considerando a ingestão de cogumelos com amatoxinas. A possibilidade de aceder, identificar e analisar exemplares dos fungos torna-se também determinante na prontidão da abordagem destes doentes. Simultaneamente, a disponibilidade de testes de doseamento urinário de amatoxinas poderá ser fulcral para confirmar a suspeita diagnóstica.
O reconhecimento precoce do quadro permite não só otimizar as medidas de suporte enunciadas como aumentar a vigilância clínica prevenindo a possível falência orgânica que é potencialmente fatal. Os pacientes com disfunção neurológica e coagulopatia grave devem ser referenciados a transplante hepático urgente (21), sendo a técnica de depuração extracorporal (MARS) uma opção válida que permite ganhar tempo nos casos de maior severidade (2).
Figura I
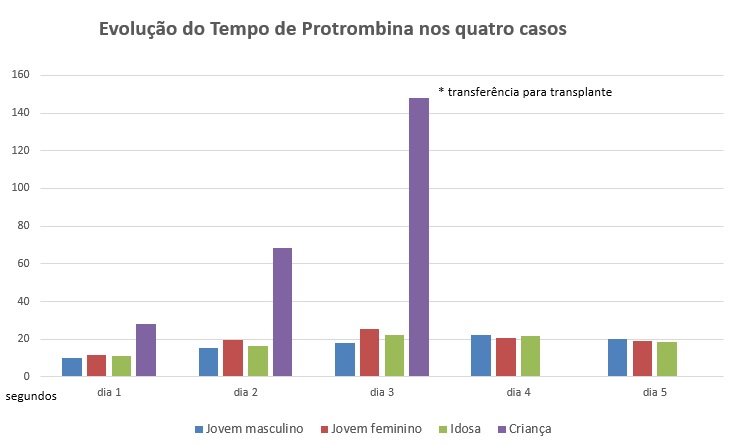
figura 1 Evolução dos Tempo de Protrombina nos quatro casos
Figura II

quadro I critérios para transplante hepático
Figura III
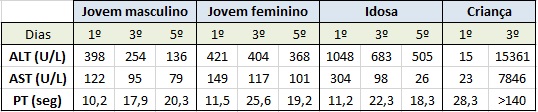
quadro II Evolução analítica entre os dias 1 e 3 de Internamento
BIBLIOGRAFIA
1. Roberts DM, Hall MJ, Falkland MM, Strasser SI, Buckley NA. Amanita phalloides poisoning and treatment with silibinin in the Australian Capital Territory and New South Wales. Medical Journal of Australia.198(1):43-7. PubMed PMID: 23330770.
2. Santi L, Maggioli C, Mastroroberto M, Tufoni M, Napoli L, Caraceni P. Acute liver failure caused by amanita phalloides poisoning. International Journal of Hepatology. 2012 (487480). PubMed PMID: 2012475944.
3. Serne EH, Toorians AWFT, Gietema JA, Bronsveld W, Haagsma EB, Mulder POM. Amanita phalloides, a potentially lethal mushroom: Its clinical presentation and therapeutic options. Netherlands Journal of Medicine. 1996 July;49(1):19-23. PubMed PMID: 1996269507.
4. Trim GM, Lepp H, Hall MJ, McKeown RV, McCaughan GW, Duggin GG, et al. Poisoning by Amanita phalloides (´deathcap´) mushrooms in the Australian Capital Territory. Medical Journal of Australia. 1999 06 Sep;171(5):247-9. PubMed PMID: 1999319979.
5. Broussard CN, Aggarwal A, Lacey SR, Post AB, Gramlich T, Henderson JM, et al. Mushroom poisoning - From diarrhea to liver transplantation. American Journal of Gastroenterology. 2001;96(11):3195-8. PubMed PMID: 2001415842.
6. Horgen PA, Vaisius AC, Ammirati JF. The insensitivity of mushroom nuclear RNA polymerase activity to inhibition by amatoxins. Archives of Microbiology.118(3):317-9. PubMed PMID: 567964.
7. Olson KR, Pond SM, Seward J. Amanita phalloides-type mushroom poisoning. Western Journal of Medicine. 1982;137(4):282-9. PubMed PMID: 1983042884.
8. Gibbons RB. Mushroom poisoning. Comprehensive Therapy. 1982;8(12):33-9. PubMed PMID: 1983095383.
9. Ferenc T, Lukasiewicz B, Ciecwierz J, Kowalczyk E. Poisonings with Amanita phalloides.
Zatrucia muchomorem sromotnikowym (Amanita phalloides). Medycyna pracy. 2009;60(5):415-26. PubMed PMID: 19999046.
10. Paaso B, Harrison DC. A new look at an old problem: mushroom poisoning. Clinical presentations and new therapeutic approaches. American Journal of Medicine.58(4):505-9. PubMed PMID: 1124787.
11. Butera R, Locatelli C, Coccini T, Manzo L. Diagnostic accuracy of urinary amanitin in suspected mushroom poisoning: A pilot study. Journal of Toxicology - Clinical Toxicology. 2004;42(6):901-12. PubMed PMID: 2004460756.
12. Enjalbert F, Rapior S, Nouguier-Soule J, Guillon S, Amouroux N, Cabot C. Treatment of amatoxin poisoning: 20-Year retrospective analysis. Journal of Toxicology - Clinical Toxicology. 2002;40(6):715-57. PubMed PMID: 2002443918.
13. Wittebole X, Hantson P. Use of the molecular adsorbent recirculating system (MARS) for the management of acute poisoning with or without liver failure. Clinical Toxicology. 2011 November;49(9):782-93. PubMed PMID: 2011630752.
14. Faybik P, Hetz H, Baker A, Bitterman C, Berlakovich G, Werba A, et al. Extracorporeal albumin dialysis in patients with Amanita phalloides poisoning. Liver International. 2003;23(SUPPL. 3):28-33. PubMed PMID: 2003414623.
15. Hruby K, Csomos G, Fuhrmann M, Thaler H. Chemotherapy of Amanita phalloides poisoning with intravenous silibinin. Human Toxicology. 1983;2(2):183-95. PubMed PMID: 1983219309.
16. Cochran JB, Losek JD. Acute liver failure in children. Pediatric Emergency Care. 2007 February;23(2):129-35. PubMed PMID: 2007130417.
17. Dhawan A. Etiology and prognosis of acute liver failure in children. Liver transplantation : official publication of the American Association for the Study of Liver Diseases and the International Liver Transplantation Society. 2008 Oct;14 Suppl 2:S80-4. PubMed PMID: 18825678.
18. Parish RC, Doering PL. Treatment of Amanita mushroom poisoning: A review. Veterinary and Human Toxicology. 1986;28(4):318-22. PubMed PMID: 1986177487.
19. Duffy TJ, Vergeer PP. Amanita poisoning: treatment and role of liver transplantation. The American journal of medicine. 1989 Aug;87(2):244. PubMed PMID: 2757069.
20. Thaler T, Aceto L, Kupferschmidt H, Mullhaupt B, Greutmann M. First intoxication with freshly picked Amanita phalloides in winter time in central Europe. Journal of Gastrointestinal and Liver Diseases. 2008 March;17(1):111. PubMed PMID: 2008194784.
21. Klein AS, Hart J, Brems JJ, Goldstein L, Lewin K, Busuttil RW. Amanita poisoning: Treatment and the role of liver transplantation. American Journal of Medicine. 1989;86(2):187-93. PubMed PMID: 1989049632.

