Introdução
As Síndromes Poliglandulares Auto-Imunes (SPA) foram inicialmente definidas como insuficiência de múltiplas glândulas endócrinas associadas a uma doença Auto-Imune subjacente.1A combinação de Doença de Addison (DA) e tiroidite linfocítica crónica foi pela primeira vez identificada porSchmidtem 1926. Desde então, a coexistência de DA e patologia tiroidiea auto-imune (PTAI) designa-se por Síndrome deSchmidt.2
Em 1980,NeufeldeBlizzardpropuseram a classificação das SPA em 4 tipos baseando-se exclusivamente em critérios clínicos. A SPA-1 caracteriza-se pela presença de candidíase, hipoparatiroidismo e DA. É uma síndrome rara que se manifesta em idade jovem e com um padrão genético monogénico, autossómico recessivo que se correlaciona com várias mutações do gene regulador auto-imune (AIRE 1) localizado no cromossoma 21. A SPA-2 caracteriza-se pela presença de DA em 100% dos casos associada a PTAI (hipo ou hipertiroidismo) e/ou a Diabetes Mellitus tipo 1 (DM1). É uma síndrome rara, mais frequente no género feminino, dependente de padrões genéticos mais complexos e associados aohuman leukocyte antigen(HLA) DR3/DR4. A associação entre PTAI com outras patologias auto-imunes, à excepção de DA, DM1 ou hipoparatiroidismo, classifica-se como APS-3. Todas as outras combinações clínicas de doenças endócrinas auto-imunes diferentes das referidas anteriormente são classificadas com APS-4 (Tabela 1).1Actualmente, ainda que todos os tipos possam ser caracterizáveis do ponto de vista clínico como síndromes diferentes3, existe a tendência para considerar a SPA-3 e a SPA-4 como apresentações possíveis de SPA-2, considerando-se apenas dois tipos, a SPA-1 e SPA-2.5
A DA é de etiologia auto-imune em cerca de 83% dos casos e destes 41% enquadram-se num SPA-2.3Todos os doentes com SPA-2 apresentam DA2e esta é a primeira manifestação da síndrome em 50% dos casos, simultânea com PTAI ou DM1 em 20% dos casos e em 30% dos casos surge posteriormente a qualquer uma delas.4Apresenta-se, habitualmente, como uma insuficiência supra-renal primária crónica e por isso as manifestações mais frequentes são o mal-estar crónico, astenia, fadiga que agrava com o esforço, anorexia e perda de peso.4A hipoglicemia não é frequente. Outras manifestações podem surgir como os sintomas gastrointestinais, hipotensão, alterações hidro-electrolíticas (hiponatremia em 90%, hipercaliemia em 65% e hipercalcemia em 6-66%).6Anticorpos anti-córtex da supra-renal (ACA) estão presentes em 89% dos casos enquanto que anticorpos anti-21-hidroxilase estão presentes em 91% dos casos; se doseados na altura do diagnóstico de DA, a positividade ocorre em 100% dos casos.2A tomografia computorizada (TC) ou a ressonância magnética nuclear (RMN) das glândulas supra-renais habitualmente revela glândulas normais ou pequenas mas a tendência é para a atrofia progressiva.2
A PTAI manifesta-se em 69-82% dos casos, quer como doença de Graves que se desenvolve previamente à DA quer como tiroidite crónica que se desenvolve simultaneamente com DA e tem apresentação mais tardia, aos 40 anos.2
A DM1 ocorre em cerca de 30-52% dos doentes e a idade média de apresentação é inferior a 28 anos. No contexto de SPA-2, verifica-se com frequência anticorpos positivos: anti-antigénio das células dos ilhéus de Langherans, anti-glutamato descarboxilase e anti-segundo antigénio das células dos ilhéus de Langerhans.2
O hipoparatiroidismo não se verifica nesta síndrome. A alopécia e a anemia perniciosa são muito menos frequentes do que no SPA-1.4O hipopituitarismo, devido a hipofisite auto-imune, causando preferencialmente défice de ACTH (adrenocorticotropic hormone), pode ocorrer em combinação com défice deTSH (thyroid-stimulating hormone) e, raramente, com défice de GH (growth hormone).4Outras patologias auto-imunes não endócrinas podem ocorrer esporadicamente tal como o vitiligo, a miastenia gravis, a púrpura trombocitopénica idiopática, a síndrome de Sjögren, artrite reumatóide e a serosite pericárdica ou pleural.4
A incidência de SPA-2 é de 1,4-4,5 por cada 100000 habitantes. A idade média de apresentação da doença são os 35 anos, é muito rara em crianças e é mais prevalente no género feminino com uma razão mulheres/homens de 2,7-3,7:1.1A SPA-2 ocorre frequentemente em várias gerações da mesma família de uma forma autossómica dominante com um padrão de penetrância incompleta.1,2,5,6Existe uma prevalência de doença auto-imune aumentada em familiares de 1º grau com SPA-2.1,2,5,6O HLA tem um papel central na determinação das respostas das células T aos antigénios e vários alelos do HLA foram associados a várias patologias auto-imunes mediadas por células T.1As alterações genéticas parecem resultar em diminuição da capacidade das células T reguladoras CD4+e CD25+em suprimir a auto-reactividade. Este aspecto verifica-se apenas na SPA-2 e não nas endocrinopatias isoladamente.5Para explicar o envolvimento de múltiplos órgãos colocou-se a hipótese de a patologia se verificar em órgãos com a mesma origem embrionária o que não é válido para a SPA-2.2Outro aspecto importante é a origem da auto-reactividade: será que resulta da activação num dado momento de um clone de linfócitos auto-reactivos ou esta activação vai ocorrendo ao longo da vida?2O facto de existir no momento do diagnóstico positividade para vários anticorpos sugere a primeira hipótese.2
Casos clínicos
Apresentamos dois casos clínicos de doentes com o diagnóstico prévio de hipotiroidismo auto-imune (HAI) em que a terapêutica de substituição hormonal com levotiroxina tornou evidente uma insuficiência supra-renal, que se apresentou de forma aguda, permitindo estabelecer o diagnóstico de SPA-2.
Caso clínico nº1:
Mulher de 35 anos, HAI diagnosticada em 2005, com valores de anticorpos anti-tireoglobulina de 625 UI/mL e anti-peroxidase de 2312 UI/mL e ecografia tiroideia normal. Medicada com levotiroxina, apresentava função tiroideia estável. Sem história familiar relevante. Referenciada à consulta de Medicina Interna em 2008 por astenia intensa e vários episódios de lipotímia com 3 meses de evolução. O último episódio de lipotímia ocorreu no Verão, com pressão arterial de 70/40 mmHg, taquicardia sinusal 120 bpm, hiponatremia 124 mmol/L e discreta hipercaliemia 5,3 mmol/L. Melhoria transitória com fluidoterapia. Ao exame objectivo, apresentava hiperpigmentação cutânea e mucosa; hipotensão arterial sem hipotensão ortostática; tiróide palpável, móvel com a deglutição, sem nódulos; restante exame físico sem particularidades. Analiticamente, valores de cortisol <0,02 mcg/dL, ACTH >1250 pg/mL, renina = 246,4 U/mL, aldosterona = 3 ng/dL e glicose = 95 mg/dL (Tabela 2). Do estudo imunológico, apresentava anticorpos anti-21-hidroxilase >5000 U/ml e anticorpos anti-células parietais e anti-factor intrínseco negativos. Não apresentava alterações na TC das glândulas supra-renais. Perante DA, foi medicada com dexametasona 0,5 mg/Kg e fludrocortisona 100 microg/dia.
Caso clínico nº2:
Homem de 27 anos, HAI diagnosticada em Novembro de 2007 na sequência da investigação de astenia, naúseas, vómitos, desconforto abdominal, diarreia, perda ponderal Na altura do diagnóstico, apresentava TSH 153,3 ng/mL, T4 livre de 5,15 ng/mL e T3 livre normal com anticorpos anticorpos anti-tireoglobulina 71,3 UI/mL e anti-peroxidase 66 UI/mL e ecografia tiroideia normal. Medicado desde então com levotiroxina 100 mg/dia, com função tiroideia estabilizada. Em Fevereiro de 2008, recorreu ao SU por fadiga fácil, anorexia perda de peso e alterações da memória. Ao exame objectivo, apresentava áreas de hiperpigmentação cutânea; tiróide não palpável; restante exame sem particularidades. Analiticamente, anemia microcítica e normocrómica (hemoglobina 10,6 g/dl; volume globular médio de 81 fl), sem alterações iónicas. Internado no Serviço de Medicina Interna. Do estudo analítico realizado, função tiroideia estabilizada, cortisol sérico<0,02 mcg/dl, cortisol urinário = 827,4 mcg/dia, ACTH 1356 pg/ml e glicose = 90 mg/dl (Tabela 2). Sem resposta na prova de estimulção da ACTH. A TC das glândulas supra-renais revelou glândulas vestigiais (Fig. 1). Por insuficiência supra-renal, de provável etiologia auto-imune, iniciou corticoterapia e evidenciou boa evolução clínica com melhoria da sintomatolgia.
Discussão
Os casos clínicos apresentados permitem caracterizar a evolução para SPA-2 a partir de uma patologia auto-imune previamente diagnosticada. Perante dois casos de HAI, foi diagnosticada DA após início de terapêutica com levotiroxina. Em ambos os casos e para alguns autores1,2,5inicialmente estaríamos perante uma SPA-2 incompleta, embora tal definição não seja consensual.
Podemos identificar 3 fases na SPA-2: potencial, sub-clínica e clínica. Na fase potencial, apenas são detectáveis anticorpos, marcadores de doença sem lesão de órgão-alvo e são classificados nesta fase os doentes com DA e anti-antigénio das células dos ilhéus de Langherans positivos com teste de tolerância oral à glicose negativo, bem como doentes com DM1 e anticorpos anti-córtex da supra-renal ou anti-21-hidroxilase positivos com função supra-renal normal.1,2Na fase sub-clínica, existem já alterações nos testes funcionais (teste de tolerância oral à glicose positivo ou insuficiência supra-renal sub-clínica) (Tabela 2).1,2Se tivermos esta abordagem em conta, podemos identificar SPA-2 incompleta em doentes com apenas uma das patologias constitutivas. Aliás, uma apresentação inicial com SPA-2 completa é rara.1,2Por isso, os doentes com apenas uma das patologias auto-imunes características da SPA-2 constituem a ponta doiceberge podem muito apresentar outras doenças em estadio latente.1,2Nos casos clínicos apresentados a hipótese de SPA-2 incompleta não foi considerada no momento do primeiro diagnóstico, dado não existirem dados da história clínica que a suportassem. Posteriormente, perante contexto clínico pertinente, a investigação dirigiu-se naturalmente para avaliar a DA subjacente, que se confirmou.
O diagnóstico e a terapêutica precoce podem ser benéficos antes de se estabelecer o diagnóstico definitivo.1,2Assim, perante a patologia inicial ostatusde anticorpos é importante para a classificação da doença e portanto anticorpos anti-supra-renal, anti-tiroideus e anti-pancreáticos devem ser doseados.1,2Além disso, doentes com apenas uma das patologias constitutivas devem ser avaliados para a possível presença das outras alterações funcionais através do doseamento de função tiroideia da prova de tolerância oral à glicose e do teste da ACTH, identificando-se desta forma doentes já em fase sub-clínica ou em fase potencial com um alto risco de vir a desenvolver SPA-2 clínica.1,2Apesar de menos de 1% dos doentes com PTAI ou DMI virem a desenvolver DA, faz sentido o screening de DA em doentes com história familiar sugestiva ou suspeita clínica de SPA-2.6O screening de outras patologias auto-imunes, nomeadamente de Doença Celíaca ou Anemia Perniciosa não está indicado.7
Após o diagnóstico de insuficiência supra-renal e em contexto de patologia auto-imune prévia, os anticorpos anti-21-hidroxilase devem ser doseados para confirmar etiologia auto-imune.1,8Estes anticorpos apresentam uma sensibilidade diagnóstica alta e estão presentes em 100% dos doentes com SPA-2 no momento do diagnóstico de DA.1,8,9
Um aspecto clínico importante e preponderante no diagnóstico de DA nos casos clínicos apresentados foi a instituição da terapêutica de substituição tiroideia, neste caso com levotiroxina. Nos doentes com HAI deve considerar-se a exclusão de DA antes da instituição da terapêutica, pois a levotiroxina aumenta o metabolismo hepático dos corticoesteróides, diminuindo a concentração de cortisol sérica, podendo precipitar hipotensão e crise adrenal.2Assim, nos doentes com SPA-2, a corticoterapia deve ser instituída sempre previamente à instituição da terapêutica de substituição tiroideia.2
A abordagem terapêutica dos SPA-2 baseia-se na terapêutica de substituição hormonal para cada um dos diferentes componentes da síndrome, devendo ser individualizada e de longa duração, com vigilância clínica e laboratorial frequente para eventual aparecimento de insuficiência hormonal dos outros órgãos.6Os doentes devem ser monitorizados regularmente com história clínica, exame físico e avaliação laboratorial apropriada.6Deve existir alerta médica para a função supra-renal destes doentes especialmente em contexto de doença, cirurgia ou emergência.6Os familiares devem conhecer o risco aumentado de doença endócrina, especialmente de SPA-2.6
Relativamente aofollow-up, a avaliação da função tiroideia é recomendada em todos os doentes com SPA-2 de 5 em 5 anos7e anualmente nos doentes com DM1. Deve ser excluída DA e PTAI quando há diminuição na necessidade de insulina nos DM1.6
Conclusão
A SPA-2 é uma patologia rara cujo diagnóstico depende de um alto grau de suspeição. Actualmente, as patologias auto-imunes são encaradas como doenças que ocorrem emclustersde associação e a SPA-2 é um dos mais típicos. O diagnóstico de novo de uma endocrinopatia implica a exclusão de uma etiologia auto-imune. Além disso, oscreeningde outras patologias auto-imunes é fundamental: pode existir doença latente subjacente e a identificação dos doentes em risco de desenvolver SPA fica assim facilitada. Oscreeningconsiste na avaliação da função tiroideia (T3 livre, T4 livre e TSH), na prova de tolerância oral à glicose e no teste da ACTH. Apesar de menos de 1% dos doentes com PTAI ou DM1 virem a desenvolver DA, o screening de DA está potencialmente indicado em doente com história familiar sugestiva ou suspeita clínica de SPA-2.6Na SPA-2, a instituição de corticoterapia deve preceder a instituição de terapêutica de substituição tiroideia.
Figura I

Figura 1 - Síndrome poliglandular auto-imune incompleta: combinações possíveis entre patologias endocrinológicas de base e doseamento de anticorpos.
Figura II
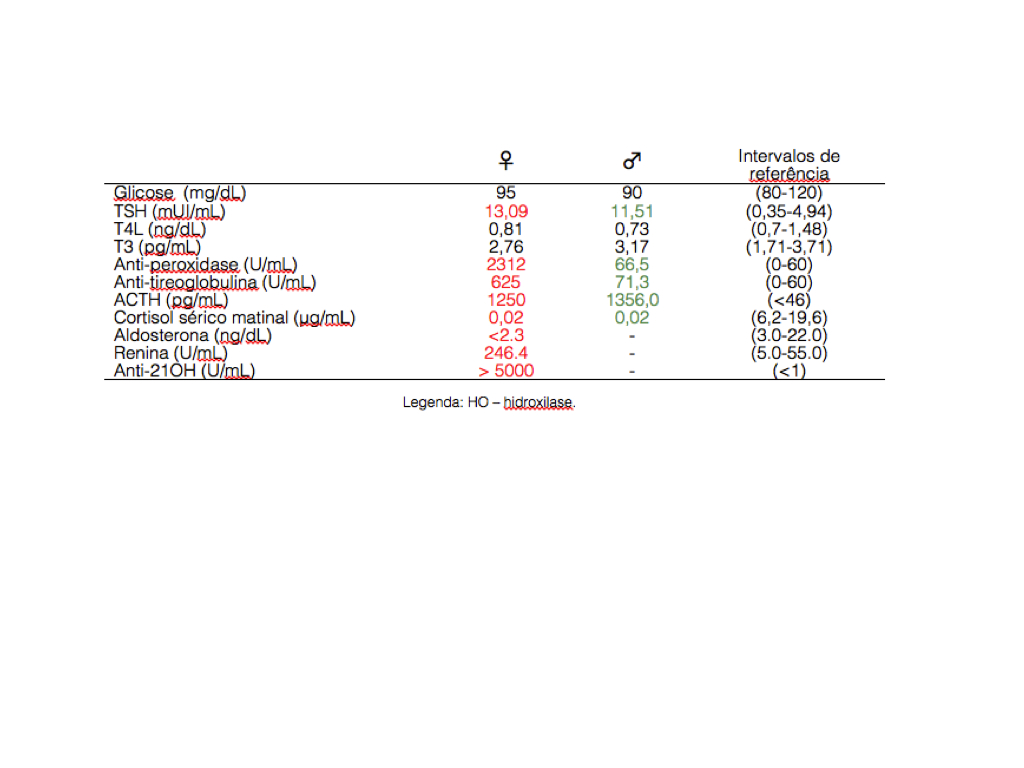
Figura 2 - Avaliação laboratorial dos doentes compatível com hipotiroidismo e insuficiência supra-renal auto-imune.
Figura III
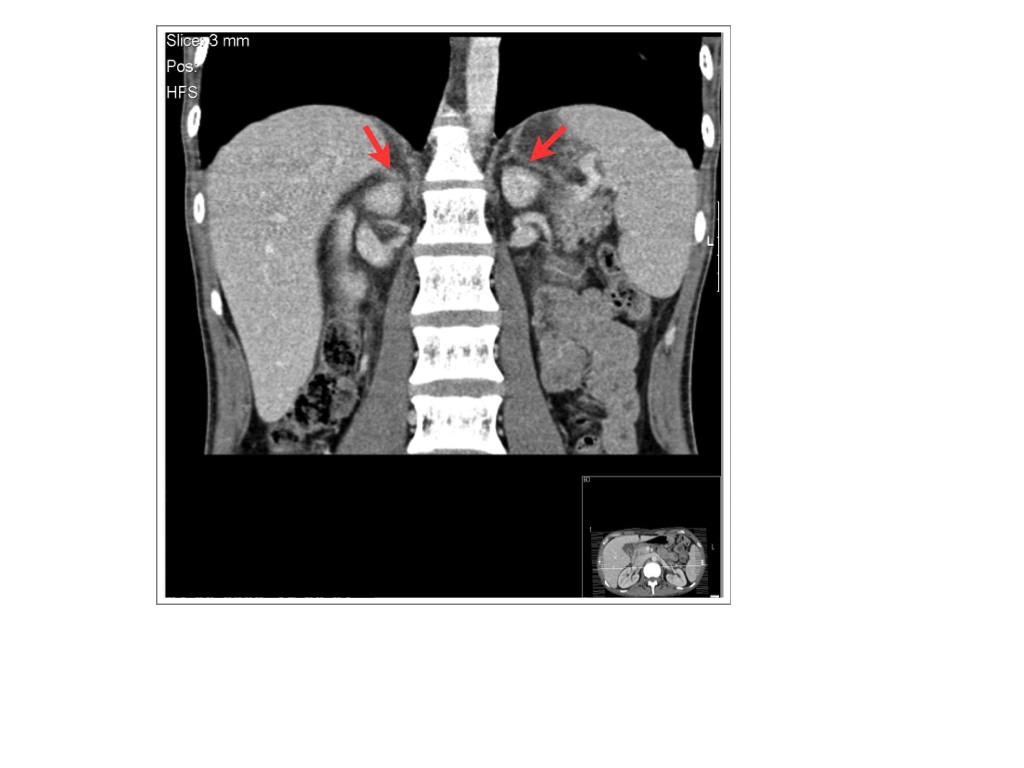
Figura 3 - RMN abdominal com atrofia das glândulas supra-renais.
BIBLIOGRAFIA
1. Betterle C, Zanchetta R. An update on autoimunne polyendocrine syndromes (APS). Acta Biomed. 2003 Apr;74(1):9-33. [PMID: 12817789].
2. Betterle C, Lazzarotto F, Presotto F. Autoimunne polyglandular syndrome Type 2: the tip of an iceberg? Clin Exp Immunol 2004; 137:225–233. [PMID: 15270837]
3. Betterle C, Dal Pra C, Mantero F, Zanchetta R. Autoimunne Adrenal Insuficiency and Autoimmune Polyendocrine Syndromes: Autoantibodies, Autoantigens, and Their Applicability in Diagnosis and Disease Prediction. Endocrine Reviews 23: 327-364, 2002. [PMID: 12050123].
4. Murray JS, Jayarajasingh R, Perros P. Deterioration of symptoms after start of thyroid hormone replacement. BMJ 2001;323:332–3. [PMID: 11498494].
5. Eisenbarth GS, Gottlieb PA. Autoimunne Polyendocrine Syndromes. N Engl J Med 2004;350:2068-79. [PMID: 15141045].
6. Graves III L, Klein RM, Walling AD. Addisonian Crisis Precipitated by Thyroxine Therapy. Southern Medical Journal. Volume 96, Number 8, August 2003, 824-827. [PMID: 14515930].
7. Majeroni BA, Patel P. Autoimunne Polyglandular Syndrome, Type II. Am Fam Physician 2007;75:667-70. [PMID: 17375512]
8. Michels AW, Eisenbarth GS. Autoimmune polyendocrine syndrome type 1 (APS-1) as a model for understanding autoimmune polyendocrine syndrome type 2 (APS-2). J Intern Med 2009; 265: 530–540. [doi: 10.1111/j.1365-2796.2009.02091.x.; PMID: 19382992].
9. Laureti S, Aubourg P, Calcinaro F, Rocchiccioli F, Casucci G, Angelleti G, Brunetti P, Lernmark A, Santeusanio F, Falorni A. Etiological Diagnosis of Primary Adrenal Insufficiency Using an Original Flowchart of Immune and Biochemical Marker. J Clin Endocrinol Metab 83: 3163–3168, 1998. [PMID: 9745420].
10. Meira C, Guerreiro E, Cruz R, Valle B, Melo P. Doença de Addison e Doença de Graves: implicações clínicas das manifestações poliglandulares – a propósito de um caso clínico. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo 2008;02:125-128.
11. Raposo JN, Sousa S, Namora J, Tomaz A, Raimundo L, Fernandes C, Ferreira JM. Síndrome de Schmidt – a propósito de um caso. Medicina Interna 2004; Vol.11; nº4: 183-186.
12. Queiroz MS. Diabetes Mellitus tipo I no Contexto das Poliendocrinopatias Auto-Imunes. Arq Bras Endrocrinol Metab 2008;52/2: 198-204. [PMID: 18438530].
13.Vieira A, Carrilho F, Carvalheiro M. Tiroidites auto-imunes: apresentação clínica e tratamento. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo 2008;02:45-56.
14. Malheiro F, Mendes R, Santos E, Mesquita T, Rocha I, Madruga I, Mello e Silva A. Síndroma Poliglandular Autoimune Tipo 2 – caso clínico. Medicina Interna 2009; Vol.16; nº2; Abr/Jun: 83-85.
15. Yersali Ö, Seymani G, Soysali D, Aydogan H, Sentenkin S, Sözen Y. Autoimunne Polyglandular Syndrome Type II: A Case Report.1Turk J Med Sci 35 (2005) 417-419.
16 M. Hsieh C, Chen HD, Wu DA. Polyglandular Autoimunne Syndromes – A Case Report. Tzu Chi Med J 2006,18, No. 5 385-388.
17. Becejac B, Bekic M, Misjak M, Solter M, Vrkljan M. Autoimunne Polyglandular Syndrome Type II - Case Report. Acta clin Croat 2001; 40:299-301.
18. Pereira NC, Rau CM, Araya VQ. Caso clínico: síndroma poliglandular autoimmune tipo II, forma de presentación en un paciente adulto. Rev Hosp Clín Univ Chile 2008; 19: 149 – 55.
19. Cutolo M. Autoimmune polyendocrine syndromes.Autoimmun Rev.2014 Feb;13(2):85-9.
20. Antonelli A, Ferrari SM, Corrado A, Di Domenicantonio A, Fallahi P. Autoimmune thyroid disorders.Autoimmun Rev.2015 Feb;14(2):174-180.
21. Brandão Neto RA, de Carvalho JF.Diagnosis and classification of Addison´s disease (autoimmuneadrenalitis).Autoimmun Rev.2014 Apr-May;13(4-5):408-11.

