INTRODUÇÃO
A síndrome hemofagocítica (SH), também conhecida por linfo-histiocitose hemofagocítica, é uma entidade clínica rara caracterizada por proliferação de histiócitos com importante atividade hemofagocitária1. A sua etiologia pode ser de dois tipos: primária (geneticamente determinada) ou secundária (reativa). Esta última está fortemente associada a infeções virais, bacterianas, fúngicas ou parasitárias e neoplasias1,2. Os critérios de diagnóstico propostos pela Sociedade de Histiocitose em 1991 e revistos em 2004 incluem a presença de febre, pancitopenia, hiperferritinemia, aumento da lactato desidrogenase e hemofagocitose no medulograma3,4.
O tratamento da SH deve ser individualizado, estando recomendado na literatura tratamento de suporte e tratamento dirigido à causa subjacente1. A terapêutica com imunomodeladores e imunossupressores, nomeadamente corticoterapia, independentemente da causa associada, pode ser utilizada para controlar a resposta inflamatória1. Caso haja agravamento clínico e, na ausência de infeção subjacente identificável, pode ser considerada quimioterapia com base na avaliação clínico-laboratorial e com a urgência da situação; e, nos casos graves e refratários às outras terapêuticas, o transplante de medula óssea 1-2,5. Contudo, apesar do tratamento apresenta um prognóstico clínico reservado, mas variável de acordo com a etiologia, estando descrita uma taxa de mortalidade associada à SH secundária que ronda 40%1,5-7.
A SH secundária a Leishmania spp está descrita em alguns casos na literatura1. A Leishmaniose visceral (LV), ou Kala-azar, é uma antropozoonose grave e endémica em Portugal. É causada por um protozoário flagelado do género Leishmania, constituindo a Leishmania donovani a espécie mais prevalente, com o foco mais ativo a nível da bacia Mediterrânea7,8. A Leishmaniose é pouco sintomática na população geral, no entanto é causa importante de síndrome febril prolongada em determinados grupos de doentes, nomeadamente naqueles com imunodeficiência celular9,10 . Afeta fundamentalmente o sistema mononuclear fagocítico da medula óssea, fígado e baço. Contudo, o estado imunitário do doente com LV pode influenciar a progressão clínica e a presença de localizações atípicas da doença, por exemplo a nível do trato digestivo, respiratório e muco-cutâneo. O diagnóstico assenta na identificação do protozoário a nível tecidual ou na positividade da serologia. Pode ter uma evolução fatal se não for diagnosticada e tratada de forma atempada7,9-10.
A colite ulcerosa é uma doença inflamatória crónica e recidivante do cólon de etiologia desconhecida. A escolha do tratamento farmacológico assenta na atividade clínica e endoscópica, sendo avaliada segundo a Classificação de Montreal com base na extensão (E) e severidade (S) da doença11,12. Os agentes biológicos têm sido utilizados com eficácia comprovada no controlo da atividade da doença. O infliximab, inibidor do fator de necrose tumoral alfa (TNF-alfa), é em geral bem tolerado porém, existem alguns estudos que mostraram uma associação com reações adversas graves, nomeadamente reações cutâneas, infeções, reativação de tuberculose, neoplasias e fenómenos auto-imunes (onde se inclui a síndrome hemofagocítica)11-13.
CASO CLÍNICO
Doente do sexo masculino de 61 anos, natural e residente no concelho de Alijó, ex-trabalhador numa panificadora e fumador (40 UMA). Em 2008 foi-lhe diagnosticada colite ulcerosa (proctite). Mantinha-se sob seguimento regular pela Gastrenterologia e medicado com azatioprina, messalazina e prednisolona até setembro de 2012. Nessa altura, por colite grave refratária à terapêutica convencional, foi adicionado infliximab 5 mg/kg a cada 8 semanas e, em julho de 2013, ajustada a dose para 10 mg/kg a cada 6 semanas.
Em agosto de 2013 o doente recorreu ao serviço de urgência por um quadro clínico, com cerca de um mês de evolução, caracterizado por febre elevada (Taxilar> 39ºC) de predomínio vespertino associada a calafrios e sintomas constitucionais (anorexia, astenia e perda ponderal de 5 kg). Negava outros sintomas, nomeadamente do foro cardiorrespiratório, gastrointestinal ou urinário. Do ponto de vista epidemiológico, o doente referia contacto frequente com animais (cão e gato) e negava viagens recentes, ingestão de água não canalizada e de leite ou derivados não pasteurizados. Sem comportamentos sexuais de risco ou história de transfusões. Foi internado no Serviço de Medicina Interna para investigação etiológica da síndrome febril, tendo sido suspenso o tratamento com infliximab e iniciada antibioterapia empírica com ceftriaxone e metronidazol.
Ao exame físico o doente encontrava-se consciente e orientado e com exame neurológico sumário normal. Apresentava palidez cutâneo-mucosa, sem exantema cutâneo ou adenopatias palpáveis. Estava febril, normotenso e normocárdico. A auscultação cardiopulmonar não revelou alterações. À palpação abdominal sem hepatoesplenomegalia.
Nas análises efetuadas salientava-se pancitopenia (hemoglobina 11.1 g/dl, leucócitos 2.400 células/µ, plaquetas 130.000 células/µL), transaminases normais, lactato desidrogenase 391 U/L (VR:135-255 U/L), albumina 2.7 mg/dL (VR:3.4-4.8 mg/dL) e proteína C reativa 5.2 mg/dL (VR: <0.5 mg/dL); ferro 21 ng/mL (VR: 59-158 ng/mL), ferritina 2162 ng/mL (VR: 30-400 ng/mL); colesterol total 115 mg/dL (VR: <200 mg/dL), triglicerídeos 211 mg/dL (VR: <150 mg/dL); e imunoeletroforese sérica com hipergamaglobulinemia.
O estudo serológico alargado, quer para vírus (vírus da imunodeficiência humana 1 e 2, vírus das hepatites A, B e C, citomegalovírus, vírus epstein-barr, herpes simplex 1 e 2, herpes 8, parvovírus B19, varicela-zoster, influenzae, adenovírus, enterovírus e echovírus), quer para bactérias (Brucella, Coxiella burnetii, Treponema pallidum, Mycoplasma e Chlamydia) e ainda protozoário (Toxoplasma gondii) foi negativo. De realçar, no entanto, positividade no sangue do DNA do vírus herpes simplex tipo 1 (VHS-1) e citomegalovírus (CMV) por técnica de PCR. A imunofenotipagem de sangue periférico não evidenciou quaisquer anomalias na linhagem linfóide T ou B e o estudo autoimune foi negativo.
Sedimento urinário normal e telerradiografia de tórax sem alterações. Hemoculturas, uroculturas, exame microbiológico de expetoração, incluindo a pesquisa de micobactérias, foram repetidamente negativas. O medulograma revelou numerosos macrófagos com fagocitose de plaquetas, eritrócitos e neutrófilos sugestivos de hemofagocitose (figura 1), tendo sido a pesquisa de Leishmania na medula negativa. Os mesmos achados foram obtidos na biópsia óssea e a pesquisa de micobactérias na mielocultura negativa. A tomografia computorizada toraco-abdomino-pélvica mostrou esplenomegalia homogénea (16 cm) e adenopatias na gordura peri-retal e na transição reto-sigmóideia. O ecocardiograma transtorácico, apesar da má janela ecográfica, não evidenciou vegetação. A retosigmoidoscopia mostrou raras erosões a nível do reto e colon sigmoide, compatível com atividade controlada da colite ulcerosa (estadio E1 S0).
Em termos clínicos assistiu-se à persistência de febre elevada e laboratorialmente houve agravamento das citopenias, com elevação das enzimas de citólise e colestase hepáticas e da proteína C reativa (Quadro I – 08/08/13). A evolução analítica encontra-se registada no Quadro I.
Nesta altura, estava-se perante um doente com manifestações clínicas de febre elevada, perda de peso e esplenomegalia, os achados laboratoriais de pancitopenia, disfunção hepática (hipoalbuminemia, hipertrigliceridemia, hiperferritinemia) e a demonstração de hemofagocitose na medula óssea, pelo que se confirmou o diagnóstico de síndrome hemofagocítica. Assim, a investigação complementar efetuada, e após exclusão de outras causas, permitiu apoiar a hipótese etiológica de hemofagocitose secundária a reativação de infeção pelo VHS-1 e CMV. Foi iniciada terapêutica com corticoterapia sistémica (prednisolona, 1 mg/kg/dia) e antivíricos, aciclovir (500 mg de 8/8 horas) e valganciclovir (900 mg de 12/12 horas), que cumpriu durante, respetivamente, 14 e 21 dias. A evolução clínica do doente foi favorável a permitir a alta clínica sob corticoterapia em desmame (Quadro I – 02/09/13).
Em finais de setembro de 2013 o doente foi avaliado em consulta externa e novamente internado por síndrome febril. A reavaliação analítica mostrou alterações sobreponíveis (Quadro I - 25/09/13). Manteve-se sempre o doente sob corticoterapia sistémica. O medulograma confirmou hemofagocitose, com pesquisa de Leishmania negativa e não demonstrou sinais de doença hematológica. Estudo microbiológico negativo. A pesquisa da antigenemia para o CMV no sangue foi negativa, bem como a PCR-CMV e PCR-VHS-1. Foi alargada a investigação complementar com tomografia de positrões de corpo inteiro (18-F-FDG) que mostrou a presença de lesões hipermetabólicas (fígado, baço, medula óssea e reto); biópsia hepática transjugular, cujo exame histológico foi sugestivo de hepatite aguda inespecífica e retosigmoidoscopia com biópsia cega. Repetiu-se ecocardiograma transtorácico que evidenciou pequenas estruturas filamentosas apensas à cúspide não coronariana da válvula aórtica.
Dada a ausência de outra etiologia para a hemofagocitose foi assumida possível endocardite (segundo os critérios de Duke) e introduzida antibioterapia empírica com vancomicina e gentamicina durante 4 semanas, com resposta clínica lenta e demorada (Quadro I – 11/11/13). Em novembro de 2013, o doente teve alta, assintomático.
Foi reinternado um mês depois por recidiva da febre. Os resultados laboratoriais eram idênticos aos dos internamentos prévios (Quadro I – 04/12/13). Assim, dada a ausência de diagnóstico etiológico definitivo foi considerada a hipótese de instituir quimioterapia. Repetiu biópsia óssea com medulograma, tendo sido observados neste e, em exame histológico de biópsia do cólon, a presença de corpos de Leishmania donovani (figura 2). Este novo dado permitiu estabelecer o diagnóstico de leishmaniose visceral, tendo sido iniciada terapêutica com anfotericina B lipossómica (3 mg/kg/dose em 7 doses). Verificou-se resposta clínico-laboratorial completa, sem relato de complicações ou reações adversas à terapêutica. Aos nove meses de follow-up o doente mantém-se assintomático.
DISCUSSÃO
O caso clínico apresentado de febre prolongada, sintomas constitucionais, citopenias e hiperplasia do sistema reticulo-endotelial em doente imunodeprimido colocava como prioridade excluir causa infeciosa ou doença linfoproliferativa. A clarificação diagnóstica só pôde ser estabelecida com a evolução clínica do doente ao longo do tempo.
A região do Alto Douro, nomeadamente o concelho de Alijó, residência habitual do doente, era considerada a localidade do país com maior número de casos de infeção humana por Leishmania, em que o cão é o seu principal reservatório e hospedeiro8. Do ponto de vista geográfico, esta caraterística epidemiológica era particularmente relevante.
Deste modo, considerando a história epidemiológica, a presença das manifestações clínicas clássicas (febre prolongada, síndrome constitucional e esplenomegalia) e as alterações laboratoriais típicas (pancitopenia e hipoalbuminemia)7,10, a hipótese diagnóstica de infeção por Leishmania embora tenha sido sempre considerada não foi inicialmente apoiada pela investigação efetuada.
Um fator que contribuiu para o atraso no diagnóstico foi a forma de apresentação clínica da LV7,9,10. Isto é, a alternância de febre durante várias semanas com curtos períodos de apirexia, parece ter-se devido não à administração de terapêutica dirigida (antivírico e antibioterapia) mas sim a uma melhoria clínica espontânea. A corticoterapia sistémica teve um papel importante no controlo parcial da hemofagocitose. Parece lógico afirmar-se que a hemofagocitose sempre foi secundária à infeção por Leishmania e que as hipóteses diagnósticas colocadas ao longo do tempo não se confirmaram.
O diagnóstico definitivo foi conseguido apenas após repetição consecutiva do medulograma. De forma surpreendente tendo em conta a sua elevada especificidade no isolamento deste protozoário7, este fracassou persistentemente na sua identificação, provavelmente devido ao número reduzido de amastigotas em circulação em fase precoce da doença. Um outro aspeto a realçar residiu no facto da Leishmania donovani também ter sido identificada no tubo digestivo do doente, localização atípica deste10. A biópsia cólica foi executada numa fase menos precoce da investigação dado não haver evidência de atividade da proctite ulcerosa.
Têm sido descritos casos raros na literatura em que a leishmaniose visceral é apontada como complicação dos agentes biológicos14. O caso clínico aqui descrito alerta para o fato da utilização destes fármacos na colite ulcerosa condicionar um risco não desprezível de desenvolvimento de infeções oportunistas graves. É importante manter um elevado índice de suspeição clínica, sobretudo em determinados contextos, que permita um diagnóstico correto desta entidade clínica.
CONCLUSÃO
Os autores ressalvam a particularidade deste caso, que residiu não só no facto da Leishmaniose visceral ser uma doença rara e se ter manifestado sob a forma de hemofagocitose em doente sob terapêutica biológica, assim como no curso prolongado e cíclico das manifestações clínicas e no atraso do diagnóstico por medulograma.
Agradecimentos
O nosso agradecimento à Dr.ª Ana Paula Castro e ao Dr. Fortunato Vieira, respetivamente, do Laboratório de Anatomia Patológica do Centro Hospitalar de Trás-os-Montes e Alto Douro em Vila Real e do Histocit no Porto, pela cedência das imagens.
Quadro I
Evolução analítica ao longo do internamento
| Parâmetro | Valores de referência | 08/08/13 | 02/09/13 | 25/09/13 | 11/11/13 | 04/12/13 |
| Hemoglobina | 13-18.0 g/dL | 9.7 | 10.0 | 9.2 | 11.0 | 9.23 |
| Leucócitos | 4-11.000 células/µL | 1.100 | 3.100 | 2.700 | 3.100 | 2.300 |
| Plaquetas | 150-400.000 células/µL | 74 | 308 | 157 | 228 | 130000 |
| Creatinina | 0.7-1.4 mg/dL | 0.7 | 0.7 | 0.9 | 1.4 | 1.5 |
| AST/ALT | < 40 U/L | 156/107 | 25/78 | 109/150 | 18/45 | 54/48 |
| FA | 40-130 U/L | 632 | 276 | 150 | 102 | 179 |
| GGT | 10-49 U/L | 1061 | 323 | 809 | 139 | 151 |
| LDH | 135-225 U/L | 1532 | 258 | 1496 | 212 | 325 |
| PCR | < 0.5 mg/dL | 23.0 | 0.6 | 13.6 | 1.6 | 11.6 |
| Proteínas totais | 6.6-8.7g/dL | 6.9 | 6.3 | 5.8 | 5.7 | 5.6 |
| Albumina | 3.4-4.8 g/dL | 2.9 | 2.1 | 2.7 | 3.2 | 3.2 |
| Ferritina | 15-150 ng/mL | 11898 | 1803 | 44404 | 960 | 3643 |
AST: Aspartato aminotransferase. ALT: Alanina aminotransferase. GGT: Gamaglutamiltransferase. FA: Fosfatase alcalina. LDH: Lactato desidrogenase. PCR: Proteína C reativa.
Figura I
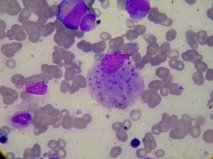
Medulograma: macrófago a fagocitar plaqueta (ampliação normal x1000).
Figura II
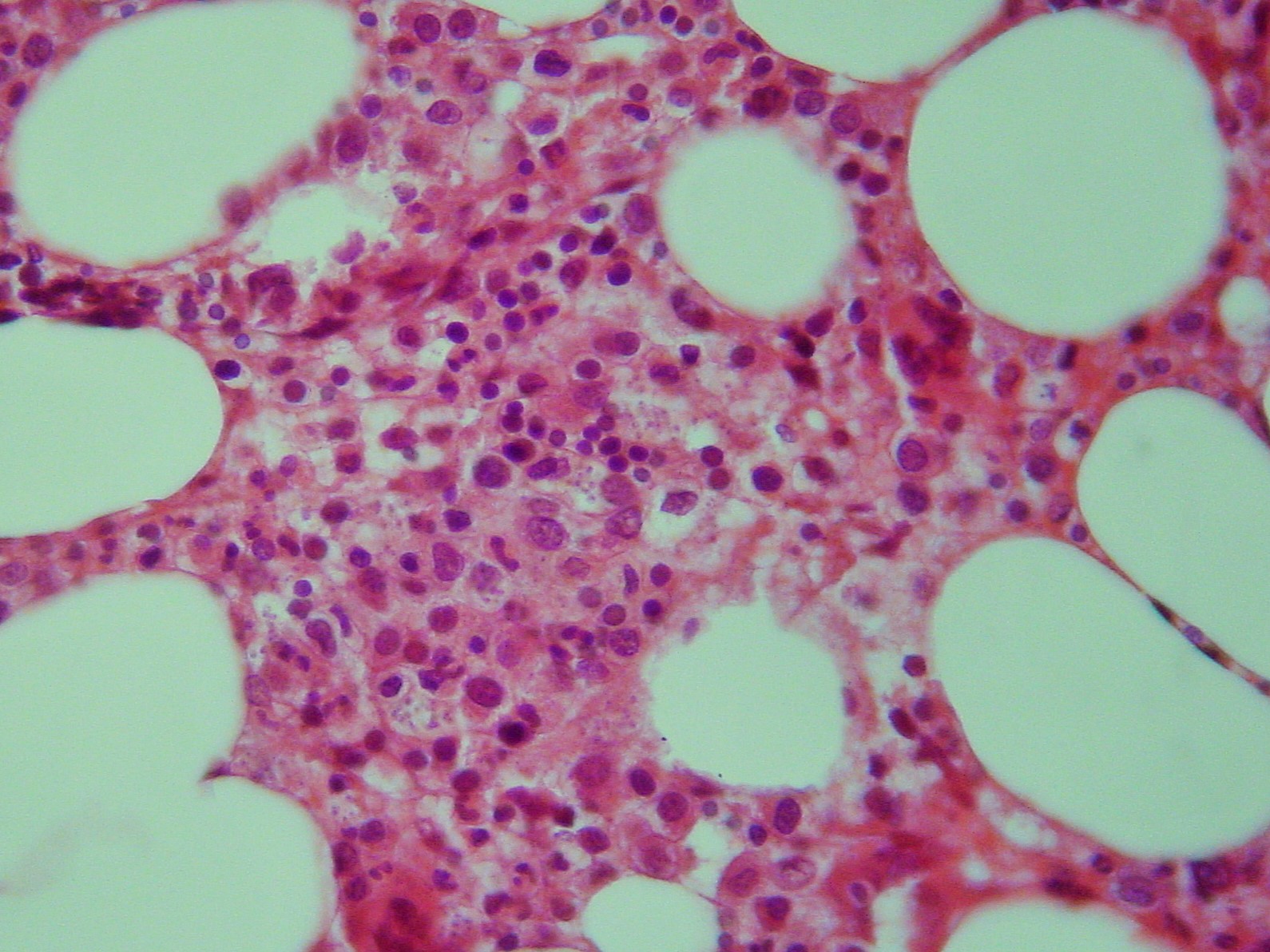
a) Biópsia óssea
Figura II
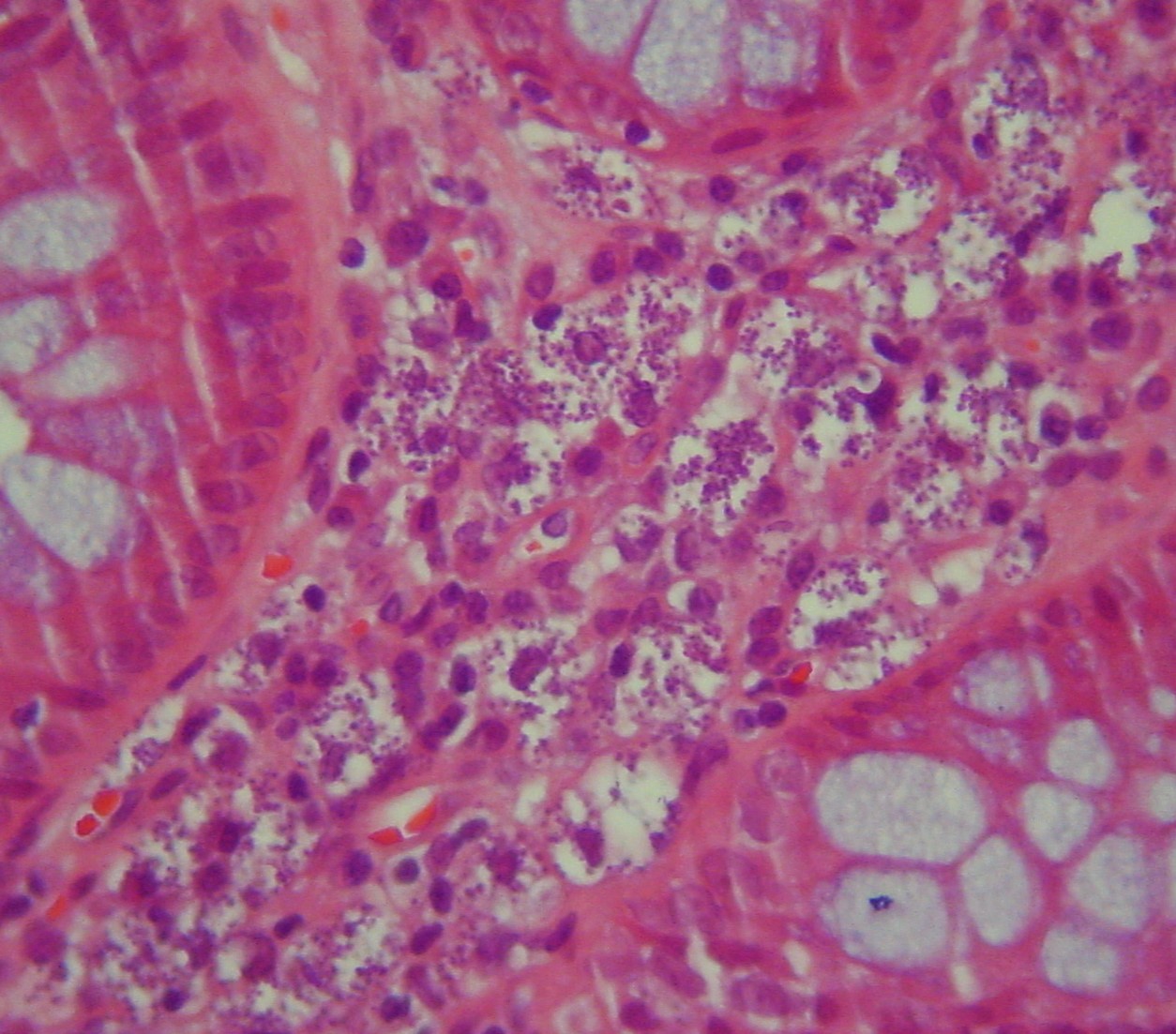
b) Biópsia retal: presença de numerosos histiócitos em cujo citoplasma se identificam formas amastigotas de Leishmania (coloração hematoxilina-eosina, ampliação original X 400).
BIBLIOGRAFIA
1 - RC, M et al. Adult Haemophagocytic syndrome. The Lancet 2013; 383: 1503-1516.
2 - Janka E. Hemophagocytic syndromes – An update. Blood Reviews 2014; 28: 135-142.
3 - Henter JI, Elinder G, Ost A. Diagnostic guidelines for hemophagocytic lymphohistiocytosis. The FHL Study Group of the Histiocyte Society. Semin Oncol 1991; 18: 29-33.
4 - Henter JL, Horne A, Arico M. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatric Blood Cancer, 2007; 48: 124-131.
5 – Rosado F et al. Hemophagocytic Lymphohistiocytosis. An Update on Diagnosis and Pathogenesis. Am J Clin Pathol 2013; 139: 713-727.
6 - Janka GE. Familial and acquired hemophagocytic lymphohistiocytosis. Annu Rev Med 2012; 63: 233-246.
7– Magill, Alan J. Leishmania Species: Visceral (Kala-azar), Cutaneous and Mucosal Leishmaniasis. In Mandell, Douglas and Bennett´s Principles of Infectious Diseases, 8th edition. Churchill Livingstone 2015; 277: 3091-3107(disponível online).
8 - Campino L, Maia C. Epidemiologia das Leishmanioses em Portugal. Acta Med Port 2010;23:59-864.
9 - Van Griensven J, Carrillo E, López-Vélez R, Lynen L, Moreno J. Leishmaniasis in immunosupressed individuals. Clin Microbiol Infect 2014; 20 (4): 286-299.
10 - Farrar J et al. Leishmaniasis. In Manson´s Tropical Diseases, 23th edition. Elsevier 2014; 47: 631-651.
11 - Norma da Direção Geral de Saúde: Terapêutica biológica da doença inflamatória do intestino do adulto. Número 068/2011 de 30/12/2011, pág. 1-21.
12 – Lopes H, Curado A. Terapêutica Farmacológica da Colite Ulcerosa. J Port Gastrenterol 2009; 16: 140-141.
13- Magro F, Portela F. Management of inflammatory bowel disease with infliximab and other anti-tumor necrosis factor alpha therapies. BioDrugs 2010; 24 (Suppl 1): 3-14.
14 - Sousa N, Câmara IA, Pego PM, Andrade JP, Costa JM. Leishmaniose visceral em doentes sob terapêutica com etanercept: Caso Clínico. Rev Port Med Int 2013; 21(2): 69-73.

