Introdução
Neoplasias primitivas múltiplas (NPM) incluem a ocorrência, no mesmo indivíduo, de duas ou mais neoplasias malignas, envolvendo o mesmo órgão ou órgãos diferentes. (1) Trata-se de neoplasias síncronas, se a tradução clínica se manifesta num período de tempo inferior a 6 meses, e metacrónicas, quando esse intervalo é superior. Este tema foi pela primeira vez abordado por Bilroth, sobretudo na perspectiva epidemiológica e etiopatogénica, mas que se constata actualmente ter uma incidência crescente. Um estudo de 2010 por Özsoy et al, mostrou, por exemplo, que a TC abdominopélvica como parte do estadiamento prévio ao tratamento curativo do carcinoma da próstata detecta carcinomas de células renais síncronos assintomáticos com uma incidência significativamente maior comparada com a esperada na população geral (4). Trata-se, portanto, de uma situação que se reveste de importância clínica, dado o desafio em termos diagnósticos e terapêuticos que envolve.
A entidade caracterizada por hamartomas biliares múltiplos foi descrita pela primeira vez por von Meyenburg em 1918 e, por esta razão, é também conhecida por Complexo de von Meyenburg (5). Apesar de clinicamente silenciosa na maioria das vezes, a prevalência ascende a 5.6% em grandes séries de autópsias, tratando-se maioritariamente, na prática clínica corrente, de um achado incidental. No entanto, trata-se de uma entidade que pode confundir-se facilmente com uma grande variedade de lesões hepáticas multifocais, como a doença de Caroli, quistos ou metástases, aquando da presença de neoplasia maligna concomitante (6).
As neoplasias renais podem ocorrer como complicação da doença renal poliquística (DRP), autossómica dominante (DRPAD) ou autossómica recessiva (DRPAR), como da doença renal poliquística adquirida e estadio final de doença renal, apesar de esses serem fatores de risco menores, responsáveis por uma parcela pequena dos carcinomas de células renais (CCR). Comparado com o CCR esporádico, o associado à DRPAD ocorre mais precocemente, apresenta-se com mais frequência bilateralmente e é multicêntrico. Uma lesão precursora potencial, como proliferação intra-quística do tufo papilar, é identificada em 25% dos casos, apesar de não ter valor citológico prognóstico (7,8).
Caso clínico
Os autores apresentam o caso de um homem de 72 anos, caucasiano, internado para esclarecimento de quadro com febre intermitente com 3 meses de evolução, que cedia aos antipiréticos (paracetamol, ibuprofeno), perda ponderal (cerca de 7 Kgs em 3 meses), astenia e adinamia. Negava anorexia, dispneia, tosse, expectoração, queixas génito-urinárias ou gastro-intestinais. Tratava-se de um doente com antecedentes pessoais de diabetes mellitus tipo 2 não insulinotratada, hipertensão arterial essencial, polisserosite (aos 17 anos), cirurgia oftalmológica por descolamento da retina direita (aos 52 anos) e por cataratas e miopia (aos 62 anos), uvulo-palato-faringoplastia com amigdalectomia por síndrome de apneia-hipopneia obstrutiva (aos 60 anos), pneumonia hipoxemiante (aos 66 anos). Ex-fumador pesado (35 UMA, cessação há 15 anos). Medicado habitualmente com metformina 500 mg 3 id, perindopril 5 mg 1 id, nifedipina 60 mg 1 id, latanoprost gotas oftálmicas, timolol gotas oftálmicas e estazolam 2 mg 1 id. Negou hábitos alcoólicos, contacto com animais e viagens ao estrangeiro. Os antecedentes familiares eram irrelevantes. Da observação destacava-se temperatura corporal subfebril e palidez muco-cutânea. Da avaliação complementar inicial, destacava-se anemia microcítica hipocrómica (Hb 10.9 g/dL, VGM 78,4 fL e HGM 25,1 pg) ferropénica (Fe sérico 42 µg/dLe ferritina 13,9 ng/mL) e velocidade de sedimentação (VS) discretamente elevada (34 mm); o estudo microbiológico e imuno-serológico foi negativo, bem como o sedimento urinário. O ecocardiograma não tinha alterações de relevo. Realizou endoscopia digestiva alta (EDA) que mostrou gastrite erosiva e hérnia do hiato sem significado patológico; e colonoscopia que mostrou formação ulcerada, compatível com neoplasia do cólon, aos 25 cm da margem anal, cuja biópsia revelou um adenocarcinoma moderadamente diferenciado e infiltrativo. Realizou TC tóraco-abdómino-pélvica que mostrou, “no terço superior do rim direito, imagem com atenuação hídrica e ligeiramente superior, captante, compatível com possível neoplasia; em ambos os rins, múltiplas imagens com atenuação idêntica, não captantes, traduzindo possíveis quistos simples e complexos; fígado com dimensões e valores de atenuação normais e contorno regular; nos segmentos IV e VIII, documentam-se duas imagens em possível relação com quistos biliares; no segmento IV, observa-se ainda imagem com atenuação superior à hídrica, captante, compatível com possível hemangioma, embora não se possa excluir a hipótese de metástase”. Realizou RMN abdominal para caracterização das lesões hepáticas e renais, que mostrou, “no rim direito, formação nodular com 2,5 cm, cuja avaliação ecográfica complementar revelou nódulo com características ecoestruturais heterogéneas, sem áreas líquidas individualizáveis, suspeito de lesão proliferativa celular renal (Figs.1 e 2); para além de vários quistos renais de pequenas dimensões, de morfologia simples, bilaterais (Figs. 3 e 4); da avaliação hepática, formações quísticas simples, com distribuição difusa em ambos os lobos e, no segmento IV, pequeno nódulo de difícil individualização em T1, com moderado hipersinal T2, com 7 mm de diâmetro e que não exibe realce após contraste ev, sugerindo quisto de elevado conteúdo proteico, não se conseguindo concluir definitivamente sobre a etiologia do nódulo referenciado no estudo TC”.
Optou-se por cirurgia digestiva e urológica no mesmo tempo operatório, tendo sido submetido a mapeamento das lesões hepáticas por ecografia intra-operatória e excisão de 2 lesões, nefrectomia parcial direita e sigmoidectomia. O exame histológico extemporâneo das lesões hepáticas mostrou hamartomas dos ductos biliares, confirmado posteriormente (Fig.5). O exame histológico dos fragmentos de cólon mostrou um adenocarcinoma moderadamente diferenciado pT3pN0; e do fragmento renal mostrou um carcinoma de áreas renais, papilar tipo 1, grau nuclear 2 de Furhman, pT1a (excisão justalesional).
Foi realizado estudo genético, com pesquisa de mutações dos genes da doença poliquística (PKD1 e 2) e das síndromes com carcinoma do cólon não polipose (MSH2/MLH1, MLH6 ou PMS2). Não foi apurada nenhuma mutação associada a estes genes.
Discussão
O caso descrito reveste-se de grande interesse, porque reúne vários aspectos de pertinência clínica. Trata-se de um caso de NPM. Apesar de não possuirmos actualmente dados seguros quanto à incidência destes casos, diferentes séries mostraram valores que oscilam entre 1.7% e 7.4%. Há, no entanto, consenso sobre a incidência crescente deste tipo de neoplasias, que não se prende apenas com a melhoria dos métodos de diagnóstico, já que foi comprovado em séries de necrópsias (1,2,3).
Um importante aspecto do caso apresentado é a existência das lesões hepáticas concomitantes, que dado o contexto de neoplasia maligna confirmada histologicamente (adenocarcinoma do cólon, em biópsia por colonoscopia) e de neoplasia renal com aspectos radiológicos muito sugestivos de malignidade, colocou-se a hipótese de metastização hepática no topo da lista. Os hamartomas dos ductos biliares, ou complexos de von Meyenburg, todavia, são lesões benignas, frequentemente confundidas com metástases pela sua apresentação radiológica. No entanto, a sua prevalência parece ser mais elevada do que parece, porque geralmente é uma entidade subclínica. A questão que permanece por esclarecer é a sua implicação como possível lesão pré-maligna, associada sobretudo à génese de neoplasias das vias biliares, como o colangiocarcinoma (9). Estas lesões podem associar-se à DRP, que, também ela, acarreta risco aumentado de carcinogénese, sobretudo carcinoma de células renais.
Outro aspecto de particular interesse no caso descrito é a associação entre neoplasia maligna e DRP. Trata-se, como já referido, de neoplasias síncronas, de mais do que um sistema de órgãos, mais frequentemente associada a um terreno de risco, devido a predisposição genética. A associação entre CCR e DRP, tanto autossómica dominante como recessiva, é já conhecida, associada a malignização do epitélio de revestimento dos quistos renais. Por esta razão, pareceu pertinente fazer a pesquisa de mutações de genes associados não só à poliquistose, PKD1 e PKD2, mas também a carcinoma do cólon hereditário não polipose, MSH2/MLH1, MLH6 ou PMS2.
O caso tem aspectos de grande interesse clínico: inclui-se no número crescente de casos de neoplasias síncronas com a complexidade que estas envolvem em termos de abordagem diagnóstica e terapêutica; ilustra uma entidade clínica rara, complexos de von Meyenburg, que apesar de benigna, é desafiante por exigir um rigoroso diagnóstico diferencial com a metastização hepática; ilustra igualmente a complexidade da DRP, no tocante ao risco que confere de carcinogénese e à sua associação com o complexo de von Meyenburg.
Figura I
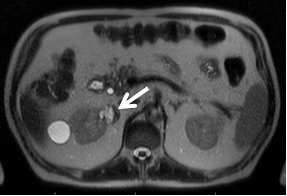
No bordo interno do 1/3 superior do rim direito, formação nodular com 2,5 cm de diâmetro, com hipersinal heterogéneo, sem áreas líquidas individualizáveis, sugestiva de lesão proliferativa celular renal (ponderação T1).
Figura II
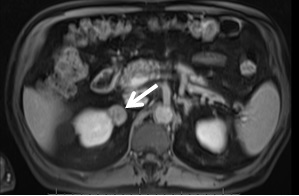
No bordo interno do 1/3 superior do rim direito, formação nodular com 2,5 cm de diâmetro, com hipersinal heterogéneo, sem áreas líquidas individualizáveis, sugestiva de lesão proliferativa celular renal (ponderação T2).
Figura III
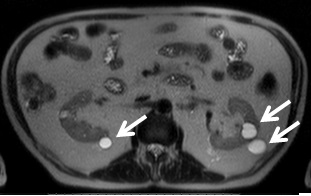
Vários quistos de pequenas dimensões, de morfologia simples, bilaterais (ponderação T1).
Figura IV
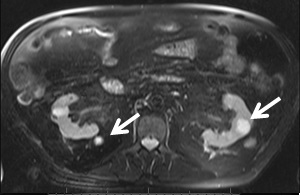
Vários quistos de pequenas dimensões, de morfologia simples, bilaterais (ponderação T2).
Figura V
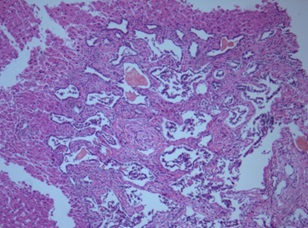
Tecido hepático com hamartomas dos ductos biliares (complexos de von Meyenburg)
BIBLIOGRAFIA
1) Amaro M, Manassas N, Santos H, Barata J, Ferreira M, Carvalho A. Neoplasias múltiplas síncronas – Um caso clínico de apresentação pouco comum, Medicina Interna 1995; Vol2, N. 3:159-164
2) Giron CG, Redondo E. Neoplasias multiplas, estudio de 36 casos de serie autópsica (1966-1985), Rev Clin Esp 1988; 182(3):137-142
3) Watanabe S, Kodama T et al, Multiple primary cancers in 5456 autopsy cases in the National Cancer Center of Japan, JNCI 1984; 72:1021-1027
4) Özsoy O, Fioretta G, Ares C, Miralbell R. Incidental detection of synchronous primary tumours during staging workup for prostate cancer, Swiss Med Wkly 2010;140(15-16):233-236
5) Lotte G. van Vlerkena, Maarten S. van Leeuwenb, Marguerite E.I. Schipperc, Karel J. van Erpecuma. The ‘‘Von Meyenburg complex’’: an unusual cause of cholangitis?, Clinics and Research in Hepatology and Gastroenterology 2011; 35: 762-764
6) Lorenzon L, Ziparo V; Von Meyenburg Complexes Mimicking Liver Metastases, Hepatology 2011; 54, No. 2: 734-735
7) Bonsib S. Renal Cystic Diseases and Renal Neoplasms: A Mini-Review, Clin J Am Soc Nephrol 2009; 4: 1998-2007
8) Bernstein J, Evan AP, Gardner KD Jr. Epithelial hyperplasia in human polycystic kidney diseases. Its role in patho-genesis and risk of neoplasia, Am J Pathol 1987; 129: 92–101
9) O´Dell M, Huang J, Whitney-Miller C, et al. Kras(G12D) and p53 Mutation Cause Primary Intrahepatic Cholangiocarcinoma, Cancer Res 2012; 72: 1557-1567






