Introdução
A Doença de Lyme (DL) é uma zoonose provocada por espiroquetas do complexo Borrelia burgdorferi sensu lato[1,2), sendo a doença causada por vetores mais frequentemente reportada na Europa e América do Norte.3 A transmissão ao Homem é resultando da picada por carraças sobretudo do género Ixodes, o seu principal vetor. É uma doença multissistémica complexa, reativa, infeciosa e crónica, suscetível de apresentar três fases no decurso da sua evolução, as quais se traduzem por manifestações clínicas na pele (sob a forma de eritema migratório, linfocitoma borreliano e acrodermatite crónica atrófica), no coração (cardite de Lyme), no sistema nervoso central (neuroborreliose - NBL) e articulações (artrite de Lyme).(4,5)
As manifestações neurológicas são raras, aproximadamente 13% dos doentes, podendo ocorrer na ausência de sintomas clínicos prévios. Na Europa a NBL geralmente manifesta-se como síndrome de Bannwarth incluindo meningite linfocítica, neurite craniana, e radiculoneurite.(6,7) O AVC devido a vasculite cerebral é uma das complicações menos comuns da infeção por B. burgdorferi e raramente é mencionado em artigos médicos sobre NBL.(8,9)
O diagnóstico é essencialmente clínico associado a uma história de exposição com picada pelo vetor, porém, a informação fornecida pelo laboratório, baseada em testes serológicos e/ou moleculares, constitui um apoio fundamental permitindo um tratamento adequado e atempado destes doentes.10
Caso Clínico
Os autores descrevem o caso de uma doente do género feminino, com 38 anos, previamente saudável que recorreu ao Serviço de Urgência por quadro clínico, de início súbito, caraterizado por diplopia, náuseas, vómitos e desequilíbrio da marcha, com descoordenação motora dos membros inferiores. A doente era jardineira de profissão, residia em espaço urbano, sem contato com animais.
Na admissão encontrava-se apirética e hemodinamicamente estável, consciente e orientada no tempo e no espaço. Calma e colaborante, sem défices da linguagem ou disartria, com paresia facial periférica à direita, paresia da introversão do olho direito, sem oftalmoplegia internuclear valorizável. Dismetria dos membros direitos, em particular no membro inferior, com marcha atáxica, sem défices motores ou alterações da sensibilidade, sem rigidez da nuca e sem alterações no exame oftalmoscópico. Não apresentava outras alterações no exame objetivo, nomeadamente, alterações cutâneas ou osteoarticulares.
Analiticamente não apresentava alterações a nível de hemograma e bioquímica, com formula leucocitária normal, provas de função renal, hepática e tiroideia normais, e proteína C reativa, ácido fólico e vitamina B12 dentro do limite da normalidade. Realizou tomografia computorizada crânio-encefálica (TC-CE) que não evidenciou imagens de lesões isquémicas ou hemorrágicas recentes. Fez ressonância magnética crânio-encefálica que mostrou imagem hiperdensa com localização mesencefálica paramediana esquerda, compatível com lesão de natureza vascular isquémica em fase aguda.
Inserir Figura I e II.
Na colheita da história epidemiológica, a doente refere episódio de mordedura por carraça, em contexto profissional, para a qual não fez qualquer terapêutica, cerca de um mês antes do início da sintomatologia. Uma semana após esse evento surgiram lesões cutâneas no membro inferior direito, autolimitadas, com duração de um dia, compatíveis com eritema migratório (“aspeto de um alvo”, sic.), que a doente não valorizou. Negava episódios de febre, mialgias, artralgias ou cefaleias anteriores ao início dos sintomas.
Tratando-se de um AVC em doente jovem sem fatores de risco cardiovasculares, iniciou a marcha diagnóstica etiológica. O estudo de autoimunidade, trombofilias e função tiroideia não mostrou alterações. Fez estudo doppler dos vasos do pescoço, transcraniano e venoso dos membros inferiores que foram normais. Serologias para Vírus da Imunodeficiência Humana (VIH), sífilis e hepatites negativas. Foram pedidas serologias para Borrelia, com resultado positivo para IgM e negativo para IgG (por método Enzyme Linked Immuno Sorbent Assay - ELISA), com seroconversão confirmada duas semanas depois (por Western Blot). Realizou punção lombar cujo exame citoquímico do LCR revelou proteinorráquia (270 mg/dl), pleocitose linfocítica (271 mononucleares/mm3) e glicose normal. A pesquisa de anticorpos anti-Borrelia burgdorferi no LCR foi positiva, bem como a deteção de DNA borreliano pelo método “polimerase chain reactin”,PCR.
A terapêutica intravenosa com ceftriaxona 2g/dia foi feita durante 21 dias, assistindo-se a uma melhoria clínica. Ao fim do ciclo de antibioterapia foi submetida a nova punção lombar cujo exame citoquímico do LCR revelou normalização das células pleomórficas. Teve alta clínica assintomática, retomando a sua atividade profissional e pessoal dentro da normalidade.
Discussão
A NBL é uma doença aguda que surge poucas semanas após a picada pelo vetor,3 na presença ou na ausência do eritema migratório prévio. Em adultos manifesta-se como uma meningoradiculoneurite dolorosa e migratória (síndrome Garin-Bujadoux-Bannwarth) que desaparece espontaneamente, num período de seis meses, e por uma paralisia facial uni ou bilateral.3
Sabe-se que a NBL é uma causa muito rara de vasculite e AVC mas, dados epidemiológicos exatos não estão disponíveis porque poucos casos foram relatados até à data, sendo a maioria por autores europeus. Um estudo realizado por Hammers-Berggren et al., Incluindo 281 doentes com diagnóstico de AVC, verificou que 8% dos doentes foram positivos para infeção por B. burgdorferi, mas apenas um deles tinha sintomas de AVC devido a NBL.13 Oschmann et al. relatou 4 casos de AVC devido a NBL entre 330 doentes com diagnóstico de DL.14
Apesar de raros, os casos de AVC por NBL descritos na literatura sugerem que existe uma forma meningovascular de infeção por B. burgdorferi. A vasculite inflamatória é uma manifestação patológica conhecida da NBL e é resultado da infiltração linfocitica perivascular e vascular no interior do parênquima cerebral e nas artérias das leptomeninges induzida por infeção com B. burgdorferi.(15,16)
De acordo com as atuais diretrizes da Sociedade Europeia de Neurologia, para o estabelecimento diagnóstico definitivo de NBL, três condições devem ser cumpridas: sintomas neurológicos sugestivos de NBL sem outras causas aparentes, pleocitose no LCR e síntese intratecal de anticorpos anti-B. burgdorferi. Se estiverem presentes apenas dois critérios, o diagnóstico de NBL é possível.17 O caso reportado reunía as três condições pelo que foi feito corretamente o diagnóstico definitivo de NBL.
Por serem microrganismos microaerofílicos, com crescimento lento e necessidades nutricionais complexas, os métodos culturais são normalmente ineficazes, apesar de serem os métodos gold-standard de especificidade de diagnóstico.3
O pedido de PCR para B. burgdorferi realizado na abordagem deste caso é questionável, pois sabe-se que na DL europeia, a espiroquetémia é transitória e as espiroquetas são dificilmente isoladas das amostras, pelo que os métodos de biologia molecular não são tao úteis.3
A serologia deve ser o primeiro passo na abordagem diagnostica da DL, sendo as amostras facilmente obtidas e os testes atuais mais sensíveis e específicos.18 A pesquisa de anticorpos específicos (IgM ou IgG) anti-B. burgdorferi por exames serológicos, tais como ELISA e a imunofluorescência indireta (IFI), é útil em todas as manifestações clínicas exceto nos estadios iniciais de doença e no eritema migratório. No caso reportado, verificou-se seroconversão às duas semanas, porém esta pode estar ausente devido ao início precoce da antibioterapia. Importa referir que uma serologia positiva pode persistir por meses ou anos, apesar do tratamento eficaz da infeção. Como tal, o follow-up do título de anticorpos não é recomendável para a monitorização destes doentes.19
As recomendações europeias sugerem um teste de screning inicial (ELISA) seguido de Western-blot (teste mais sensível e específico) para amostras positivas ou equívocas. Em doentes com NBL, o exame do LCR é necessário para demonstrar a pleocitose linfocitica e alterações inflamatórios de lesão da barreira hemato-encefálica (BHE).17
No que concerne ao tratamento, este está indicado após o diagnóstico e deve ser o mais precoce possível, pois resulta na ausência de recorrência de enfartes, paragem na progressão da doença ou recuperação dos défices, tal como se verificou no caso descrito. De acordo com as últimas orientações da Sociedade Europeia de Neurologia, doentes adultos com NBL em estadio inicial, com manifestações do SNC (incluindo vasculite), devem ser tratados com ceftriaxona (2 g por dia), intravenosa (IV), durante 14 dias. Em adultos com NBL tardia, com manifestações do SNC, está preconizado o tratamento com ceftriaxona IV (2 g por dia) durante 3 semanas. No entanto, um estudo multicêntrico, duplamente cego e aleatorizado em nove hospitais da Noruega, demonstrou que a doxiciclina oral foi tão eficaz quanto a ceftriaxona IV, independentemente da gravidade dos sintomas, incluindo vasculite do SNC.20
Conclusão:
A Neuroborreliose de Lyme é uma causa rara de vasculite e acidente vascular cerebral porém, deve ser considerada no diagnóstico diferencial de AVC em doente jovem sem causa conhecida e sem fatores de risco cardiovasculares, mas com história de exposição ao vetores, especialmente em áreas endémicas.
A doença raramente é fatal mas pode adquirir elevada morbilidade e mortalidade se não for diagnosticada e tratada precocemente. Deve ser considerada uma doença emergente e ser questionada durante a abordagem de um doente com a sintomatologia acima descrita.
Por fim, a doença de Lyme é uma doença de declaração obrigatória, sendo a sua notificação deveras importante, para percebermos a verdadeira incidência no nosso país, que acreditamos estar subestimada.
Figura I
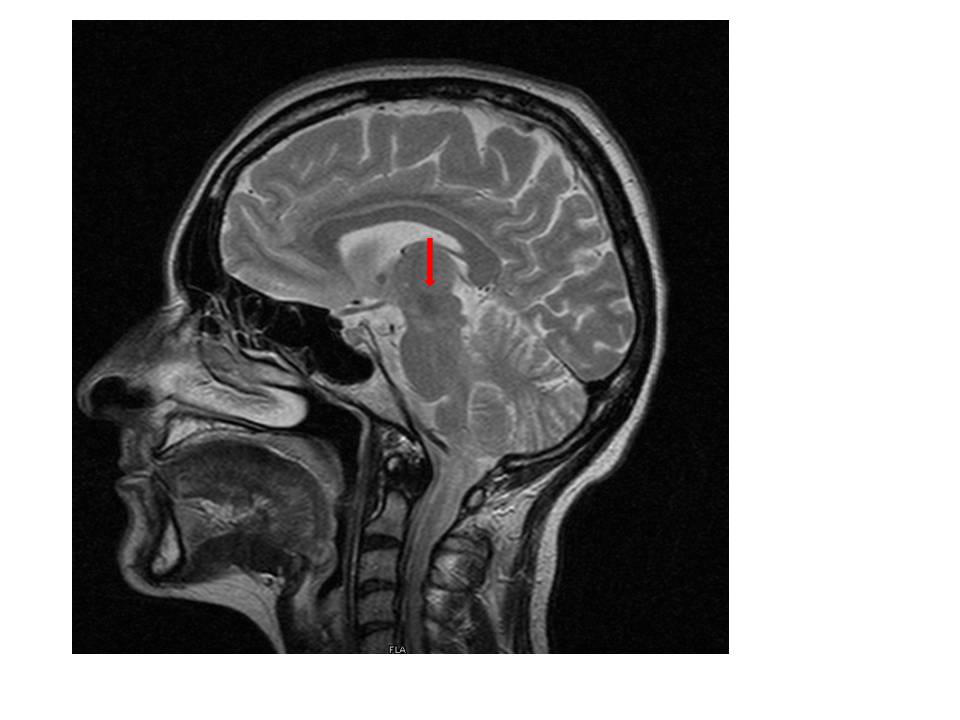
Imagem hiperdensa com localização mesencefálica paramediana esquerda, compatível com lesão de natureza vascular isquémica em fase aguda.
Figura II
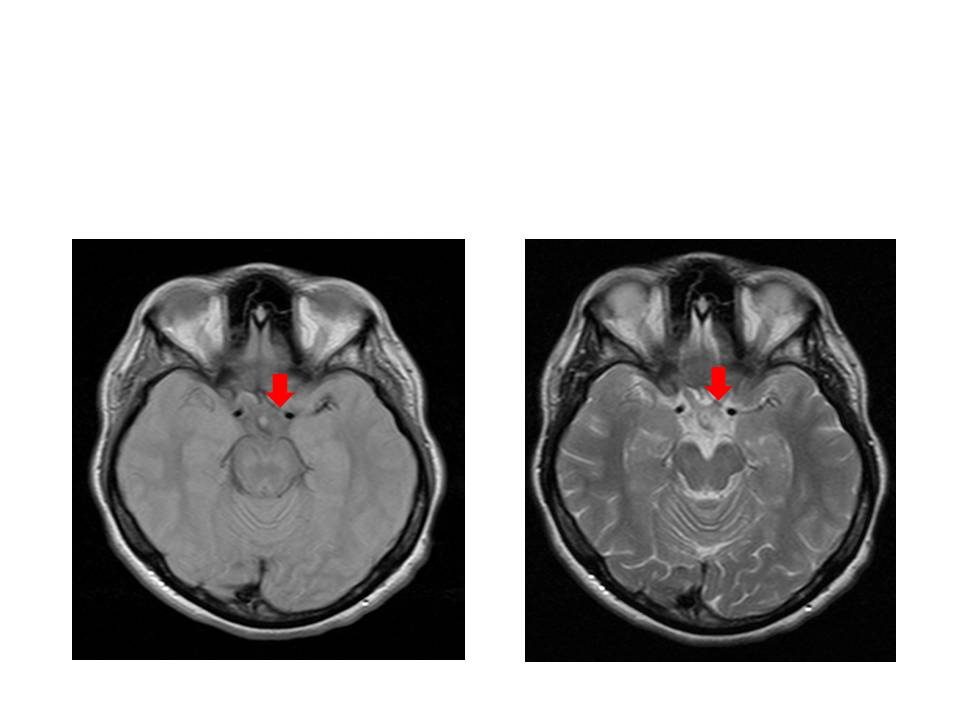
Imagem hiperdensa com localização mesencefálica paramediana esquerda, compatível com lesão de natureza vascular isquémica em fase aguda.
BIBLIOGRAFIA
1. Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E. Lyme disease - a tick-borne spirochetosis? Science. 1982; 216 (4552): 1317-9
2. Johnson RC, Schimd GP, Hyde FW, Steigerwalt AG, Brenner DJ. Borrelia burgdorferi spp.: etiologic agent of Lyme disease. Int J Syst Bacteriol. 1984; 34:496-7
3. Stanek GS, Cimmino M, Aberer E, Kristoferitsch W, Granstrom M, Guy E, et al. Lyme borreliosis: Clinical case definitions for diagnosis and management in Europe. Clin Microbiol Infect. 2011; 17: 69-79
4. Stanek G, O’connel S, Cimmino M, Aberer E, Kristoferitsch W, Granstro M, et al. European Union concerted action on risk assessment in Lyme borreliosis: clinical case definitions for Lyme borreliosis. Wien Klin Wochenschr. 1996; 108:741-7
5. Franca I. Borreliose de Lyme: uma introducao a doenca. Trabalhos da Sociedade Portuguesa de Dermatologia e Venereologia. 2005; 8 (Supl): 11-39
6. Scheid R, Hund-Georgiadis M, von Cramon DY. Intracerebral haemorrhage as a manifestation of Lyme neuroborreliosis? Eur J Neurol 2003;10:99–101.
7. Zajkowska J, Czupryna P, Kuśmierczyk J, Ciemerych A, Ciemerych M, Kondrusik M, et al. Clinical forms of neuroborreliosis – the analysis of patients diagnosed in department of infectious diseases and neuroinfection medical academy in Bialystok between 2000–2005. Przegl Epidemiol 2007;61:59–65.
8. Topakian R, Stieglbauer K, Nussbaumer K, Aichner FT. Cerebral vasculitis and stroke in Lyme neuroborreliosis. Two case reports and review of current knowledge. Cerebrovasc Dis 2008;26:455–61.
9. May EF, Jabbari B. Stroke in neuroborreliosis. Stroke 1990;21:1232–5.
10. Lopes de Carvalho I, Nuncio MS. Laboratory diagnosis of Lyme borreliosis at the Portuguese National Institute of Health (1990-2004). Euro Surveill. 2006;11: 257-60
11. Hildenbrand P, Craven D.E, Jones R, Nemeskal P. Lyme neuroborreliosis: manifestations of a rapidly emerging zoonosis. Am J Neuroradiol. 2009; 30:1079-7
12. Bratton R.L., Whiteside J.W., Hovan M.J., Engle R.L., and Edwards F.D. 2008. Diagnosis and treatment of Lyme disease. Mayo Clin Proc., 83:566–71.
13. Hammers-Berggren S, Gröndahl A, Karlsson M, von Arbin M, Carlsson A, Stiernstedt G. Screening for neuroborreliosis in patients with stroke. Stroke 1993;24:1393–6.
14. Oschmann P, Dorndorf W, Hornig C, Schäfer C, Wellensiek HJ, Pflughaupt KW. Stages and syndromes of neuroborreliosis. J Neurol 1998;245:262–72.
15. Oksi J, Kalimo H, Marttila RJ, Marjamäki M, Sonninen P, Nikoskelainen J, et al. Inflammatory brain changes in Lyme borreliosis. A report on three patients and review of literature. Brain 1996;119:2143–54.
16. Miklossy J, Kuntzer T, Bogousslavsky J, Regli F, Janzer RC. Meningovascular form of neuroborreliosis: similarities between neuropathological findings in a case of Lyme disease and those occurring in tertiary neurosyphilis. Acta Neuropathol 1990;80:568–72.
17. Mygland A, Ljøstad U, Fingerle V, Rupprecht T, Schmutzhard E, Steiner I, et al. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur J Neurol 2010;17:8–16.
18. Wilske B, Fingerle V, Schulte-Spechtel V. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol. 2007; 49: 13-21
19. Joseph FG, Scolding NJ. Cerebral vasculitis: a practical approach. Pract Neurol 2002;2:80–93.
20. Bremell D, Dotevall L. Oral doxycycline for Lyme neuroborreliosis with symptoms of encephalitis, myelitis, vasculitis or intracranial hypertension. Eur J Neurol 2014;21:1162–7

