Introdução
A rotura da placa aterosclerótica é o mecanismo patofisiológico clássico do enfarte agudo do miocárdio (EAM). Contudo, o EAM pode não ter origem em doença aterosclerótica, pelo que importa ponderarmos a possibilidade de outras alterações a nível da vasculatura coronária, sobretudo se tivermos em consideração o facto de 20% das coronariografias diagnósticas apresentarem um resultado normal1.
A Angina Variante (AV), descrita em 1959 por Prinzmetal2, é também conhecida por angina vasoespástica e apresenta uma prevalência estimada de 1 a 1,5% na Europa3. Esta caracteriza-se pela presença de dor precordial típica transitória e recorrente que surge em repouso ou com actividade física mínima e pela presença de elevação transitória do segmento ST no electrocardiograma (ECG). Estudos revelaram a presença de um padrão circadiano dos episódios isquémicos, que surgem na sua maioria durante a madrugada ou início da manhã4. Apesar de transitória, a AV pode associar-se a arritmias graves ou evoluir para EAM5. Há, no entanto, uma frequência elevada de episódios isquémicos assintomáticos, que podem atingir os 82%5. O espasmo arterial é o mecanismo subjacente à isquemia miocárdica e pode surgir em artérias coronárias angiograficamente normais6 ou em locais de estenose aterosclerótica7. Estima-se que cerca de 70% dos doentes com AV apresentam coronariografias normais4. Apesar de a fisiopatiologia não estar totalmente esclarecida, acredita-se que a disfunção endotelial e o aumento da contractilidade do músculo liso vascular são os mecanismos primários8. Consideram-se factores precipitantes de vasoespamo: desequilíbrio da actividade do sistema nervoso autónomo, aumento do stress oxidativo, inflamação crónica, deficiência de magnésio e susceptibilidade genética8. O tratamento precoce da AV é fundamental, de modo a prevenir o aparecimento de complicações, como arritmias, EAM ou até mesmo morte súbita5. A administração sublingual ou intravenosa de nitroglicerina ou dinitrato de isossorbido é eficaz no alívio do quadro agudo e os antagonistas dos canais de cálcio são extremamente eficazes na prevenção do espasmo coronário5,8.
O Bridging Miocárdico (BM), descrito em 1900, é uma anomalia coronária congénita frequente9. Corresponde à presença de um segmento intramiocárdico de uma artéria coronária epicárdica que sofre compressão durante a sístole (milking). Este localiza-se habitualmente ao nível do segmento médio da artéria coronária descendente anterior10. Apesar de ser considerada uma alteração benigna, já que o preenchimento das artérias coronárias ocorre durante a diástole, alguns estudos revelaram poder condicionar angor10 ou despoletar uma crise de angina vasoespástica11. O mecanismo fisiopatológico proposto para explicar a associação entre o BM e a AV é o stress mecânico crónico que condiciona posteriormente disfunção endotelial12, como foi demonstrado por um estudo que revelou a presença de depleção de óxido nítrico (ON) nos locais de BM12.
Caso Clínico
Homem de 58 anos, com história de tabagismo (78 unidade maço ano), dislipidemia e hipertensão arterial, admitido no serviço de urgência com dor precordial com duas horas de evolução. O ECG da admissão (figura 1) não apresentava alterações do segmento ST, o doente foi medicado com ácido acetilsalicílico (AAS) e nitrato sublingual, com alívio posterior da dor. A seriação de marcadores cardíacos revelou elevação da troponina I (máximo de 2,35 ng/dL às 12 horas), compatível com síndrome coronário agudo (SCA), pelo que foi decidida abordagem invasiva precoce com angiografia coronária. A angiografia coronária revelou fenómeno de milking no segmento médio da artéria descendente anterior (figura 2), sem doença angiográfica significativa. O caso foi interpretado como EAM secundário a BM e o doente foi medicado com AAS 100 mg qd, clopidogrel 75 mg qd, rosuvastatina 10 mg qd, carvedilol 12.5 mg qd e lisinopril 20 mg qd. Manteve-se internado sob vigilância durante 96h, sem intercorrências. O ecocardiograma transtorácico (Eco-TT) revelou ventrículo esquerdo (VE) de 9mm ao nível do septo, massa de 172gr, fracção de ejecção do VE de 57%, sem alterações segmentares ou disfunção diastólica, tendo alta mantendo a medicação instituída. Na madrugada do 1º dia pós-alta, iniciou novo quadro de dor precordial de características semelhantes. Recorreu novamente ao SU, onde realizou ECG que revelou supradesnivelamento do segmento ST nas paredes lateral e inferior (figura 3). Realizou novo cateterismo coronário, constatando-se estenose grave e longa da artéria coronária direita (figura 4, A) com reversão após dinitrato de isossorbida intracoronário (figura 4, B) e restantes alterações previamente descritas, incluindo a presença de fenómeno de milking no segmento médio da artéria descendente anterior. Houve subida do valor de troponina, que atingiu um máximo de 158 ng/dL ao T6, e foi repetido Eco-TT que revelou hipocinésia das paredes inferior e lateral de novo com fracção de ejecção dentro dos limites da normalidade. Assumido quadro de AV, suspendeu terapêutica prévia e iniciou amlodipina e mononitrato de isossorbida com boa tolerância e desde então encontra-se assintomático do ponto de vista cardiovascular, sem novos episódios de vasoespasmo coronário.
Discussão
O diagnóstico diferencial de dor precordial com coronariografia “normal” é extenso e mesmo dentro das causas cardíacas inclui um número elevado de diagnósticos possíveis, como, por exemplo, miocardite, pericardite, cardiomiopatias, doença cardíaca valvular, angina variante e angina microvascular1. As alterações electrocardiográficas e a seriação de marcadores nodoente em questão eram claramente sugestivas de um processo isquémico segmentar, nãofavorecendo as hipóteses de miocardite ou pericardite, que caracteristicamente relevam alterações globais. A inocência dos achados do ecocardiograma, que não revelaram alterações valvulares ou hipertrofia do VE, também excluíram estas alterações como etiologia da dor precordial no nosso doente. Apesar da presença de factores de risco para doença aterosclerótica e de não ter sido realizado teste de indução de vasoespasmo, acreditamos que no caso descrito a etiopatogenia dos dois EAM foi a redução da perfusão coronária pela presença de milking coronário ao nível da parede anterior e AV da coronária direita.
Importa salientar que a administração de nitratos no primeiro evento torna difícil determinar se este foi condicionado só pelo fenómeno de milking ou se poderia associadamente haver um fenómeno de vasoespasmo. O facto de não ter sido ponderado o diagnóstico de AV no primeiro internamento levou à utilização de betabloqueador não cardio-selectivo, contra-indicado nesta hipótese diagnóstica, mas de primeira linha no tratamento da isquemia induzida pelo BM. Consideramos que o bloqueio dos receptores beta 2 do músculo liso coronário pelo betabloqueador pode ter potenciado o segundo evento. A utilização de AAS, apesar de em dose baixa, poderá, também, ter contribuído, pois inibe a síntese de prostaciclina, um vasodilatador coronário.
A associação entre o BM e a AV tem sido descrita na literatura11,13-14, embora o mecanismo fisiopatológico responsável por esta associação, não está esclarecido15. Alguns autores propõem que o stress mecânico crónico do BM condiciona uma disfunção endotelial focal com predomínio de resposta vasoconstritora12, facto suportado pela evidência de depleção de óxido nítrico no endotélio das áreas de BM12. Estudos revelaram ainda que os doentes com BM apresentam, de forma significativa, mais vasoespasmo após administração intracoronária de acetilcolina14.
Partindo deste caso clínico e da breve revisão sobre angina variante e bridging miocárdico, pretendemos contribuir para o esclarecimento da possível associação entre estas duas entidades que, apesar de controversa, tem sido descrita; e alertar para a importância de serem consideradas outras hipóteses diagnósticas na presença de uma coronariografia normal.
Figura I
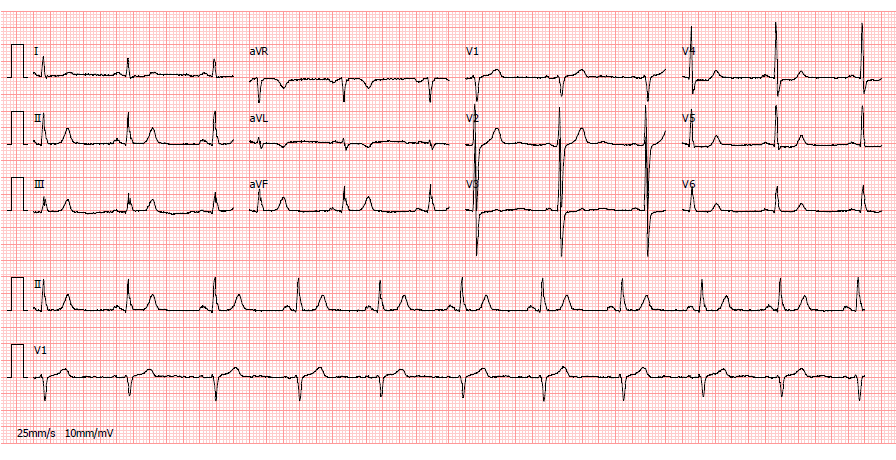
electrocardiograma em ritmo sinusal, com frequencia de 60bpm, sem alterações de repolarização do segmento ST sugestivas de isquemia aguda
Figura II
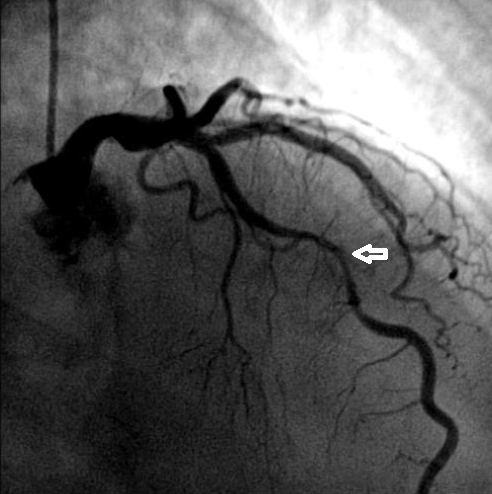
coronariografia da artéria descendente anterior revelando fenómeno de milking ao nível do segmento médio (seta)
Figura III
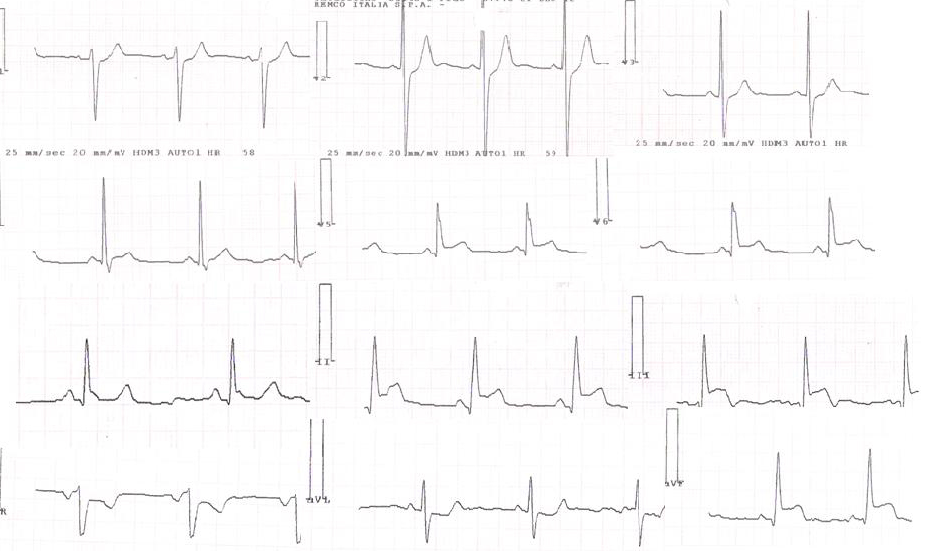
electrocardiograma em ritmo sinusal, com elevação do segmento ST nas derivações correspondentes à parede lateral e inferior (v5-v6, DII, DIII e aVF)
Figura IV
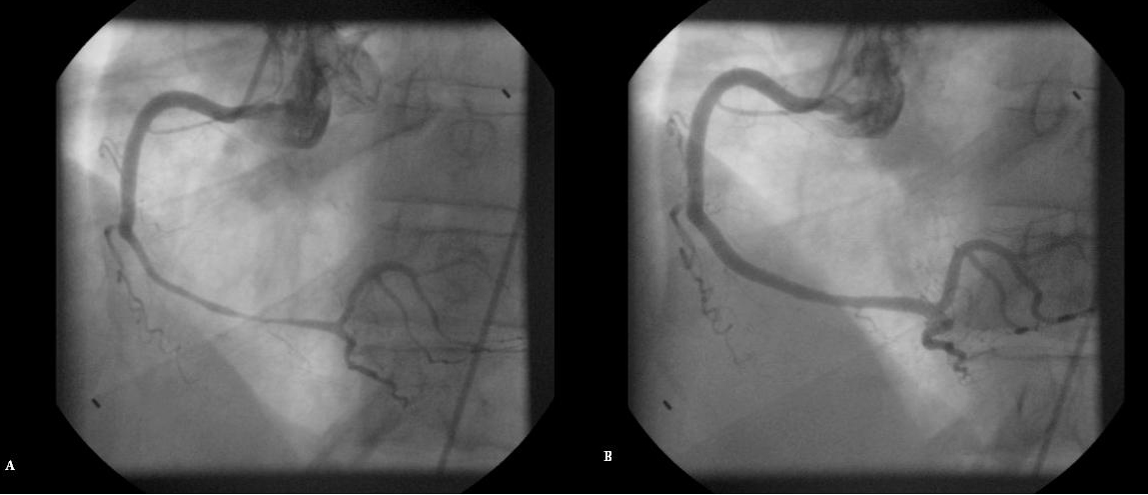
coronariografia da artéria coronária direita revelando estenose severa e longa (A) constatando-se reversão após dinitrato intracoronário (B)
BIBLIOGRAFIA
1 – Fiore DP and Beltrame JF. Chest Pain in patients with “normal angiography”: could it be cardiac?. Int J Evid Based Healthc 2013; 11:56-68.
2 – Prinzmetal M, Kennamer R, Merliss R, Wada T and Bor N. Angina pectoris I. A variant form of angina pectoris, preliminary report. Am J Med 1959; 27:375-378.
3 – Crea F and Lanza GA. New light on a forgotten disease. J Am Coll Cardiol 2011; 58:1238–1240.
4 – Yasue H and Kugiyana K. Coronary spasm: clinical features and pathogenesis. Intern Med 1997; 36:760-765.
5 – Soares-Costa JTS e Soares-Costa TJJB. Angina Variante de Prinzmetal. Rev Port Cardiol 2004; 23:1337-1356.
6 – Maseri A and Chierchia S. Coronary artery spasm: demonstration, definition, diagnosis, and consequences. Prog Cardiovasc Dis 1982; 25:169-192.
7 – Miwa K, Igawa A, Miyagi Y, Nakagawa K and Inoue H. Alterations of autonomic nervous activity preceding nocturnal variant angina: sympathetic augmentation with parasympathetic impairment. Am Heart J 1998; 135:762-771.
8 – Yasue H, Nakagawa H, Itoh T, Harada E and Mizuno Y. Coronary artery spasm – clinical features, diagnosis, pathogenesis and treatment. J Cardiol 2008; 51:2-17.impairment. Am Heart J 1998; 135:762-771.
9 – Channer KS, Bukis E, Hartnell G and Rees JR. Myocardial bridging of the coronary arteries. Clin Radiol 1989; 40:355-359.
10 – Husmann L, Nkoulou R, Wolfrum M and Kaufmann PA. Myocardial bridging causing infarction and ischaemia. Eur Heart J 2011; 790.
11 – Nardi F, Verna E, Secco GG, et al. Variant Angina Associated with Coronary Artery Endothelial Dysfunction and Myocardial Bridge: A Case Report and Review of the Literature. Intern Med 2011; 50:2601-2606.
12 – Kuhn FE, Reagan K, Mohler ER III, Satler LF, Lu DY and Rackley CE. Evidence for endothelial dysfunction and enhanced vasoconstriction in myocardial bridges. Am Heart J 1991; 122:1764-1766.
13 – Munakata K, Sato N, Sasaki Y, et al. Two cases of variant form angina pectoris associated with myocardial bridge: a possible relationship among coronary vasospasm, atherosclerosis and myocardial bridge. Jpn Circ J 1992; 56:1248-1252.
14 – Teragawa H, Fukuda Y, Matsuda K, et al. Myocardial bridging increases the risk of coronary spasm. Clin Cardiol 2003; 26:377-383.
15 – Corban MT, Hung OY, Eshtehardi P, et al. Myocardial bridging: contemporary understanding of pathophysiology with implications for diagnostic and therapeutic strategies. J Am Coll Cardiol 2014; 63:2346-55.





