INTRODUÇÃO
O Staphylococcus aureus meticilinaresistente (MRSA) surge na década de 60, pouco tempo depois do uso de meticilina na prática clinica, através da aquisição do gene mecA [1]. Em Portugal a prevalência de MRSA nosocomial varia entre hospitais, mas de uma forma geral em 2012 era das mais altas (53,8%) da Europa [2]. Além de representar um dos principais agentes responsáveis por infeções hospitalares, o Staphylococcus aureus (SA) é também um dos principais agentes isolados nas infeções da pele e tecidos moles (IPTM) adquiridas na comunidade, incluindo foliculites, impetigos, celulites e erisipelas. Tradicionalmente, as infeções causadas por MRSA eram exclusivamente documentadas em hospitais (MRSA-AH). Desde meados dos anos 90 têm sido relatadas, em vários países do mundo, infeções causadas por MRSA em doentes provenientes da comunidade (MRSA-AC) [1].
A infeção por MRSA-AC é definida quando há um isolamento do agente em colheitas de doentes em ambulatório ou até 48 horas após admissão hospitalar. Contudo o critério tempo não deve ser considerado em doentes com fatores de risco para aquisição de MRSA-AH: hospitalização no último ano, hemodiálise, uso de antibióticos, procedimentos cirúrgicos, uso de cateter venoso ou dispositivos intravasculares e cutâneos de longa permanência na altura da colheita e internamento em lares/ cuidados continuados [3]. Infeções por MRSA-AC estão habitualmente associadas a crianças, jovens e pessoas saudáveis, especialmente as que vivem em aglomerados ou com contato físico entre si. Os indivíduos com risco aumentado de desenvolver infeções por MRSA-AC são, de uma forma geral, atletas de desportos coletivos, indivíduos em serviço militar, reclusos, consumidores de drogas endovenosas, homens homossexuais, infeção por VIH, sem-abrigo e crianças de creches [1]. Estudos mostram que o MRSA-AC pode ser distinguido do MRSA-AH por estudo molecular, devido à presença do gene SCCmec tipo IV e V (que lhe determina resistência aos antibióticos beta-lactâmicos), muitas vezes associado ao gene Panton-Valentine Leukocidin (PVL), que codifica uma exotoxina letal para os leucócitos, e em combinação com outras exotoxinas é responsável pela gravidade das lesões necróticas [1]. Nenhuma das características genotípicas ajudam o clínico no cuidado do doente agudo uma vez que o estudo molecular não está disponível de forma rotineira e rápida. Além disso, desde 2003 a diferença entre MRSA-AH e MRSA-AC tem-se tornado mais ténue, com MRSA-AH em circulação na comunidade essencialmente em adultos [1]. As infeções por MRSA-AC mais comuns envolvem a pele (impetigo, celulite, erisipela) e tecidos moles em sítios diversos, frequentemente com pús. Estudos mostram que desde o surgimento do MRSA-AC verificou-se um aumento da recorrência ao serviço de urgência nos EUA por IPTM [4]. A maioria das infeções estafilocócicas são agudas e podem disseminar-se para diferentes tecidos e provocar focos metastáticos. Quadros clínicos graves, como bacteremia, pneumonia, osteomielite, endocardite, miocardite, pericardite, meningite, abscessos musculares e cerebrais, são também frequentemente documentados [5]. Estas situações apresentam-se com uma alta taxa de mortalidade apesar do uso de terapêutica dirigida [1].
CASO CLÍNICO
Homem de 28 anos, sem antecedentes patológicos. Professor de natação e praticante de surf. Admitido por edema do lábio superior, após manipulação de fissura local na semana prévia. Referia febre elevada, sintomas gerais e toracalgia esquerda, pleurítica, com dois dias de evolução. Sem dispneia ou tosse.
Ao exame físico apresentava-se consciente, colaborante e orientado. Tinha edema duro, assimétrico e indolor do lábio superior, com áreas de coloração amarela e arroxeada. Sem sinais de dificuldade respiratória. Sem adenopatias cervicais ou outras tumefações da face. Orofaringe sem alterações. Tensão arterial: 138/84mmHg; Frequência cardíaca: 104bpm; saturação periférica de oxigénio em ar ambiente: 96%; Temperatura auricular: 39ºC. Auscultação cardíaca: rítmica, sopro sistólico no ápex grau III/VI e atrito pericárdico. Auscultação pulmonar: inconclusiva devido a respiração superficial. Abdómen mole, depressível, indolor. Sem organomegalias palpáveis. Sem exantema. Sem edema periférico.
Analiticamente (Quadro 1) parâmetros inflamatórios elevados e alterações da função hepática; marcadores víricos negativos. Radiografia do tórax sem alterações. TC torácica (Figura 1) com imagens sugestivas de êmbolos sépticos, bilaterais. Ecografia abdominal com ligeira esplenomegalia homogénea. Punção aspirativa do lábio com conteúdo purulento. Colocada hipótese de endocardite infeciosa, iniciou vancomicina e gentamicina. Ecocardiograma trans-torácico (ETT) sem sinais de endocardite. Isolamento de MRSA em hemoculturas (HC) e no pús do lábio (Figura 2). Manteve febre e parâmetros inflamatórios elevados. Excluído abcesso da mandibula ou seios perinasais. Repetiu TC torácica no dia 6 (Figura 3): imagens sugestivas de êmbolos sépticos bilaterais, derrame pleural loculado bilateral e nódulos cavitados com abcessos pulmonares. Excluído empiema. Considerando-se má resposta à terapêutica, a antibioterapia foi alterada para linezolide e foi realizada drenagem total do derrame pleural esquerdo. Verificou-se melhoria clínica, analítica e imagiológica, e HC negativas. Completou 14 dias de tratamento com linezolide. Concluiu-se por embolização pulmonar séptica, com múltiplos abcessos pulmonares e derrame pleural bilateral loculado, secundários a celulite do lábio por MRSA-AC.
DISCUSSÃO
A embolia pulmonar séptica (EPS) é uma patologia grave e rara que se apresenta com febre, sintomas respiratórios e infiltrados pulmonares associados a um foco infecioso extrapulmonar. Está usualmente associada a endocardite direita, tromboflebite séptica, acessos vasculares e consumo de drogas endovenosas. Têm sido descritos casos com origem em infeções primárias profundas por MRSA-AC, como osteomielite, artrite séptica, celulite e piomiosite, algumas localizadas na cabeça e pescoço [1,6,7]. O caso apresentado é disso exemplo. O embolo que contém o microorganismo causa enfarte pulmonar com posterior formação de abcessos. Habitualmente apresenta-se em indivíduos aparentemente sem fatores de risco, com evolução rápida para taquipneia, hemoptise, febre alta, hipotensão e marcadores de inflamação elevados. Imagiologicamente verificam-se infiltrados alveolares bilaterais, opacidades nodulares (0.5-3.5cm) de predomínio periférico, pneumatocelos que evoluem para cavidades coalescentes secundárias a necrose do tecido e derrame pleural [7].
Os autores apresentam o caso de um homem jovem, previamente assintomático, que adoece com celulite do lábio. Na presença de infeção da pele, sopro cardíaco, esplenomegalia e êmbolos pulmonares bilaterais foi ponderada como hipótese diagnóstica a endocardite infeciosa e iniciada terapêutica empírica apropriada. A identificação de MRSA nas HC e pús do lábio, ETT negativo e má resposta à antibioterapia inicial levou à procura de outros focos e repetição de TC torácica. Com a descrição de abcessos pulmonares e foco infecioso cutâneo inicial, considerou-se embolização pulmonar séptica, neste caso secundária a celulite do lábio. Estando perante um individuo sem fatores de risco conhecidos, proveniente da comunidade, admitiu-se infeção por MRSA-AC.
O MRSA-AC tem um perfil genético e fenotípico diferente do MRSA-AH, mantendo sensibilidade a outros antibióticos além dos beta-lactâmicos, como cotrimoxazol, rifampicina, clindamicina e tetraciclinas. Os doentes graves (como o descrito) requerem tratamento endovenoso e as opções terapêuticas são a vancomicina, linezolide, tigeciclina ou daptomicina [8]. Estudos retrospetivos mostraram superioridade do linezolide relativamente à vancomicina no tratamento das pneumonias nosocomiais por MRSA. No caso da pneumonia necrotizante por MRSA-AC a vancomicina não diminui a produção de PVL e de outras toxinas, sendo incerto o efeito do cotrimoxazol e das fluoroquinolonas nestas situações. A associação de clindamicina demonstrou diminuição da produção de toxinas, porém têm surgido resistências que limitam o seu uso [8]. A daptomicina não deve ser usada para tratar pneumonias pois é inativada pelo surfactante pulmonar [10].
Apesar do nosso doente ter MRSA com concentração inibitória mínima (CIM) de 1ug/mL para a vancomicina, a resposta foi insatisfatória, sendo então substituída pelo linezolide ao sexto dia de internamento. A altura em que se deve considerar falência terapêutica e o tratamento alternativo é um assunto complexo. O tempo médio para ausência de bacteriemia por MRSA é de 7-9 dias, pelo que deve considerar-se a alteração terapêutica cerca do 7º dia de tratamento na bacteriemia persistente A decisão é, no entanto, baseada essencialmente na evolução clínica. De uma forma geral, nestas situações, o tratamento alternativo recomendado é a alteração do antibiótico [8].
CONCLUSÃO
Nos últimos 20 anos tem-se verificado uma alteração epidemiológica do Staphylococcus aureus com o surgimento do MRSA-AC, que se manifesta como IPTM. Uma das complicações é a EPS que pode ser fatal quando não identificada e tratada corretamente e de forma precoce. Este caso pretende salientar a gravidade e progressão rápida da infeção inicial, aparentemente benigna e alertar para a dificuldade em gerir este tipo de infeção.
Figura I
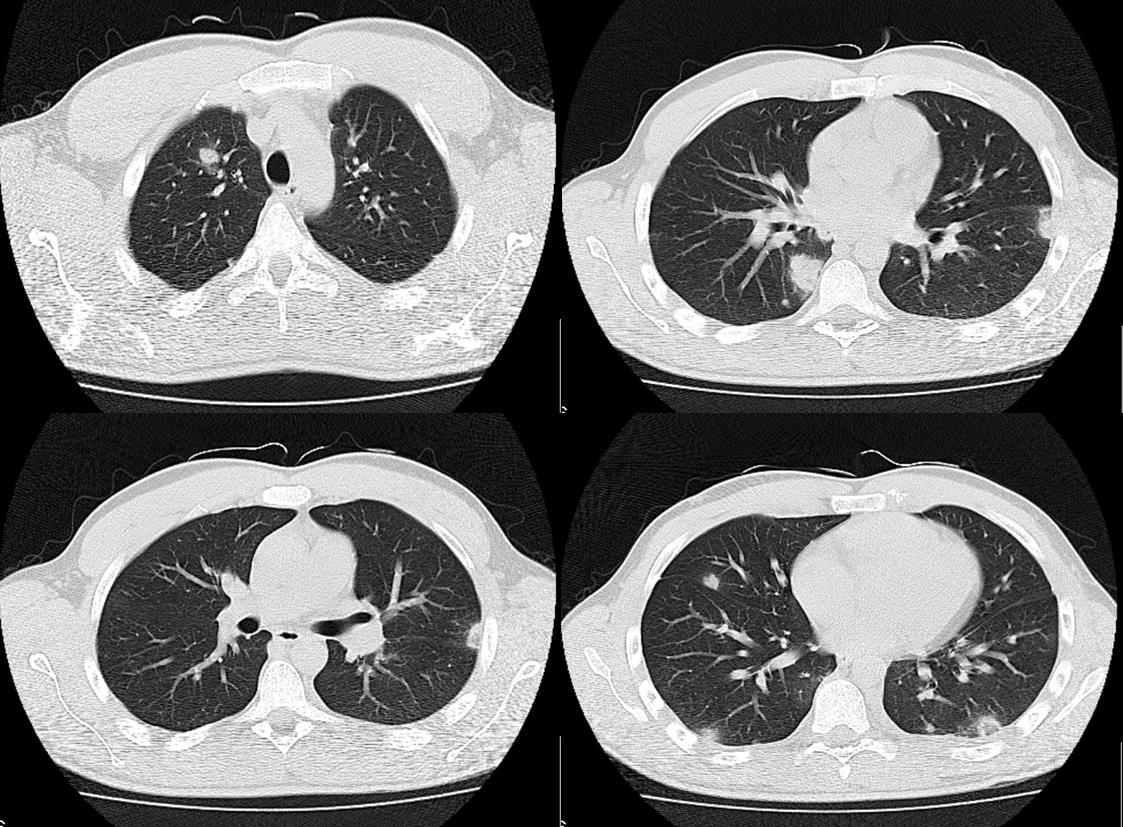
TC tórax da admissão. Mostra em ambos os campos pulmonares densificações vagamente nodulares de contornos bem definidos, irregulares, com dimensões variáveis, o maior com 25mm, alguns com áreas de cavitação interna e halos de “vidro despolido”, levantando a possibilidade de êmbolos sépticos.
Figura II
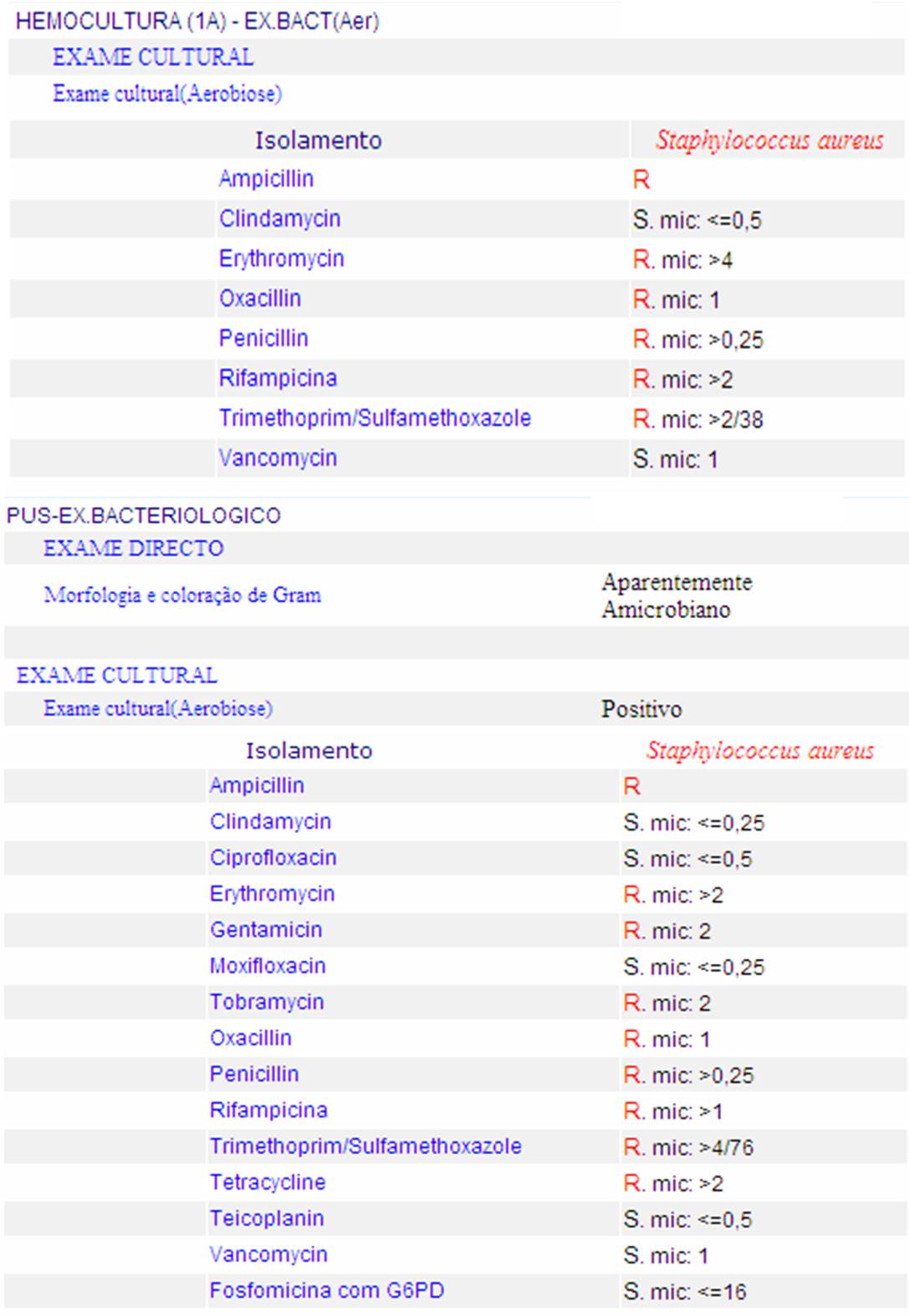
Resultados microbiológicos de cultura de sangue e pus colhido por aspiração do lábio com respectivo antibiograma. R: resistente; S: sensível; mic: concentração mínima inibitória.
Figura III
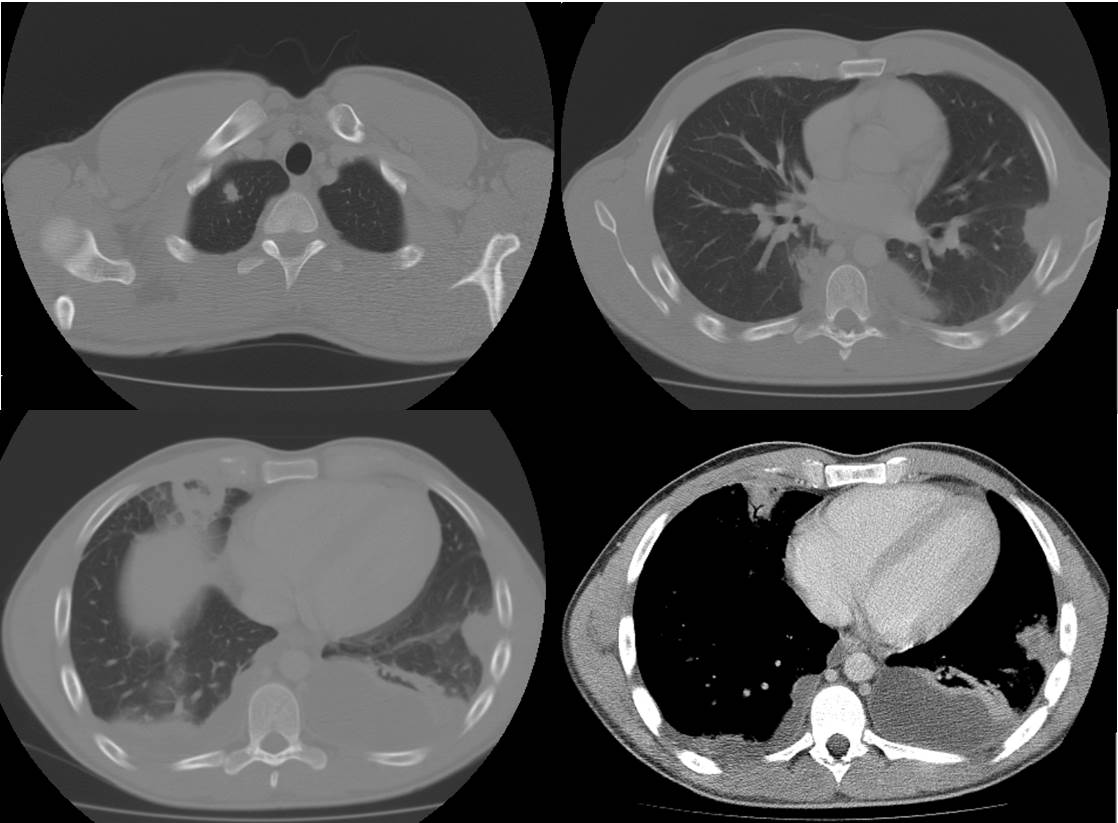
TC tórax de reavaliação. Focos de consolidação com morfologia nodular dispersos nos lobos superiores, inferiores, médio e língula, compatíveis com êmbolos sépticos pulmonares; pequenas cavitações com conteúdo líquido compatíveis com abcessos pulmonares em formação; derrame pleural de aspeto loculado na vertente posterior de ambos os pulmões, à direita de 1,7/ 2cm de espessura máxima e à esquerda medindo cerca de 5 cm; adenopatias latero-esofágica direita e infra-carinal.
Figura IV
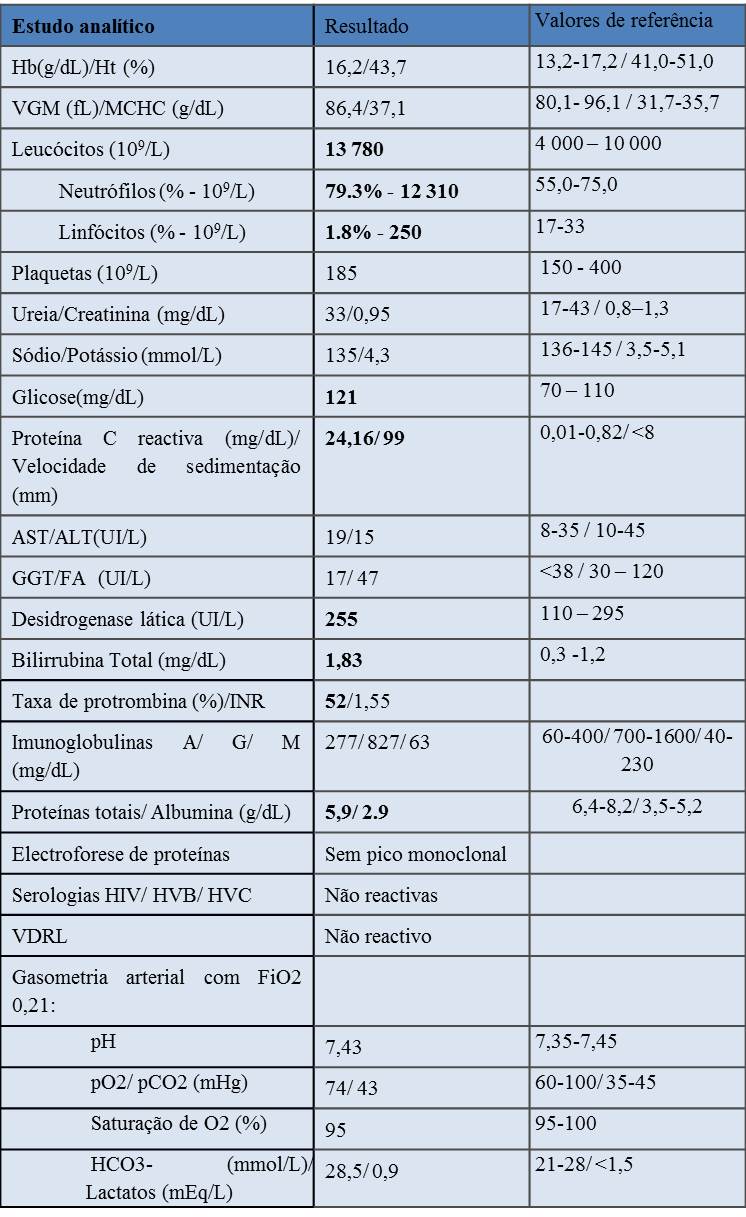
Quadro 1: Estudo analítico do doente.
BIBLIOGRAFIA
[1] David, MZ; Daum, RS. Community-Associated Methicillin-ResistantStaphylococcus aureus: Epidemiology and Clinical Consequences of an Emerging Epidemic. Clinical Microbiology Reviews, July 2010, 616–687.
[2] The European Centre for Disease Prevention and Control. Antimicrobial resistance surveillance in Europe 2012 - Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). ECDC; 2013.
[3] Buck,JM; Como-Sabetti,K; Harriman, KH; Danila,RN; Boxrud,DJ; Glennen,A; Lynfield, R. Community-associated Methicillinresistant Staphylococcus aureus, Minnesota, 2000–2003. Emerging Infectious Diseases. CDC. 2005. 11: 1532-8.
[4] Pallin, DJ; Egan, DJ; Pelletier, AJ; Espinola, JA; Hooper, DC; Camargo, CA Jr. Increased US emergency department visits for skin and soft tissue infections, and changes in antibiotic choices, during the emergence of community-associated methicillin-resistantStaphylococcus aureus. Ann Emerg Med. 2008; 51: 291–8.
[5] Lowy, FD. Staphylococcus aureus infections. N Engl J Med. 1998; 339: 520-532.
[6] Rossi, SE; Goodman, PC; Franquet, T. Nonthrombotic pulmonary emboli. AJR Am J Roentgenol. 2000; 174: 1499 –1508.
[7] Wong, KS; Lin, TY; Huang, YC; Hsia, SH; Yang, PH; Chu, SM. Clinical and radiographic spectrum of septic pulmonar embolism. Arch Dis Child. 2002; 87:312–315.
[8] Liu, C; Bayer, A; Cosgrove, SE; Daum, RS; Fridkin, SK; Gorwitz, RJ; Kaplan, SL; Karchmer, AW; et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Infectious Diseases Society of America. 2011.
[9] Mandell, LA; Wunderink, RG; Anzueto, A; Bartlett, JG; Campbell, D; Dean, NC; Dowell, SF; File, TM; et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the management of community-acquired pneumonia in adults. IDSA/ATS Guidelines for CAP in Adults. CID 2007:44 (Suppl 2).
[10] Silverman, JA; Mortin, LI; VanPraagh, DT; Li, A; Alder, J. “Inhibition of daptomycin by pulmonary surfactant: in vitro modeling and clinical impact,” Journal of Infectious Diseases, 2005, vol. 191, no. 12: 2149–2152.





