Introdução
O mesotelioma maligno é um tumor raro, menos de 1% dos cancros, que se origina nas células mesoteliais das cavidades celómicas: pleura, peritoneu, pericárdio e tunica vaginalis. A localização pleural é a mais comum, seguida pela peritoneal(1,2).
O principal factor de risco para o mesotelioma pleural maligno (MPM) é a exposição ambiental a fibras de asbestos com um prolongado período de latência, em média 40 anos (15-67 anos)(2).
As incidências mais elevadas registam-se na Austrália, Bélgica, Holanda e Reino Unido com cerca de 30 a 40 casos por milhão de habitantes, calculando-se que em França, Alemanha, Itália e Estados Unidos da América será de 11 a 20 casos/milhão. Em Portugal a taxa de incidência prevista é inferior a 11 casos/milhão(3). Segundo dados da Direcção Geral da Saúde, de 2000 a 2011 foram identificados 217 casos de mesotelioma pleural(4).
O pico de incidência pode já ter sido atingido em países como os Estados Unidos da América, prevendo-se que na Europa ocorra entre 2015-2020(2,5).
O sexo masculino é mais atingido, cerca de 80% dos casos, sobretudo a partir da 6ª década de vida. Na maioria dos doentes com MPM a apresentação clínica inicial é a de dispneia progressiva e/ou dor torácica e por vezes tosse seca. Aquando do diagnóstico os sinais físicos são secundários à doença pulmonar, geralmente um derrame pleural unilateral (95%), mais frequente à direita (60%)(6). Os sintomas do MPM são insidiosos e inespecíficos e o tempo decorrido entre as queixas iniciais e o diagnóstico é frequentemente de 2 a 6 meses(2,6). É uma doença de difícil tratamento e de prognóstico reservado, impondo-se um diagnóstico precoce.
Caso Clínico
Mulher, 57 anos de idade, secretária reformada, não fumadora, natural e residente em Lisboa. Antecedentes de acidente vascular cerebral hemorrágico, sem sequelas, hipertensão arterial essencial, diabetes mellitus não insulino-tratada, obesidade e síndrome de apneia obstrutiva do sono.
Assintomática até duas semanas antes do internamento, quando inicia dor pleurítica na base do hemitórax esquerdo e dispneia. Negava febre, emagrecimento, tosse, queixas urinárias, gastrointestinais ou sugestivas de insuficiência cardíaca. Estava apirética, normotensa, normocárdica, sem sinais de dificuldade respiratória e apresentava semiologia de derrame pleural nos dois terços inferiores do hemitórax esquerdo (fig.1), sem adenomegálias ou organomegálias, sopros cardíacos ou edemas.
Do estudo realizado destaca-se hemograma, ureia, creatinina, ionograma, enzimas hepáticas, hormonas tiroideias e electroforese proteica normais. O rastreio imunológico e a serologia VIH foram negativos. A gasometria arterial em ar ambiente revelava normoventilação e paO2 de 72mmHg. O líquido pleural era um exsudado rico em células mononucleadas, com ADA normal, sendo negativo o exame microbiológico directo e cultural. A citologia foi positiva para células de carcinoma papilar, em número escasso para estudo imunohistoquímico.
A tomografia computorizada (TC) toraco-abdomino-pélvica revelou derrame pleural bilateral, volumoso à esquerda, com atelectasia do parênquima adjacente e pequeno derrame pericárdico, sem outras alterações pulmonares, pleurais ou adenomegálias; a nível abdomino-pelvico havia macroformação quística no rim esquerdo.
A biopsia pleural esquerda “cega” mostrou hiperplasia de células mesoteliais acompanhada de ligeiro infiltrado inflamatório e proliferação vascular, sem granulomas ou tecido de neoplasia. O ecocardiograma transtorácico evidenciou diminuição da compliance ventricular e pequeno derrame pericárdico.
Nos 4 meses de investigação subsequente, a doente manteve a dor pleurítica que passou a ser bilateral e dispneia de esforço, somando-se acessos de tosse seca irritativa e emagrecimento de 10kg. O derrame pleural, agora bilateral (fig.2), permanecia com características de exsudado estéril, sem nova identificação de células neoplásicas.
As ecografias tiroideia, endovaginal e mamária, a mamografia, a endoscopia digestiva alta e a colonoscopia foram normais; a RM abdominal revelou um macroquisto renal esquerdo, sem características suspeitas de neoplasia. Por razões pessoais da doente foi finalmente realizada videotoracoscopia à direita: pleura parietal edemaciada com micronodularidade também presente na pleura visceral (fig.3). Efectuada talcagem pleural direita e drenagem bilateral. Foi ainda realizada drenagem pleural esquerda. O estudo imunohistoquimico, a citologia dos líquidos pleurais e as biopsias da pleura visceral, parietal e diafragmática à direita permitiram identificar um mesotelioma maligno, epitelióide papilar, com positividade para calretinina, Tumor de Wilms 1 (WT1), citoqueratimina 5/6 (CK 5/6) e negatividade para marcadores de carcinomas.
Na consulta de Oncologia iniciou quimioterapia paliativa com vinorrelbina, mantendo-se com razoável controlo sintomático dois anos após o diagnóstico.
Discussão
O MPM é considerado um tumor raro mas a significativa utilização de asbestos desde a década de 50 levou a um importante aumento da sua incidência. Na Europa prevê-se um pico de incidência nos próximos anos(2, 5-8). A sua abordagem permanece difícil e complexa relativamente ao diagnóstico e estadiamento e a melhor estratégia de tratamento ainda não está claramente definida.
O MPM atinge maioritariamente homens com mais de 65 anos, com exposição (inalação) a fibras de asbestos (trabalhadores da construção civil e naval, electricistas, canalizadores, carpinteiros, etc.)(2,5-8).
É geralmente uma doença profissional, contudo existem cerca de 20 a 30% de casos que podem resultar de exposição ambiental não profissional - residência em áreas onde os asbestos são um componente geológico do solo ou perto de fábricas de fibras de asbestos - ou de exposição de coabitantes de indivíduos em risco, através das roupas contaminadas no trabalho(1,2,7,9). A doente apresentada era mulher e não se documentou prévia exposição a asbestos. No entanto, o longo período decorrido entre a exposição e a apresentação clínica do MPM pode dificultar a lembrança precisa duma exposição ocupacional ou não ocupacional ocorrida muitas vezes há 30-40 anos.
Como no caso descrito, a apresentação clínica inicial é a de dor torácica e dispneia (50-70%). A dor (60-70%) é geralmente difusa, fixa, ocasionalmente pleurítica e agrava-se durante a evolução. A tosse pode ocorrer (20-30%), particularmente nos doentes com derrame pleural, mas não é geralmente um sintoma dominante. Nas fases iniciais os sintomas de doença metastática são raros e cerca de 80-95% dos doentes apresentam-se com sinais físicos e radiológicos de derrame pleural sendo mais raro o espessamento pleural focal ou difuso(2,5,10).
A citologia do derrame pleural é positiva para células neoplásicas em cerca de 1/3 dos casos. Excepto se contraindicado, deve colher-se um mínimo de 100ml de líquido pleural para permitir a recuperação de um número suficiente de células para estudo imunohistoquímico(10). No caso presente apenas na primeira amostra de líquido pleural se identificou um número escasso de células sugestivas de carcinoma papilar que não permitiu a avaliação imunohistoquímica.
Na marcha diagnóstica recomenda-se a realização de uma biopsia pleural. A biopsia percutânea “cega” tem uma baixa rentabilidade (30%) sendo a biopsia guiada por TC mais adequada se existe espessamento difuso ou massas pleurais nodulares(6,10). No caso descrito a doente tinha uma apresentação comum do MPM - derrame pleural - mas sem evidência de espessamentos pleurais. Nestes casos a melhor opção é a biopsia pleural guiada por videotoracoscopia (VT) que apresenta uma elevada eficácia diagnóstica (95%). A VT é o melhor exame para garantir uma amostra pleural segura para o diagnóstico anatomopatológico, permitindo drenagem eficaz do derrame pleural e pleurodese com talco(1,6-8,10,11).
O MPM compreende três tipos histológicos: o epitelióide (60%), o sarcomatóide (10-20%) e o bifásico (30%). O epitelióide é o mais comum e o de melhor prognóstico e o seu diagnóstico diferencial histológico deve incluir doença pleural benigna induzida por asbestos e metástases pleurais de carcinomas (adenocarcinoma do pulmão, mama, ovário e cólon e carcinoma de células renais)(12). No diagnóstico anatomopatológico de MPM deve utilizar-se um painel de marcadores imunohistoquímicos com pelo menos dois mesoteliais e dois relacionados com carcinomas. Os melhores marcadores de MPM epitélioide são a calretinina, a CK 5 ou 5/6 e o WT 1(7,10,12), cuja detecção se verificou no caso apresentado, sendo negativos os marcadores de carcinomas.
O MPM tem mau prognóstico, com uma sobrevivência nos casos não tratados de 6 a 9 meses e nos tratados de 8 a 14 meses com uma taxa de sobrevida de menos de 5% aos 5 anos(2,5,10).
Aquando do diagnóstico, cerca de 85-90% dos doentes apresenta-se com doença localmente avançada, irressecável, sendo o tratamento paliativo. O tumor é pouco sensível à radioterapia e à quimioterapia. A quimioterapia de 1ª linha é a associação de cisplatina com pemetrexed ou raltitrexed, havendo estudos que sugerem que a vinorelbina poderá ser um agente a considerar(2,7-11). Recomenda-se que os doentes sejam incluídos em ensaios clínicos randomizados, sob a supervisão de uma equipa multidisciplinar.
A radioterapia paliativa utiliza-se no alívio da dor secundária à infiltração parietal do MPM, nas metástases subcutâneas ou na prevenção destas ao longo dos trajectos de drenos ou de sondas de toracoscopia(8,9,11-13).
O controlo do derrame pleural, geralmente recorrente, é o principal tratamento para a dispneia, o sintoma mais comum nos doentes com MPM. A toracocentese repetida não deve ser realizada porque aumenta o risco de metástases subcutâneas ao longo dos trajectos dos drenos. A pleurodese com talco por toracoscopia é o melhor método de escolha para a abordagem do derrame pleural recorrente, devendo ser precocemente realizada, se não comprometer a restante estratégia oncológica(7,9-11).
Manter um elevado índice de suspeição clínica e estabelecer um diagnóstico mais precoce podem melhorar a abordagem terapêutica e o prognóstico dos doentes com MPM que devem ser incluídos em protocolos prospectivos realizados em centros de referência.
Figura I
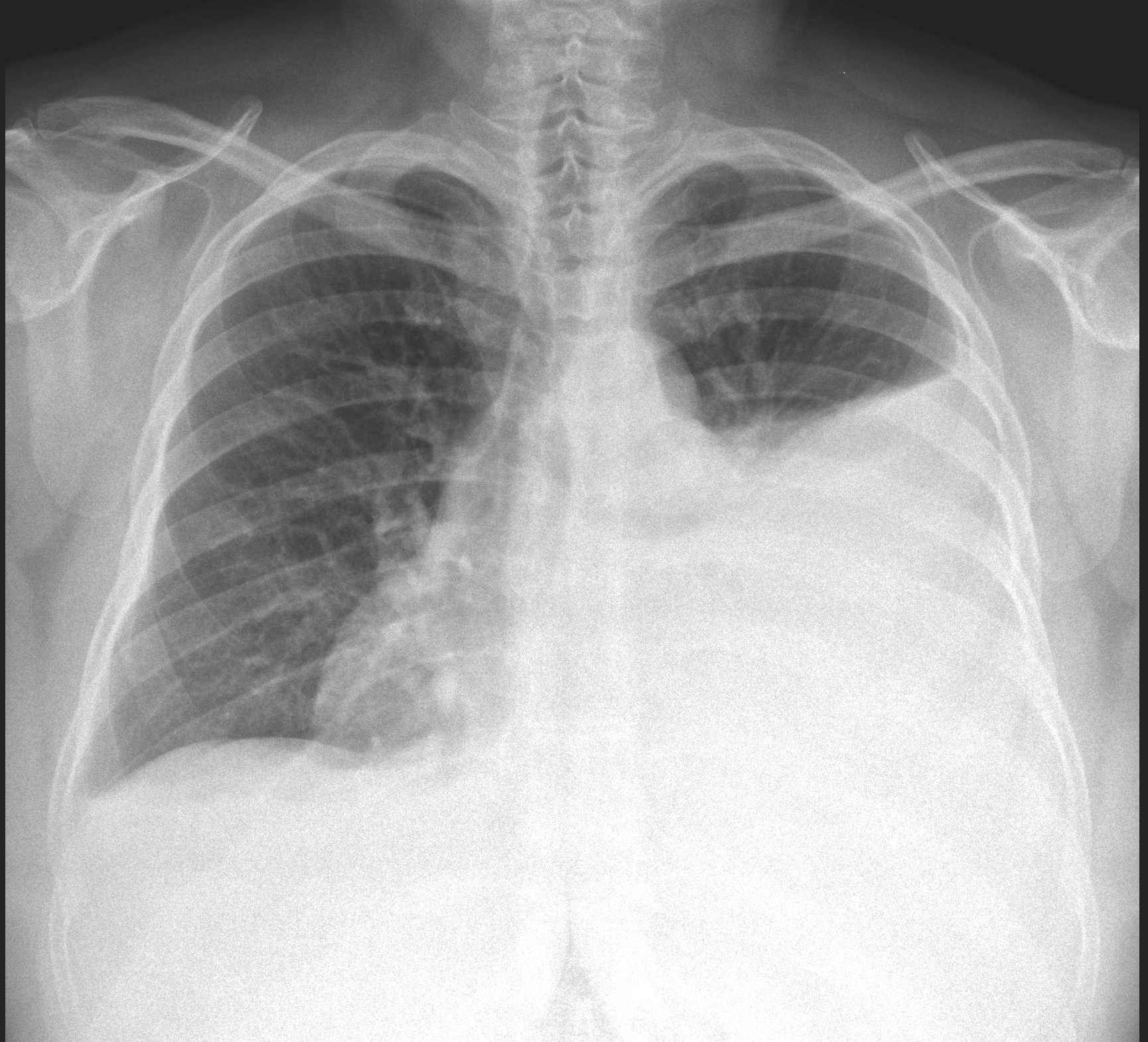
Radiograma torácico à admissão: derrame pleural esquerdo
Figura II

Radiograma torácico aos 4 meses de evolução: derrame pleural bilateral
Figura III
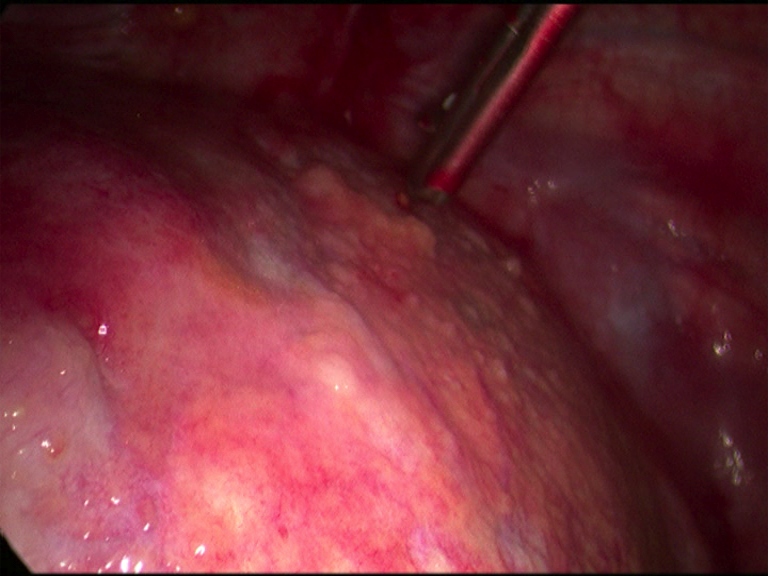
Videotoracoscopia – micronodularidade na pleura visceral
BIBLIOGRAFIA
1. Moore AJ, Parker RJ, Wiggins J. Malignant mesothelioma. Orphanet J Rare Dis 2008; 3-343 doi:1186/1750-1172-3-34
2. Meerbeck JP, Scherpereel A, Surmont VF, Baas P. Malignant pleural mesothelioma: The standard of care and challenges for future managment. Crit Rev Oncol Hematol 2011;78:92-111
3. Bianchi C, Bianchi T. Malignant mesothelioma: global incidence and relationship with asbestos. Ind Health 2007;45:379-387
4. Neto M. Mesotelioma: breve caracterização da situação portuguesa a partir dos episódios de internamento hospitalar ocorridos no período de 2000-2011. Direcção Geral da Saúde – Boletim Epidemiológico 2014; 2(5):14-16
5. Robinson BW, Lake RA. Advances in malignant mesothelioma. N Eng J Med 2005;353(15):1591-1603
6. Ismail-Khan R, Robinson LA, Williams CC, Garret CR, Bepler G, Simon GR. Malignant pleural mesothelioma: A comprehensive review. Cancer Control 2008;13(4):255-263
7. Scherpereel A, Astoul P, Baas P, Berghmans T, Clayson H, Vuyst P et al. Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the managment of malignant pleural meosthelioma. Eur Respir J 2010;35:479-495
8. Pinto C, Novelho S, Torri V, Ardizzoni A, Betta P, Bertazzi P et al. Second Italian Consensus Conference on Malignant Pleural Mesothelioma: state of the art and recommendations. Cancer Treat Rev 2013(4);39:328-339
9. British Thoracic Society Standards of Care Comittee. BTS Statement on Malignant Mesothelioma in the UK, 2007. Thorax 2007;62(suppl II):ii1-ii19
10. Zandwijk N, Clarke C, Henderson D, Musk W, Fong K, Nowak A et al. Guidelines for the diagnosis and treatment of malignant pleural mesothelioma. J. Thorac Dis 2013;5(6):E254-E307
11. Scherpereel A, French Speaking Society of Chest Medicine (SPLF) Experts Group. Guidelines of the French Speaking Society for Chest Medicine for management of malignant pleural mesothelioma. Respir Med 2007;101:1265-1276
12. Husain A, Colby T, Ordonez N, Krausz T, Attanoos R, Beasley M et al. Guidelines for Pathologic Diagnosis of Malignant Mesothelioma. 2012 Update of the Consensus Statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med 2013;137:647-667




