Introdução
A mucormicose é uma infeção potencialmente fatal causada por fungos da ordem Mucorales, que afeta pacientes imunocomprometidos, nomeadamente com diabetes mellitus, transplante, neutropenia ou neoplasias, sobretudo hematológicas1-4.
A incidência da mucormicose parece estar a aumentar, principalmente à custa da infeção de doentes oncológicos. De entre os pacientes com neoplasias hematológicas (NH), aqueles com leucemia mielóide aguda (LMA) estão em maior risco de contrair mucormicose (incidência de 1% a 8%)3.
Esta doença é caracterizada pela invasão da vasculatura dos tecidos hospedeiros por hifas fúngicas, resultando em enfarte e necrose dos tecidos3-5. As manifestações clínicas são variadas, sendo as mais comuns a infeção rino-orbital-cerebral e a pulmonar, no entanto, pode manifestar-se como infeção do sistema nervoso central isolada, gastrointestinal, cutânea, renal e disseminada3-6.
O diagnóstico é um desafio pois não existe nenhum teste serológico específico, sendo necessário a identificação histopatológica com confirmação cultural2,4,5. Se a biópsia dos tecidos afetados não for possível, todas as amostras, incluindo expetoração e lavado bronco-alveolar, devem ser utilizadas para exame direto e cultural2,4.
O tratamento deve ser agressivo e efetuado o mais precocemente possível, assentando na combinação de terapêutica antifúngica e desbridamento cirúrgico dos tecidos infetados1-5. A terapêutica antifúngica de primeira linha é a anfotericina B lipossómica endovenosa (5-10mg/Kg/dia), podendo associar-se o posaconazol (200mg, 4 vezes/dia)1,2,5,7. O desbridamento cirúrgico é essencial na infeção rino-orbital-cerebral, no entanto, nem sempre é possível na infeção pulmonar, que em muitos casos se apresenta com atingimento multilobar5. A eliminação de fatores predisponentes (neutropenia, hiperglicemia, acidose metabólica e fármacos imunossupressores) é essencial4,5.
Apesar do diagnóstico precoce e terapêutica combinada agressiva, a taxa de resposta é baixa, com uma taxa de mortalidade que vai de 25% (mucormicose rino-orbital-cerebral) a 87% (mucormicose pulmonar), podendo atingir 90-100% nos casos de infeção disseminada5.
Caso clínico
Os autores apresentam um homem de 45 anos, internado por leucemia aguda inaugural, à admissão com clínica de astenia e anorexia e analiticamente com pancitopenia (tabela 1). No internamento de Hematologia Clínica realizou-se esfregaço de sangue periférico que revelou quadro leucoeritroblástico compatível com leucemia aguda, de características morfológicas de linhagem mieloide. A imunofenotipagem de medula óssea demonstrou a presença de 30% blastos de linhagem mielóide (CD34+, CD13+, CD117+, HLA Dr+, CD3 negativo, CD7 negativo, CD19 negativo, CD79 negativo) e o estudo citogenético e molecular revelou um cariótipo complexo (45,XY,add(3)(q27),-7,add(12)(q24),-22,+mar[14]) e ausência de mutações com implicações prognósticas (FLT3-ITD e NPM1). Segundo o protocolo vigente no Serviço de Hematologia, foi iniciada quimioterapia de indução com Citarabina em altas doses.
Ao 2º dia de internamento iniciou febre (temperatura axilar > 38.1ºC), sem outros sintomas ou sinais associados. Do estudo realizado, a referir agravamento da neutropenia e aumento da proteína C reativa (PCR) – tabela 1. Sedimento urinário inocente, radiografia torácica sem condensações agudas, ecocardiograma sem evidência de endocardite infeciosa e ecografia abdominal com ligeira hepato-esplenomegalia (fígado com 16cm de diâmetro longitudinal e baço com 13cm de diâmetro bipolar) e fina lâmina de líquido livre intraperitoneal. Microbiologicamente sem isolamento de agente: serologias negativas (Vírus da Hepatite B e C, Vírus da Imunodeficiência Humana, Citomegalovírus, Toxoplasmose e Vírus Epstein-Barr), hemoculturas, urocultura e bacteriológico de expetoração negativos. Nesta fase assumiu-se o diagnóstico de neutropenia febril e iniciou empiricamente imipenem 500mg 6/6 horas, com resposta inicial favorável com apirexia e melhoria dos parâmetros inflamatórios.
No entanto, ao 5º dia de imipenem verificou-se aumento da PCR (tabela 1) associado a febre de novo e dor pleurítica esquerda, sem tosse ou expetoração. Radiologicamente com infiltrado intersticial esquerdo fugaz (fig. 1). Nesta fase colheu novo rastreio séptico e iniciou empiricamente vancomicina.
Não se identificou agente etiológico no rastreio séptico colhido (bacteriológico e micológico de sangue periférico, urina e expetoração) e para melhor caracterização da imagem pulmonar realizou tomografia computorizada (TC) torácica que identificou micronódulos centrilobulares, sobretudo no segmento ápico-posterior do lobo superior esquerdo e posterior do lobo superior direito, sugestivos de etiologia infeciosa (fig. 2). Com a manutenção de terapêutica antibiótica com imipenem e vancomicina verificou-se melhoria clínica e analítica gradual, com apirexia sustentada desde o 5º dia de terapêutica associada.
Ao 16º dia de internamento novo quadro febril com aumento dos parâmetros inflamatórios, mas sem clínica focal associada, pelo que após colheita de novo rastreio séptico se escalou antibioterapia, suspendendo imipenem e associando piperacilina/tazobactam 4.5g 6/6 horas e amicacina 1g/dia.
Ao 18º dia de internamento agravamento clínico com início de dor abdominal, localizada no hipocôndrio direito, com resposta precária à terapêutica analgésica. Analiticamente sem evidência de pancreatite ou colecistite e TC abdomino-pélvica com identificação de lesão nodular hepática (3,5cm de diâmetro) e esplénica (11cm de diâmetro) levantando a hipótese de abscesso ou infiltração por doença hematológica (fig. 3). Perante estas hipóteses iniciou-se metronidazol 500mg 6/6 horas e realizou-se biópsia hepática aspirativa ecoguiada.
A análise histopatológica identificou granulomas epitelióides e estruturas fúngicas (hifas), sem evidência de lesão neoplásica, e, apesar de não se ter obtido isolamento microbiológico, foi iniciada terapia antifúngica empírica (anfotericina B lipossómica 5mg/kg/dia).
Apesar de todos os ajustes terapêuticos efetuados verificou-se deterioração clínica, com aplasia terapêutica prolongada pela infeção e aparecimento de manifestações hemorrágicas (gengivorragia e hematúria), com necessidade de suporte transfusional mais frequente e início de fator de crescimento de granulócitos (Filgastrim 300mcg/dia, subcutâneo). Verificou-se ainda início de disfunção hepática, respiratória (frequência respiratória > 35ciclos por minuto e Ratio PaO2/FiO2 <100) e cardiovascular (hipotensão com necessidade de vasopressores), culminando em admissão em unidade de cuidados intensivos.
À admissão na unidade foi repetida TC torácica que evidenciou agravamento das áreas de consolidação nos lobos inferiores bilateralmente, com padrão sugestivo de intercorrência infeciosa inespecífica e colheu novo rastreio séptico. No exame cultural de lavado brônquico foi identificado Mucor spp, assumindo-se então o diagnóstico de infeção fúngica invasiva (mucormicose) com atingimento respiratório, hepático e esplénico (provável) e consequente disfunção multiorgânica.
Pela gravidade do quadro clínico e ausência de resposta à anfotericina B isolada, optou-se por associar posaconazol 200mg 6/6 horas. Infelizmente, o desbridamento cirúrgico não foi possível neste doente pela disseminação da doença fúngica e pela gravidade das co-morbilidades presentes, nomeadamente LMA inaugural com pancitopenia grave. O paciente desenvolveu choque séptico refratário por mucormicose disseminada com hipotensão e hiperlactacidémia apesar de noradrenalina > 40mg/hora, hidrocortisona 200mg/dia e fluidoterapia intensiva, bem como aumento dos parâmetros inflamatórios apesar de terapêutica antibacteriana e antifúngica de largo espectro (vancomicina, piperacilina/tazobactam, amicacina, anfotericina B lipossómica, posaconazol). Em isolamentos posteriores, objetivou-se sobre infeção pulmonar bacteriana por Klebsiella oxytoca (secreções brônquicas) e Enterococcus faecium (hemoculturas), acabando por falecer em falência multiorgânica13 dias após admissão na unidade de cuidados intensivos.
Discussão
O diagnóstico da mucormicose é um desafio, não só porque cursa com sintomatologia inespecífica, mas também porque não existe um teste serológico específico e a identificação histopatológica dos fungos nem sempre é fácil.
O paciente aqui apresentado possuía os principais fatores de risco para o desenvolvimento de infeção por Mucor, LMA sob quimioterapia de indução e aplasia terapêutica com neutropenia grave sem resposta ao fator de crescimento. Clinicamente apresentou-se com sintomas e sinais inespecíficos, com possível foco infecioso respiratório e/ou abdominal, o que geralmente acontece nestes doentes, mas dificulta e atrasa o diagnóstico.
No nosso doente o primeiro exame a sugerir a presença de infeção fúngica por Mucor foi a análise histopatológica do tecido hepático, com identificação de granulomas epitelióides e estruturas fúngicas (hifas). Como se sabe, a identificação microscópica de hifas é altamente sugestiva de mucormicose, devendo ser complementada com a identificação histopatológica das mesmas em tecidos necróticos com sinais de angioinvasão, enfarte, infiltrados neutrofílicos e/ou granulomas2. A confirmação cultural foi efetuada no lavado brônquico, com identificação de Mucor spp. Este isolamento permitiu o diagnóstico de mucormicose pulmonar, mas tendo em conta a biópsia hepática sugestiva de infeção fúngica, nomeadamente por Mucor, e a presença de lesões esplénicas com características semelhantes, assumiu-se o diagnóstico de infeção fúngica invasiva com atingimento respiratório, hepático e esplénico.
Como referido previamente, o prognóstico dos pacientes com mucormicose respiratória ou disseminada é pior, pela incapacidade de controlo eficaz do foco de infeção. No doente aqui apresentado este foi um dos problemas, o outro foi a incapacidade de controlar os fatores predisponentes, nomeadamente a neutropenia e LMA.
Conclusão
Com este caso os autores pretendem relembrar uma patologia rara, mas letal, que se apresenta com clínica inespecífica, e para a qual o melhor tratamento é a instituição precoce de terapêutica antifúngica e desbridamento cirúrgico dos tecidos infetados.
A mucormicose tem emergido como importante infeção fúngica com elevada mortalidade, sendo pois obrigatório incluí-la no diagnóstico diferencial de patologias infeciosas em doentes que apresentem fatores de risco.
Figura I
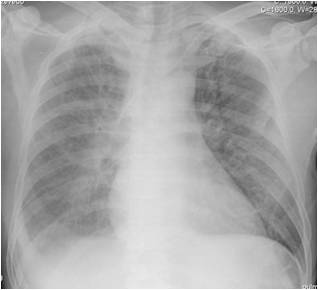
Figura 1: Radiografia torácica realizada no 6º dia de internamento que revela infiltrado intersticial esquerdo.
Figura I
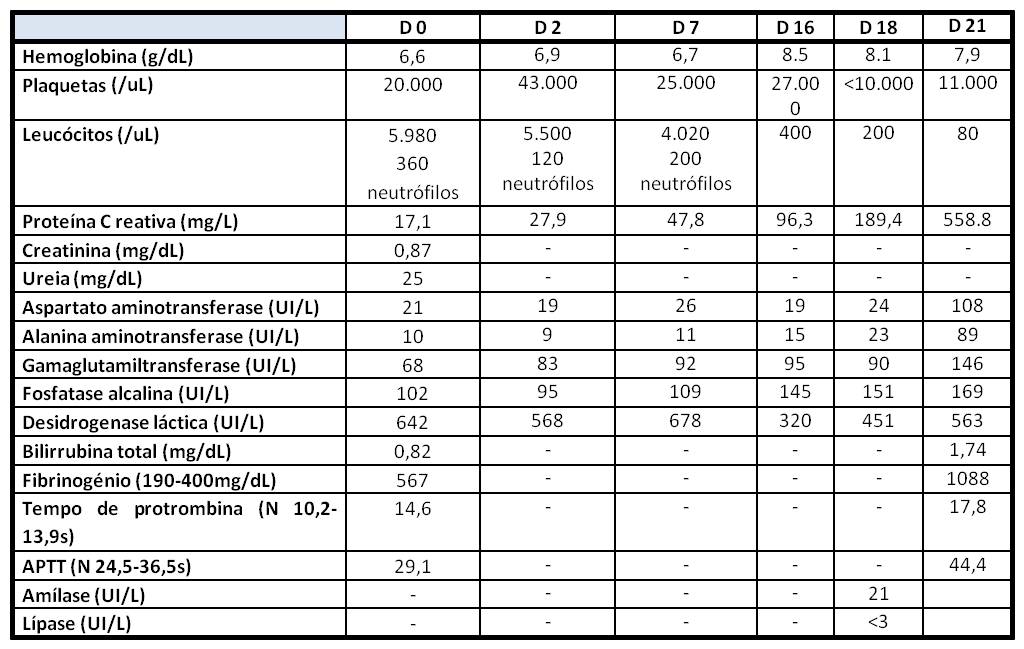
Tabela 1: Evolução analítica durante internamento. Legenda: D – dia de internamento, N - normal.
Figura II
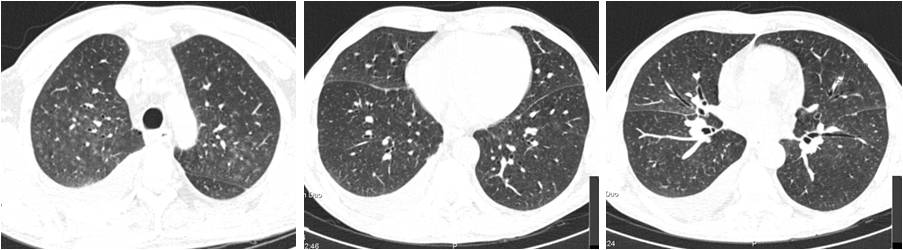
Figura 2: Tomografia Computorizada torácica realizada ao 12º dia de internamento: Derrame pleural à esquerda de pequeno volume e de médio volume à direita. Sem derrame pericárdico. No parênquima pulmonar observam-se alguns micronódulos centrilobulares, sobretudo no segmento apico-posterior do LSE e posterior do LSD, que no contexto sugerem etiologia infeciosa. Pequena nodularidade no segmento superior da língula, com 7mm, provavelmente com idêntico significado. Atelectasia subsegmentar na base direita, adjacente ao derrame. Escassas bolhas de enfisema paraseptal.
Figura III
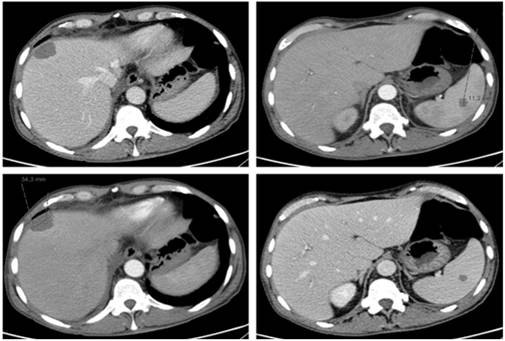
Figura 3: Tomografia Computorizada abdomino-pélvica realizada no 19º dia de internamento: Nos planos craniais do segmento hepático VIII identifica-se uma lesão nodular periférica com cerca de 3.5 cm de maior diâmetro, que se estende até à cápsula hepática, de características inespecíficas. A sua densidade e o facto de não se identificar em ecografias prévias sugerem que não se trate de um quisto biliar. No contexto deste doente (aplásico), as duas hipóteses mais prováveis são um abcesso ou envolvimento pela doença linfoproliferativa. Identifica-se uma lesão no baço com 11 mm com idênticas características e à qual se aplicam os mesmos princípios da lesão hepática.
BIBLIOGRAFIA
1. Spellberg B, et al. Recent Advances in the Management of Mucormycosis: From Bench to Bedside. Clinical Infectious Diseases 2009; 48: 1743–1751. 2. Skiada A, et al. Diagnosis and treatment of mucormycosis in patients with hematological malignancies: guidelines from the 3rd European Conference on Infections in Leukemia (ECIL 3). Haematologica 2013; 98(4): 492-504. 3. Petrikkos G, et al. Epidemiology and Clinical Manifestations of Mucormycosis. Clinical Infectious Diseases 2012; 54(S1): S23–34. 4. Greenberg RN, Scott LJ, Vaughn HH, Ribes JA. Zygomycosis (mucormycosis): emerging clinical importance and new treatments. Curr Opin Infect Dis 2004; 17: 517. 5. Cox GM, et al. Mucormycosis (zygomycosis). In UpToDate, download January 2014. 6. Roden MM, Zaoutis TE, Buchanan WL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis 2005; 41: 634-653. 7. van Burik JA, Hare RS, Solomon HF, et al. Posaconazole is effective as salvage therapy in zygomycosis: a retrospective summary of 91 cases. Clin Infect Dis 2006; 42: e61. 8. Gonzalez CE, Couriel DR, Walsh TJ. Disseminated zygomycosis in a neutropenic patient: successful treatment with amphotericin B lipid complex and granulocyte colony-stimulating factor. Clin Infect Dis 1997; 24: 192-196.





