Introdução:
O sarcoma de Kaposi (SK) era uma neoplasia rara antes da epidemia pelo vírus da imunodeficiência humana (VIH), após a qual, a sua incidência aumentou até cerca de 70 vezes¹, particularmente no grupo dos doentes do sexo masculino homossexuais, que apresentam um risco de ocorrência de SK significativamente mais elevado do que os doentes infetados por contacto heterossexual ou por via parentérica¹.
Trata-se de uma neoplasia com atingimento multisistémico, sendo a pele, mucosas e tubo digestivo as zonas mais afetadas. As lesões do parênquima pulmonar são mais raras e com pior prognóstico¹.
Relaciona-se com a infeção pelo vírus herpes humano 8 (VHH8). Esta relação tem vindo a ser reforçada pela evidência científica produzida desde que Chang identificou sequências de ADN com características semelhantes às dos vírus herpes em células de SK¹, nos quatro tipos epidemiológicos identificados (clássico ou mediterrâneo, endémico, iatrogénico ou associado a transplantes e epidémico ou associado à SIDA)¹.
Recentemente, o VHH8 foi associado a uma nova forma de linfoma, o linfoma originado em cavidades corporais¹. O aumento de incidência de linfoma não-HODGKIN (LNH) no contexto da infeção por VIH foi reconhecido desde cedo, com um aumento de risco relativamente à população não infetada na ordem das 145 vezes para o linfoma difuso de grandes células¹.
Caso clínico:
Homem de 31 anos, caucasiano, bissexual, com história de sífilis secundária e sarcoma de Kaposi (SK), seguido em consulta de Dermatologia, sem medicação habitual, sem hábitos tabágicos nem toxifílicos, sem alergias conhecidas.
Recorreu ao serviço de urgência por quadro, com cerca de 1 semana de evolução, de dor pleurítica à esquerda, dispneia de agravamento progressivo, tosse produtiva raiada de sangue e febre vespertina, até 38ºC.
Ao exame objetivo estava vígil, colaborante e orientado no tempo e espaço. Apresentava lesões cutâneas arroxeadas dispersas pela face, couro cabeludo, cavidade oral, palato, tronco, dorso e membros superiores (fig. 1 e 2); adenopatias inguinais bilaterais com cerca de 1 a 2 cm de maior diâmetro, móveis, firmes e indolores à palpação, condicionando ligeiro edema dos membros inferiores. Estava subfebril, com temperatura auricular de 37.9ºC, hemodinamicamente estável, a saturar a 96% em ar ambiente. À auscultação pulmonar com ausência de murmúrio vesicular nos dois terços inferiores do campo pulmonar esquerdo e base do campo pulmonar direito; auscultação cardíaca sem alterações; palpação abdominal com abdómen mole e depressível, indolor à palpação superficial e profunda, sem defesa, bordo inferior do fígado não palpável abaixo de rebordo costal, baço não palpável, timpanismo abdominal, ruídos hidroaéreos presentes, de timbre e intensidade normal.
Analiticamente tinha uma pancitopneia com 7,6 g/dL de hemoglobina, 2820/uL leucócitos e 109 000/uL plaquetas; proteína C reativa aumentada (3,79 mg/dL); ureia, creatinina e ionograma normais. Realizou telerradiografia (RX) do tórax que mostrou derrame pleural nos dois terços inferiores do campo pulmonar esquerdo (fig. 3). Considerando os antecedentes do doente, fez o teste de rastreio do VIH que foi positivo. Efetuada toracocentese diagnóstica e terapêutica com alívio dos sintomas. Saída de líquido sero-hemático com características de exsudato, DHL líquido pleural 1229 u/L (5,4 vezes maior que o limite superior do normal; ratio DHL líquido pleural / sérica de 7,2), proteínas do líquido de 5,5 g/dL (ratio proteínas líquido pleural / séricas de 0,8) e exame microbiológico negativo. Foi internado para estudo e tratamento.
Apresentava infeção VIH / SIDA estádio C3 do CDC, com 88 células/uL de CD4+ e carga vírica de 10901 cópias/mL. Os marcadores víricos para a hepatite A, B e C eram negativos, assim como as serologias da toxoplasmose, herpes simplex I e II eram negativas para infeção aguda. A pesquisa de micobactérias na expetoração foi negativa.
Realizou tomografia axial computorizada (TAC) toraco-abdomino-pélvico que revelou volumoso derrame pleural bilateral, mais marcado à esquerda (fig. 4), condicionando atelectasia completa do lobo pulmonar inferior e de grande parte do lobo pulmonar superior esquerdos; atelectasia de grande parte do lobo pulmonar inferior e de pequena parte do lobo pulmonar médio direitos; hepatoesplenomegália homogénea e múltiplas adenomegálias na raíz do mesentério.
A broncofibroscopia mostrou edema e congestão difusa com algumas áreas eritmatosas sugestivas de SK (fig. 5). Os exames culturais (microbiológico, micobateriológico e pesquisa de antigénio para Pneumocystis jiroveci e BAAR) do lavado bronco-alveolar foram negativos. Realizou toracocentese com biópsia pleural, com colheita de líquido pleural para exame microbiológico, micobateriológico e pesquisa de fungos que foram negativos; o exame histológico da pleura foi inconclusivo.
Concluiu-se tratar de infeção VIH/SIDA de novo com SK com atingimento da pele e mucosas (estádio T1 I1 0x) e derrame pleural de etiologia indeterminada. Iniciou terapêutica anti-retrovírica com abacavir, lamivudina, darunavir e ritonavir; e quimioterapia (QT) com doxorubicina. Teve alta orientado para as consultas de Doenças Infeciosas e de Oncologia Médica.
Por agravamento da dispneia, realizou novo RX do tórax que revelou derrame pleural direito de médio volume (fig. 6). Efetuado novo estudo por broncofibroscopia com colheita de líquido pleural para imunofenotipagem que revelou a presença de plasmócitos com características fenotípicas anormais: CD45+; CD19+ e CD71+, alterações compatíveis com a presença de linfoma difuso de grandes células/plasmoblástico. Alterado o esquema de QT para rituximab com ciclofosfmida, doxorubicina, vincristina e prednisolona (R-CHOP).
Suspendeu quimioterapia ao 5º ciclo por progressão da doença e infeção respiratória concomitante. Faleceu 5 meses após o diagnóstico por insuficiência respiratória tipo 1 não responsiva à oxigenioterapia e sem evidência foco infecioso ou metastização pulmonar.
Discussão:
O vírus da imunodeficiência humana predispõe ao desenvolvimento de neoplasias (25 – 40%), nomeadamente linfomas²˒³.
Os linfomas associados ao VIH dividem-se em 3 tipos: linfomas não HODGKIN sistémicos, linfomas primários do sistema nervoso central e o linfoma das cavidades corporais⁴.
O VHH8 pertence à família dos herpes vírus humanos gama. Os vírus desta família desempenham um papel importante na proliferação celular e no desenvolvimento de neoplasias. O VHH8 tem tropismo para uma grande variedade celular, incluindo células B, células endoteliais, células epiteliais e macrófagos⁵.
Evidências crescentes têm vindo a demonstrar uma associação do VHH8 na patogénese do linfoma pleural primário (LPP). O mecanismo preciso é desconhecido, mas sabe-se que os indivíduos com infeção para o VHH8 têm um risco aumentado de desenvolverem LPP, assim como a perda do genoma do VHH8 resulta na morte das células do LPP⁶.
A primeira patologia associada à infeção pelo VHH8 foi o SK, no entanto, rapidamente se descobriu que este agente predispõe não só ao desenvolvimento de SK, mas também de outras condições neoplásicas como a doença de Castleman e o LPP. Esta associação permite estabelecer uma interligação entre estas patologias, podendo-se afirmar que indivíduos com distúrbios relacionados com a infeção pelo VHH8, nomeadamente SK, têm um risco aumentado de desenvolver LPP e vice-versa. Neste caso, apesar de ter sido solicitada a colheita da PCR do ADN do VHH8 no líquido pleural, não foi realizada por motivos externos ao Serviço. No entanto, concluiu-se tratar-se de LPP associado a SK, presumindo-se a presença de um mesmo agente etiológico, o VHH8.
O linfoma das cavidades corporais apresenta-se na forma de derrames neoplásicos pleurais (60-90%), peritoneais (30-60%), pericárdicos (cerda de 30%), espaços articulares e meninges (raramente) na ausência de um tumor sólido⁴. O LPP é um subtipo muito raro dos linfomas B (<4%)⁴. Ocorre predominantemente em imunocomprometidos, particularmente naqueles infetados pelo VIH. Atinge preferencialmente os homens, o que pode refletir um aumento marcado da prevalência da infeção VIH neste grupo⁴.
A sintomatologia inicial relaciona-se com o acúmulo de fluídos nas cavidades, no caso do LPP a dispneia é o sintoma mais comum. O RX torácico e/ou a TAC torácica evidenciam o derrame pleural, acompanhado de espessamento pleural ligeiro na ausência de alterações do parênquima, massas sólidas ou alargamento do mediastino⁷. A avaliação do líquido pleural é fundamental, sendo que em 90% dos casos a imunofenotipagem demonstra a expressão de plasmócitos CD 45+⁸.
Apesar do baixo grau de disseminação, o LPP causa destruição local grave conferindo-lhe um mau prognóstico sem tratamento, com uma sobrevida média de 2 a 3 meses⁸. Mesmo com QT agressiva, a sobrevida média não ultrapassa os 6 meses⁸. Os regimes com ciclofosfamida, doxorrubicina e vincristina são os recomendados⁸. Naqueles em que a QT sistémica não foi possível ou falhou, a radioterapia local pode ser tentada⁹. A terapêutica anti-retrovírica, desempenha um papel fundamental nos doentes com infeção VIH e deve ser instituída rapidamente. A escolha deve ter em consideração as interações entre fármacos (anti-retrovirais e quimioterápicos)⁴.
Conclusão:
Apesar do LPP ser um subtipo muito raro de linfomas B, deve ser considerado em doentes com infeção VIH/SIDA e SK com derrame pleural de novo.
Figura I
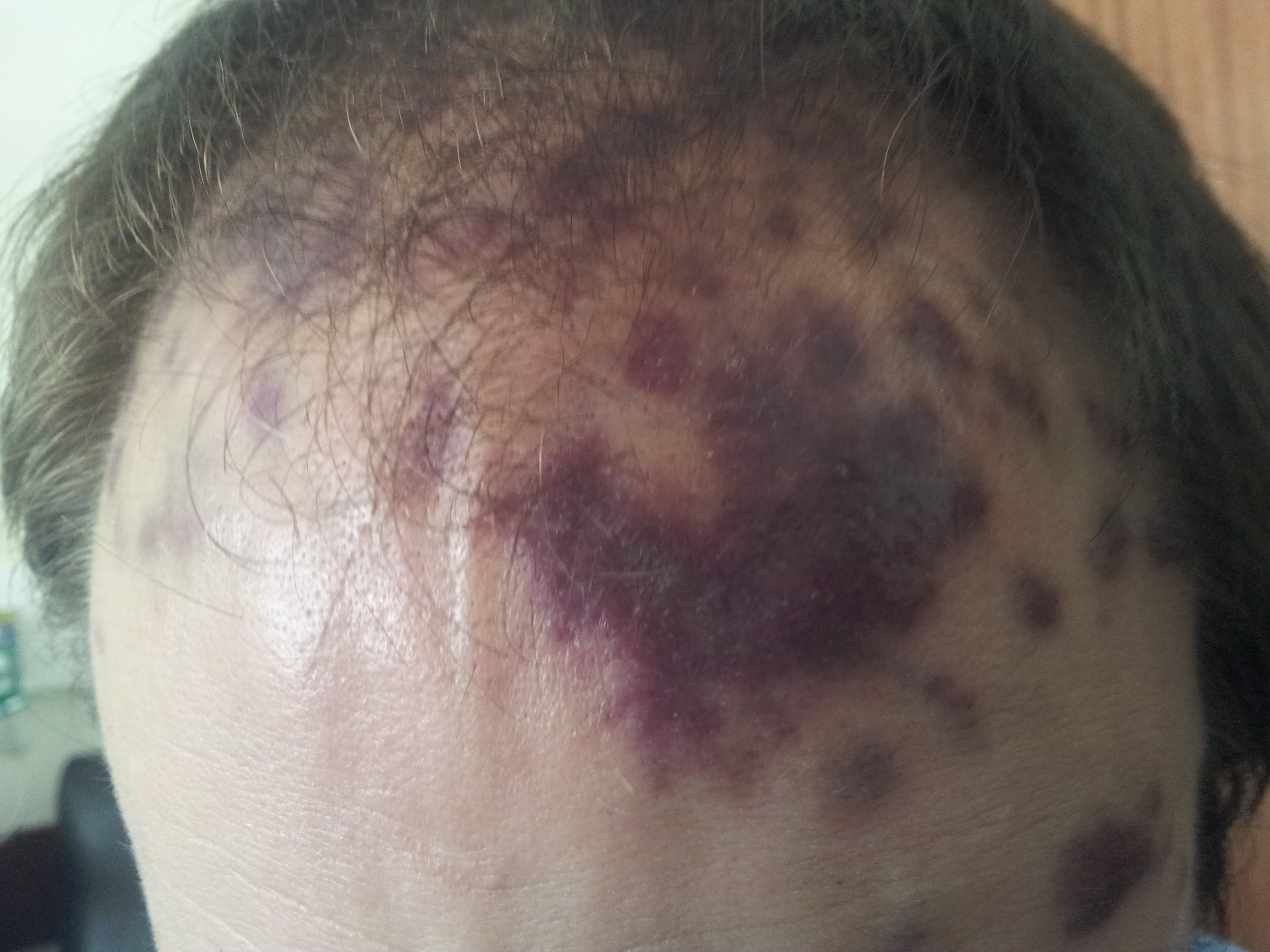
Lesões de sarcoma de kaposi no couro cabeludo.
Figura II
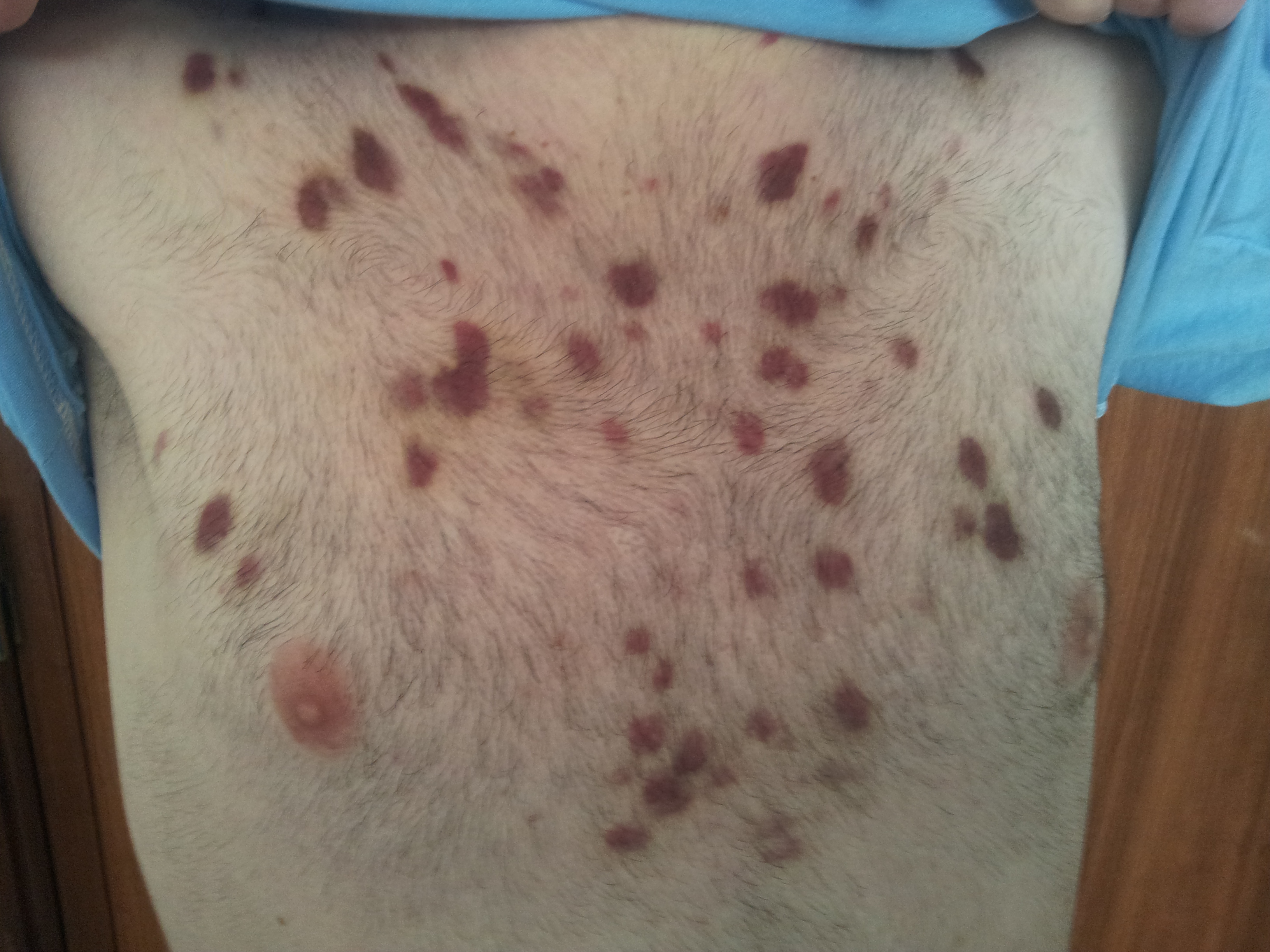
Lesões de sarcoma de kaposi no tronco.
Figura III
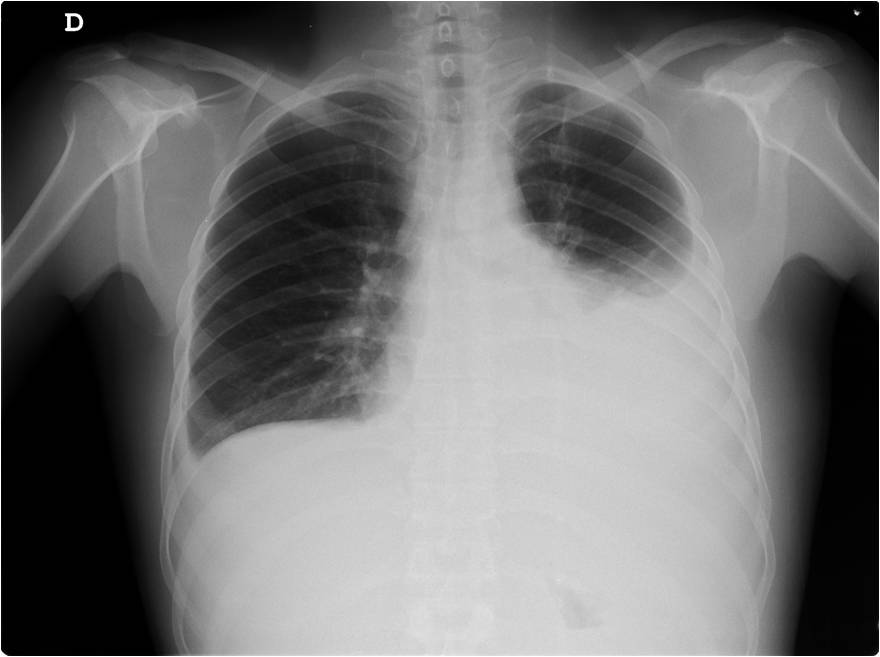
RX tórax com derrame pleural esquerdo.
Figura IV
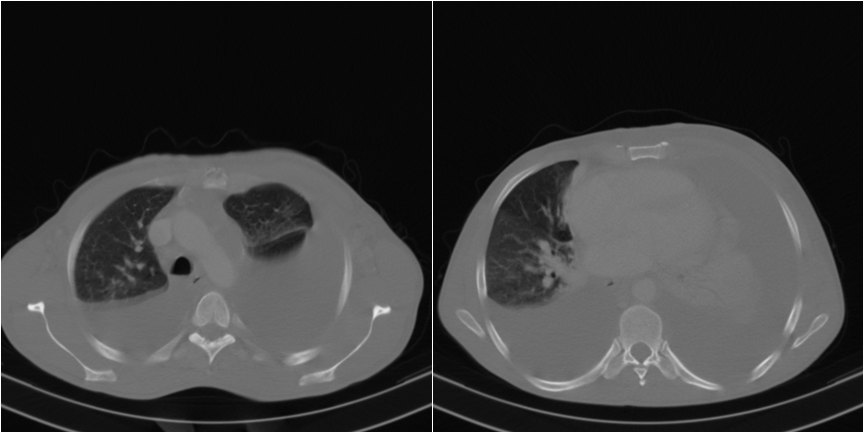
TAC toraco-abdomino-pélvico com volumoso derrame pleural bilateral, mais marcado à esquerda.
Figura V
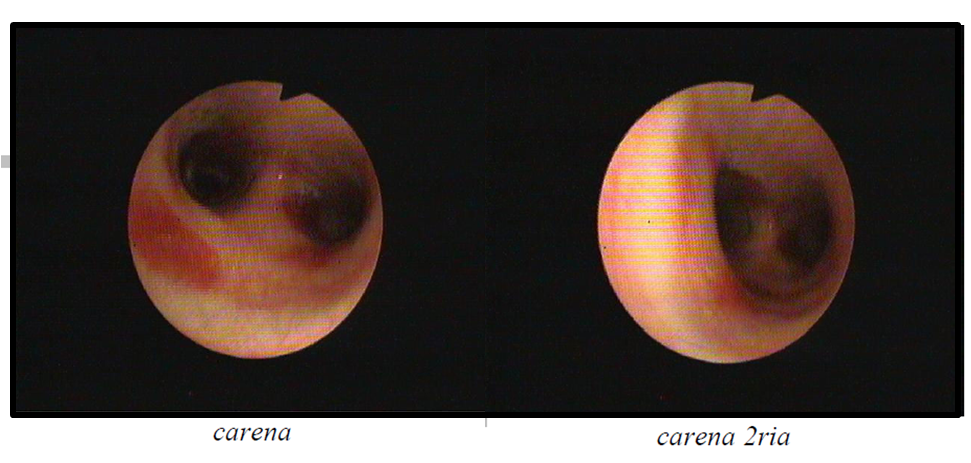
Broncofibroscopia com áreas eritmatosas sugestivas de sarcoma de kaposi.
Figura VI
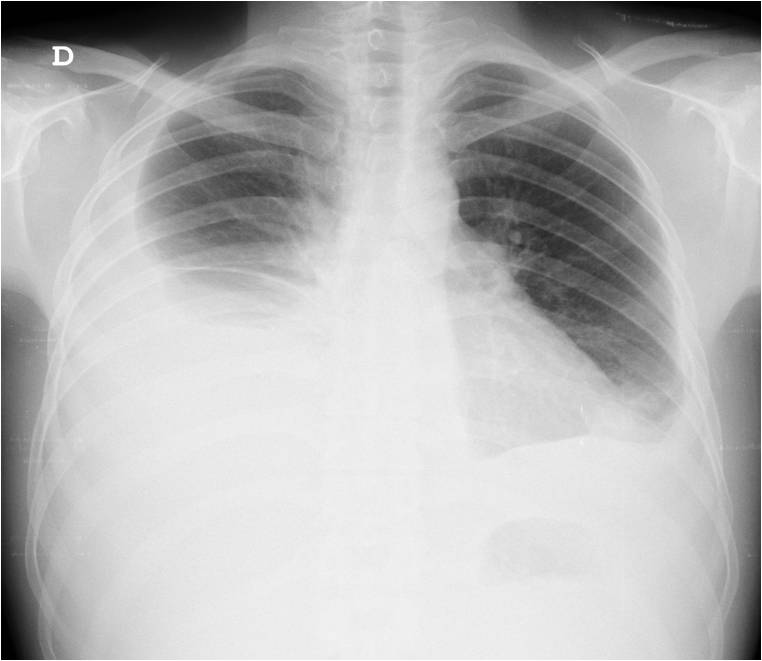
RX tórax com derrame pleural direito.
BIBLIOGRAFIA
1- Caldeira L. Neoplasias associadas à sida. In: Antunes F, editor. Manual sobre SIDA. 4ª ed. Lisboa: Bristol-Myers Squibb; 2011. p.194-200.
2- Levine AM. AIDS-related malignancies. Curr Opin Oncol 1994; 6:489.
3- Rabkin CS. Epidemiology of AIDS-related malignancies. Curr Opin Oncol 1994; 6:492.
4- Simonelli C, Spina M, Cinelli R, et al. Clinical features and outcome of primary effusion lymphoma in HIV-infected patients: a single-institution study. J Clin Oncol 2003; 21:3948.
5- Antman K, Chang Y. Kaposi´s sarcoma. N Engl J Med 2000; 342:1027.
6- Wies E, Mori Y, Hahn A, et al. The viral interferon-regulatory factor-3 is requiered for the survival of KSHV-infected primary effusion lymphoma cells. Blood 2008; 111:320.
7- Nador RG, Cesarman E, Chadburn A, et al. Primary effusion lymphoma: a distinct clinicopathologic entity associated with the Kaposi’s sarcoma-associated herpes vírus. Blood 1996; 88:645.
8- Komanduri KV, Luce JA, McGrath MS, et al. The natural history and molecular heterogeneity of HIV-associated primary malignant lymphomatous effusions. J Acquir Immune Defic Syndr Hum Retrovirol 1996; 13:215.
9- Cassoni A, Ali U, Cave J, et al. Remission after radiotherapy for a patient with chemotherapy-refractory HIV-associated primary effusion lymphoma. J Clin Oncol 2008; 26:5297.







