Introdução:
A calcificação heterotópica (CH) caracteriza-se pela deposição de osso lamelar nos tecido moles peri-articulares. Ocorre mais frequentemente em doentes com lesões traumáticas cerebrais ou da coluna vertebral e em doentes submetidos a cirurgias articulares [1]. A ocorrência de calcificação em doentes com sedação prolongada e bloqueio do eixo neuromuscular é uma situação rara [2]. Não existe relação conhecida entre o tipo de fármacos utilizados na sedação ou no bloqueio neuro-muscular e o desenvolvimento da calcificação, parecendo haver um risco aditivo quando usados em combinação [3, 4]. Os mecanismos fisiopatológicos são mal conhecidos, tendo já sido identificados alguns factores de risco e desequilíbrios fisiológicos que podem contribuir para o aparecimento da doença como alterações locais do pH e da PaO2 [4]. O tratamento mais apropriado permanece também por definir [5]. O reconhecimento desta entidade patológica é essencial no contexto da Medicina Interna quer pelo diagnóstico diferencial com patologias frequentes na fase de recuperação dos doentes críticos (como a neuropatia do doente crítico), quer pela morbilidade que confere aos doentes a longo prazo. Apresentamos o caso clínico de um doente que desenvolveu calcificação peri-articular das articulações coxo-femorais após ventilação prolongada, sedação e curarização no contexto de choque séptico.
Caso Clínico:
Homem de 54 anos, com internamento de 46 dias em Unidade de Cuidados Intensivos (UCI) por pneumonia a Streptococcus pneumoniae, com Sindrome de Dificuldade Respiratória Aguda (ARDS) grave, com necessidade de suporte ventilatório mecânico com um total de 39 dias de ventilação mecânica e sedação, com necessidade de curarização com vecurónio durante 96h por desadaptação ventilatória. No período de curarização apresentou um nível de sedação de -4 a -5 na Richmond Agitation-Sedation Scale, com um grau -2 a -3 no restante período de ventilação. Evoluiu com choque séptico com disfunção cardiovascular com necessidade de Noradrenalina em dose máxima de 78mcg/min e Adrenalina em dose máxima de 10mcg/min; disfunção hematológica (trombocitopénia 48,000/uL) e disfunção renal (grau 3 na escala Acute Kidney Injury Network), com necessidade de hemodiafiltração (HDFVVC). Durante as sessões de HDFVVC foi utilizada anticoagulação com citrato de sódio. Apresentou hipofosfatémia com valor mínimo de 1,3mg/dL, tendo sido corrigida com fosfato monopotássico. Apresentou também hipocalcémia com valor mínimo de 7,1, corrigido com gluconato de cálcio.
Após resolução do quadro séptico foi transferido para a enfermaria de Medicina Interna. Durante a reabilitação no período pós-critico, objectivou-se paraparésia dos membros inferiores, sem alterações da sensibilidade superficial mas com diminuição da sensibilidade vibratória distal, com dor intensa à mobilização e à palpação das articulações coxo-femorais. Constatou-se também tremor distal de repouso dos membros superiores.
Laboratorialmente apresentava anemia inflamatória, ausência de alterações do metabolismo fosfo-cálcico e elevação isolada da fosfatase alcalina (tabela 1).
Pela persistência das queixas álgicas realizou radiografia da bacia, que revelou calcificações dos tecidos moles peri-articulares a nível das articulações coxo-femorais (imagem 1). Para estudo complementar realizou TC da coluna lombar e bacia que demonstraram calcificações dos dois terços inferiores do músculo glúteo médio bilateralmente, estendendo-se para o músculo obturador interno bilateralmente (imagem 2). Pelas alterações sensitivas foi realizada TC medular que não mostrou evidência de lesão compressiva. A electromiografia revelou diminuição marcada das amplitudes dos potenciais de ação motores dos nervos peroneais comuns, diminuição ligeira das amplitudes dos nervos surais e polifasia nos músculos tibiais anteriores, sendo estes achados compatíveis com polineuropatia do doente crítico.
Admitiu-se o diagnóstico de CH dos tecidos moles sequelar à ventilação e curarização prolongada e de neuropatia do doente critico. Foi medicado com naproxeno 500mg 3x/d, gabapentina 300mg 3x/d e fentanil transdérmico 50μg 3/3 dias para controlo da dor. Manteve programa de reabilitação física durante 18 dias no internamento, com reaquisição progressiva da força motora dos membros inferiores, realizando marcha com andarilho e com recuperação da sensibilidade vibratória distal à data de alta, subjacente à melhoria da polineuropatia inflamatória.
Nos 12 meses após o internamento houve reaquisição de autonomia para a marcha com canadiana, mantendo no entanto dor, com dependência de opióides. Após este periodo foi proposto para intervenção cirúrgica para remoção de fragmentos ósseos intra-articulares, admitidos como principal causa da dor, aguardando atualmente cirurgia.
Discussão:
As principais causas de CH podem ser classificadas como traumáticas (após fracturas de ossos longos, cirurgia articular ou queimaduras extensas) ou neurogénicas (em consequência de traumatismos cranianos ou medulares com compromisso neurológico). A ocorrência de CH foi descrita raramente em doentes com necessidade de ventilação prolongada e bloqueio neuromuscular [2].
A fisiopatologia subjacente ao processo de calcificação heterotópica é pouco conhecida, tendo sido estudada maioritariamente em doentes que desenvolveram este quadro após intervenções cirúrgicas, ou nas situações de CH neurogénica. Existem várias hipóteses que podem explicar o seu aparecimento em doentes com permanência prolongada nas UCI [3 – 5]. A sedação prolongada, principalmente quando associada a um bloqueio neuromuscular, parece induzir uma disfunção neurológica semelhante à que ocorre na sequência de lesões traumáticas do neuro-eixo. Por outro lado, a ventilação mecânica prolongada induz alterações locais de pressão arterial de oxigénio e pH, promovendo mecanismos inflamatórios que levam à formação de depósitos cálcicos nos tecidos moles [6, 14]. A existência deste estado pró-inflamatório induzido pela ventilação e agravado em casos de sépsis, induz o aumento de expressão da Bone Morphogenic Protein (BMP), e do Fibroblast Growth Factor (FGF). Estes promovem a diferenciação de fibroblastos em osteoclastos, com a deposição de osso imaturo nos planos inter-musculares [7].
As alterações da CH são distintas das alterações da calcificação metastática. Tipicamente o processo de CH começa com a deposição de osso imaturo de aspecto floculado que evolui para ossificação organizada, ao contrário da metastática [8]. A localização da ossificação é predominantemente peri-articular, não havendo envolvimento renal, cutâneo, vascular ou da córnea como ocorre na calcificação metastática [9]. Há também menor repercussão sobre o metabolismo fosfo-cálcico, sendo os valores de fosfato e cálcio séricos tipicamente normais, como ocorreu neste caso.
As manifestações iniciais de CH são edema no local de deposição óssea, com dor e diminuição da amplitude de movimentos articulares. As manifestações podem ser precedidas pelos sinais radiográficos, com identificação de focos de calcificação de aspeto flocular peri-articular e com edema dos tecidos moles, no entanto o grau de calcificação total só pode ser avaliado 6 a 18 meses depois, altura em que está completa a formação de osso trabeculado [8]. As manifestações da CH podem assemelhar-se às manifestações de outras patologias que surgem em contexto de imobilização prolongada. A presença de edema (por vezes assimétrico) e inflamação podem sugerir o diagnóstico de trombose venosa profunda, e esta pode aparecer como complicação da CH. O processo inflamatório inicial pode ser confundido com celulite, e a acumulação de líquido intra-articular secundária à inflamação, por vezes complicada pela formação de lamelas ósseas intra-articulares, pode sugerir um quadro de artrite ou osteomielite.
Nos raros casos que existem publicados desta complicação, existe uma relação com períodos longos de ventilação mecânica, com duração superior a 30 dias [1-4]. Os locais preferênciais para a ocorrência de calcificação nos casos publicados foram a articulação coxo-femoral, em particular na zona peri-acetabular, seguida da articulação do joelho. Essa mesma distribuição ocorreu no nosso caso. A principal sintomatologia descrita foi de dor e limitação da amplitude de movimentos, e a alteração laboratorial mais consistentemente presente foi um aumento isolado da fosfatase alcalina. O tempo de evolução até à reaquisição de autonomia foi variável (entre 2 a 24 meses), mas o tempo até à intervenção cirúrgica foi consistentemente superior a 11 meses nos casos descritos.
No caso que apresentamos, as queixas álgicas eram acompanhadas de um quadro neuropático de predomínio dos membros inferiores, que não era explicado pela CH. A investigação realizada excluiu a existência de compromisso medular e o electromiograma confirmou a existência de uma polineuropatia do doente crítico, que recuperou após a reabilitação física.
O tratamento da CH é controverso e a sua eficácia foi estudada maioritariamente em doentes pós-cirúrgicos [10]. Os anti-inflamatórios não esteróides (AINEs), em particular a indometacina, diminuem a ossificação nas causas pós-operatórias, sendo o seu efeito menos claro nas situações neurogénicas [11]. Os bifosfonatos são usados com o intuito de diminuir a taxa de mineralização das calcificações, no entanto não foi comprovado que alterem significativamente a evolução [12]. A realização de um programa de fisioterapia individualizado parece diminuir o grau de calcificação final e permite conservar a amplitude dos movimentos articulares. A intervenção cirúrgica pode ser necessária para excisão de fragmentos ósseos ou correção de posições articulares anómalas. Nos casos de CH neurogénica é recomendado que a intervenção seja realizada após 18 meses, para assegurar a maturidade das calcificações e evitar a recorrência [13].
A utilização de ventilação mecânica e bloqueio neuromuscular é hoje prática corrente nas UCI. A CH é uma complicação que embora surja raramente nos doentes nas UCI, é importante ter em consideração como complicação, quer a nível de diagnóstico diferencial com patologias comuns neste período, quer a nível dos obstáculos que pode criar à recuperação, particularmente nas enfermarias de Medicina Interna, para onde os doentes são frequentemente transferidos no período pós-crítico.
Quadro I
Tabela 1 – Valores laboratoriais
| Parâmetro | Valor mínimo na UCI | Valor à admissão | Valor à data de alta | Valor de referência |
| | | | | |
| Hemoglobina | 8,6g/dL | 9,5g/dL | 11,3 g/dL | 13 – 18g/dL |
| Volume Globular Médio | - | 89,5 fL | 85,3 fL | 79 – 99 fL |
| Concentração de Hemoglobina Globular Média | - | 30,3 g/dL | 29,9 g/dL | 32 – 36 g/dL |
| Ferritina | - | 676 ng/mL | 483 ng/dL | 22 – 323 ng/dL |
| Ferro sérico | - | 44 μg/dL | 35 μg/dL | 65 – 175 μg/dL |
| Velocidade de sedimentação | - | 102 mm/h | 64 mm/h | < 13 mm/h |
| Cálcio (corrigido à hipoalbuminémia) | 7,1 mg/dL | 10,3 mg/dL | 8,8 mg/dL | 8,5 – 10,6 mg/dL |
| Fósforo | 1,7 mg/dL | 4,4 mg/dL | 4,7 mg/dL | 2,5 – 5,5 mg/dL |
| Hormona paratiroideia | - | 9,4 pg/dL | - | 10 – 65 pg/dL |
| 1,25 –hidroxivitamina D | - | 24 ng/dL | - | 5 – 75 ng/dL |
| Fosfatase Alcalina | - | 560 mg/dL | 273 mg/dL | 45 – 117 mg/dL |
Figura I
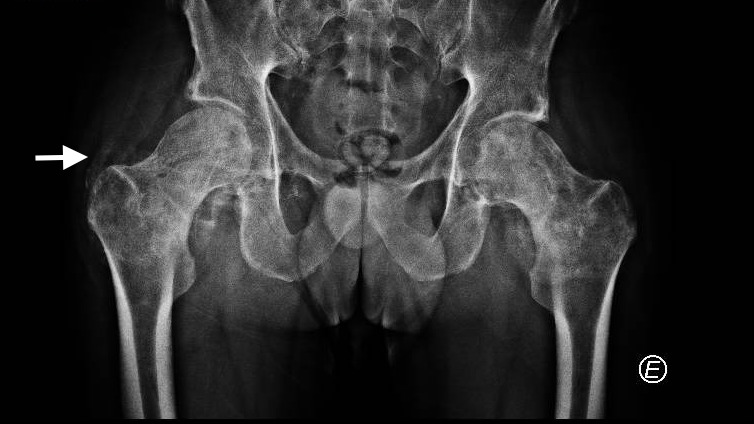
Imagem 1 – Radiografia da bacia com calcificação dos tecidos moles peri-trocantéricos (7º dia de internamento)
Figura II
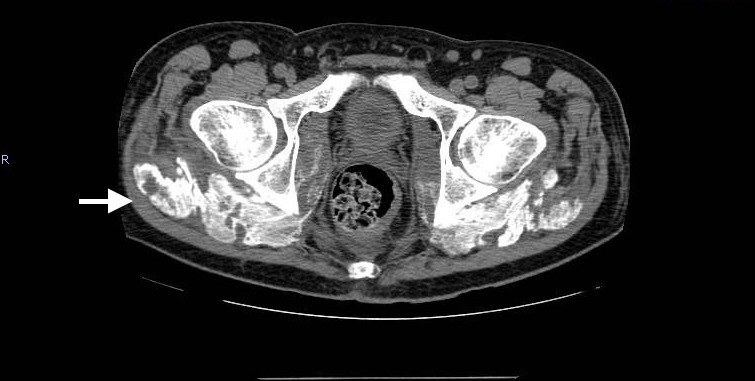
Imagem 2 – TC bacia - Calcificação peri-articular coxo-femoral bilateral (10º dia de internamento)
BIBLIOGRAFIA
Bibliografia:
1 - Sugita A., Hashimoto J., Maeda A., Kobayashi J., Hirao M., Masuhara K. et al - Heterotopic ossification in bilateral knee and hip joints after long-term sedation. J Bone Miner Metab.2005;23:329–332
2 - Dellestable F, Voltz C, Mariot J, Perrier JF, Gaucher A - Heterotopic ossification complicating long-term sedation.Br J Rheumatol.1996;5:700–701
3 - Clements N., Camili A. - Heterotopic ossification complicating critical illness . Chest.1993;104:1526–8.
4 - Lane J., Dean R., Foulkes G., Chandler P. -Idiopathic heterotopic ossification in the intensive care setting. Postgrad Med J.2002;78: 494-495
5 - Bossche LV., Vanderstraeten G. - Heterotopic ossification: a review.J Rehabil Med.2005;37:129–136
6 - Lotta S, Scelsi K, Scelsi R. - Microvascular changes in the lower extremities of paraplegics with heterotopic ossification.Spinal Cord.2001;39: 595-8
7 - Mahy PR. Urist M. - Experimental heterotopic bone formation induced by bone morphogenetic protein and recombinant human interleukin-1B.Clin Orthop.1988; 237: 236-44.
8 - Jensen L., Halar E., Little J., Brooke M. - Neurogenic heterotopic ossification. Am J Phys Med.988; 66:351-63
9 - Greenfield GB – Radiology of bone diseases. Philadelpia: SB Lippincott Co. 1990; 734-62
10 - Pape HC.,
Marsh S., Morley J. R., Krettek C., Giannoudis PV. – Current concepts on the development of heterotopic ossification.Bone Joint Surg [Br].2004;86-B:783-7
11 - Neal B, Rodgers A, Dunn L, Fransen M. - Non-steroidal anti-inflammatory drugs for preventing heterotopic bone formation after hip arthroplasty.Cochrane Database Sys Rev.2000:CD001160.
12 - Shehab D., Elgazzar A., Collier B. - Heterotopic ossification.J Nucl Med.2002; 43:346-53
13 - Garland DE, Hanscom DA, Keenan MA, Smith C, Moore T. - Resection of heterotopic ossification in the adult with head trauma. J Bone Joint Surg [Am].1985; 67-A:1261-9.
14 - Newman RJ, Stone MH, Mukherjee SK - Accelerated fracture union in association with severe head injury – Injury, 1987;18:241-6



