Introdução
O quilotórax caracteriza-se pela acumulação de linfa do ducto torácico ou “quilo” no espaço pleural.(1)
Diariamente cerca de 2 a 4L de quilo são transportados pelo sistema linfático. Em caso de lesão ou rotura do ducto torácico pode ocorrer derrame pleural de grande volume.(2) Habitualmente é unilateral e frequentemente à direita.(2,3)
O quilotórax é um tipo raro mas importante de derrame pleural.(3,4) É mais comum após trauma ou cirurgia torácica. No entanto, pode ser de etiologia não traumática. A obstrução do ducto torácico devida a neoplasia é a causa não traumática mais frequente, sendo o linfoma a neoplasia mais comum (70%).(2) Pode ainda ser secundário a insuficiência cardíaca ou surgir na sequência de cirrose hepática. Em 5 a 10% dos casos não se identifica a etiologia, sendo considerado idiopático.(3)
A apresentação clínica é variável. Os sintomas mais comuns são: dispneia, dor torácica e tosse (2). O diagnóstico é bioquímico, através do doseamento de triglicerídeos (TG) no líquido pleural (>110mg/dL) e da presença de quilomícrons. O líquido é habitualmente leitoso.(5)
O tratamento é fundamental, uma vez que é uma patologia potencialmente fatal, tendo em conta que uma perda de linfa prolongada causa estados de imunodepressão e desnutrição graves.(3,4)
Caso clínico 1
Homem de 82 anos, autónomo, com história prévia de neoplasia maligna da próstata, hipertensão arterial, dislipidemia e doença hepática crónica (DHC) de provável etiologia alcoólica (Child-Pugh A) com varizes esofágicas incipientes.
O doente recorreu ao Serviço de Urgência (SU) por quadro clínico caracterizado por dispneia com 2 semanas de evolução, associada a ortopneia, tosse e aumento do volume abdominal.
Não era conhecida história de cirurgia recente ou trauma, nem antecedentes pessoais de doença pulmonar ou cardíaca.
À admissão apresentava auscultação pulmonar com diminuição do murmúrio vesicular (MV) nos dois terços inferiores do hemitórax direito e diminuição da transmissão das vibrações vocais ipsilaterais. Sem outras alterações.
Apresentava hemoglobina (Hb) 14,8g/dL, VGM 99fL, sem leucocitose, sem alterações da fórmula leucocitária ou contagem plaquetar. A função renal, enzimas hepáticas e estudo da coagulação estavam dentro da normalidade. A VS e a proteína C reativa (PCR) eram negativas.
A radiografia torácica revelou hipotransparência à direita compatível com derrame pleural. Foi realizada toracocentese com drenagem de líquido branco, leitoso e doseamento de TG superior a 300mg/dL, o que confirmou o diagnóstico de quilotórax. O doseamento da ADA no líquido pleural foi normal e o exame bacteriológico foi negativo.
O estudo analítico não revelou alterações: esfregaço de sangue periférico com ligeira macrocitose, PSA total 1,42ng/mL e livre 0,12ng/mL, doseamentos alfa-fetoproteína, beta-2-microglobulina, ferro, ferritina e transferrina, peptídeo natriuréticotipo B e enzima conversora de angiotensina sem alterações; serologias víricas (HBV, HCV e HIV) não reativas; estudo imunológico negativo; sedimento urinário sem alterações.
A TC toraco-abdominal mostrou volumoso derrame pleural à direita, sem adenomegalias mediastínicas ou hilares; fígado com sinais de hepatopatia crónica, ectasia do tronco porta e ascite moderada. Posteriormente realizou-se ecodoppler da veia porta que excluiu trombose venosa.
O ecocardiograma não revelou alterações estruturais, mostrando boa função biventricular.
Foi realizada paracentese diagnóstica. O doseamento de TG foi de 84mg/dL. O líquido ascítico apresentava um gradiente sero-ascítico de albumina > 1,1, sugestivo de DHC.
Assim, foi efetuada biópsia hepática que confirmou hepatite crónica (Fig.1).
Foi ainda realizada cintigrafia linfática que não identificou locais de extravasamento de linfa, nem acumulação anómala do radiofármaco a nível da cavidade torácica.
Realizou-se biópsia pleural que mostrou discreto infiltrado inflamatório linfocitário.
Durante a investigação manteve-se dieta livre de TG com suplementação de TG de cadeia média. Apesar disso, o líquido pleural apresentava doseamentos > 110mg/dL de TG e mantinha drenagem superior a 1000cc por dia.
Uma das causas possíveis do quilotórax era a DHC. No entanto, sem resolução do mesmo sob terapêutica conservadora optou-se por uma avaliação conjunta com Cirurgia Cardio-Tóracica, decidiu-se instituir nutrição parentérica, sem melhoria, ao que se seguiu realização de talcagem. Por manter drenagem pleural superior a 1000cc/dia foi posteriormente realizada laqueação do ducto torácico. No pós-operatório imediato a drenagem pleural era de cerca de 2000cc por dia, a qual foi reduzindo progressivamente até se tornar residual. Nessa altura foi retirado dreno torácico (cerca de 3 semanas após a cirurgia), sem recidiva de derrame.
Atualmente, cerca de um ano após a cirurgia, o doente encontra-se assintomático, sem recidiva de derrame pleural (Fig.2) e sem ascite.
Caso Clínico 2
Mulher de 54 anos, sem patologia conhecida e sem medicação crónica, que recorre ao SU por tosse e dispneia com cerca de 2 semanas de evolução. À admissão apresentava adenomegalias palpáveis com >1cm a nível submandibular, laterocervical e supraclavicular. À auscultação pulmonar foi possível constatar diminuição do MV no terço inferior bilateralmente, com diminuição da transmissão das vibrações vocais.
O estudo analítico mostrou Hb 13,6g/dL; VGM 89fL; leucocitose (12400/uL); LDH elevada (250U/L) e PCR discretamente aumentada (3,79mg/dL).
A radiografia torácica (Fig.3) revelou apagamento bilateral dos seios costofrénicos, compatível com derrame pleural, mais volumoso à esquerda. Foi realizada toracocentese diagnóstica com saída de líquido leitoso e doseamento de TG >900mg/dL.
Posteriormente foi efetuado TC toraco-abdomino-pélvico que revelou derrame pleural bilateral, sem adenomegalias mediastínicas, mas observavam-se volumosas adenopatias a nível lombo-aórtico, da raíz do mesentério e região do tronco celíaco.
Foi realizada biópsia guiada por TC que confirmou o diagnóstico de linfoma folicular grau 1. A imunocitoquímica mostrou positividade para CD20, CD10 e bcl-2 e negatividade para CD3, CD5 e ciclina D1.
A doente foi orientada para o Serviço de Hematologia para tratamento. Até completar o segundo ciclo de quimioterapia (QT) foi necessário realizar toracocentese para alívio sintomático em duas ocasiões. O líquido pleural apresentava aspecto leitoso. Desde essa altura, mantém derrame pleural bilateral de pequeno volume, sem sintomatologia associada.
Atualmente a doente mantém seguimento na Hematologia, sob QT.
Discussão
O quilotórax representa apenas 3% de todos os derrames pleurais.(3,4) É mais frequente após trauma, seja este iatrogénico (80%) ou não-iatrogénico (20%). A cirurgia cardiotorácica é a maior causa de quilotórax traumático, particularmente a esofágica.(2)
Dentro das causas não-traumáticas, as neoplasias, nomeadamente o linfoma não-Hodgkin, é a mais comum, mas já foi descrita associação com neoplasias distintas.(2) Outras causas, mais raras, são a linfangiomiomatose, sarcoidose, tuberculose, trombose venosa, síndrome nefrótico, insuficiência cardíaca e cirrose hepática.(4)
A TC toraco-abdominal é essencial para excluir compressão extrínseca do ducto torácico por adenomegalias ou massas. Se o local de obstrução/extravasamento não for identificado na TC está indicada a realização de cintigrafia linfática ou linfangiografia,(3,6) como foi efetuado no caso 1. Neste caso, era importante excluir outras causas para além da DHC, uma vez que a biópsia hepática não mostrava fibrose importante. Após a investigação, não se pode excluir esta hipótese, apesar de o doente não ter tido ascite quilosa, nem ter ascite atualmente. Seja secundário a DHC ou idiopático, ambas etiologias raras e nem sempre fáceis de comprovar, o importante era conseguir tratar o doente e impedir a desnutrição causada pela perda constante de linfa.
O caso clínico 2, por outro lado, descreve a patologia mais comum associada a quilotórax não traumático, o linfoma.(2)
O tratamento conservador está indicado como primeira abordagem. Consiste em dieta com TG de cadeia média, que são absorvidos diretamente pelo sistema venoso portal de forma a diminuir o fluxo através do ducto torácico, diminuindo o extravasamento de linfa, permitindo, uma eventual cicatrização espontânea de uma pequena fuga; caso não resulte, a nutrição parentérica total está indicada para interromper o fluxo já referido.(2)
Há autores que defendem a utilização de octreótido ou somatostatina no tratamento do quilotórax, pela redução da produção intestinal de quilo.(2,7) No entanto, os estudos que há são experimentais e não há evidência que suporte a sua utilização de forma consistente.(5,7)
O tratamento cirúrgico está indicado se a drenagem pleural for superior a 1000cc/dia durante 5 dias; se houver extravasamento de linfa durante mais de 2 semanas; se a drenagem não se alterar durante 1 a 2 semanas (apesar da alteração da dieta) ou se se verificar deterioração clínica, desnutrição ou alterações metabólicas.(2,5)
No caso de a laqueação do ducto torácico não ser possível, pode-se tentar talcagem ou pleurodese.(5)
No caso clínico 1, uma vez que não se encontrou o local de extravasamento, foi decidido realizar talcagem, sem sucesso. Foi então realizada laqueação do ducto torácico, com resolução da patologia. Esta cirurgia tem uma taxa de sucesso de 95%.(5)
No caso clínico 2, no qual o quilotórax era secundário à obstrução do ducto torácico, está indicado o tratamento da causa subjacente, o linfoma.(5)
Estes casos representam duas etiologias diferentes de uma doença que é incomum, constituíndo um verdadeiro desafio para o internista. Esta patologia, apesar de rara, é causa importante de morbilidade e mortalidade pelas complicações associadas. O diagnóstico precoce e a tratamento adequado podem evitar complicações e melhorar o prognóstico e a qualidade de vida.
Figura I
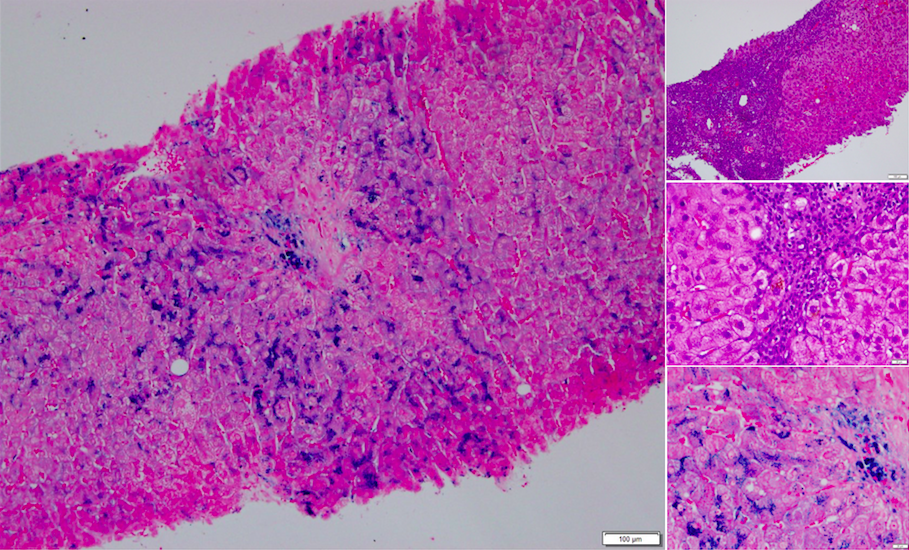
Biópsia hepática que mostra um fígado de arquitetura trabecular preservada, espaços porta com discreta fibrose e septos fibrosos finos, sem pontes. Observa-se ainda discreto infiltrado inflamatório.
Figura II
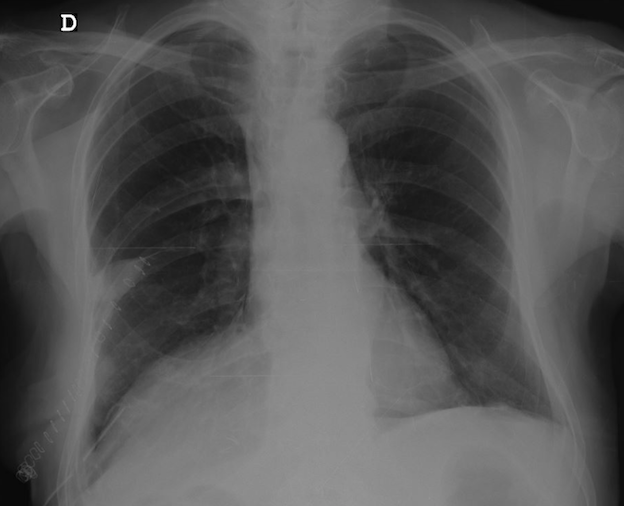
Radiografia torácica 1 ano após laqueação do ducto torácico. Sem evidência de derrame pleural.
Figura III
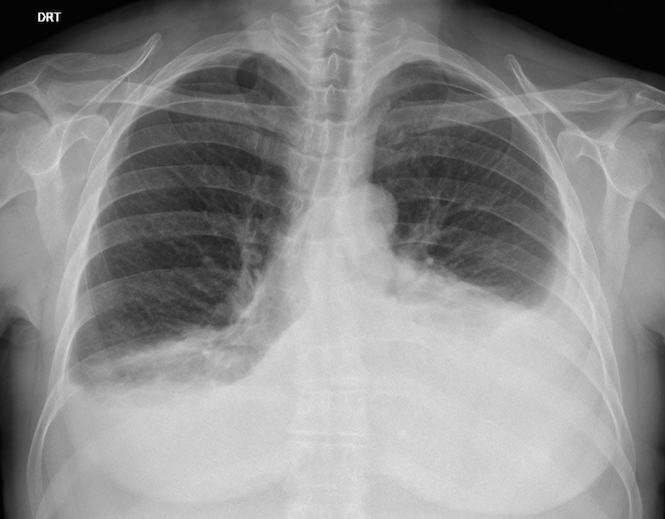
Radiografia torácica que revela hipotransparência bilateral, com apagamento dos seios costo frénicos, compatível com derrame pleural bilateral.
BIBLIOGRAFIA
(1) Fairfax AJ, McNabb WR, Spiro SG. Chylothorax:a reviewof 18 cases. Thorax. 1986;41:880-5.
(2) McGrath EE, Blades Z, Anderson PB. Chylothorax: Aetiology, diagnosis and therapeutic options. Respiratory Medicine. 2010;104:1-8.
(3) Desai N, Chaddha U, Desai S, Gable B. Idiopathic chylothorax in a young man. BMJ Case Reports. 2012; doi:10.1136/bcr-2012-007318.
(4) Torrejais JCM, Rau CB, Barros JA, Torrejais MM. Quilotóraxespontâneo associado a atividade física leve. J Bras Pneumol. 2006;32(6):599-602.
(5) Schild HH, Strassburg CP, Welz A, Kalff J. Treatment options in patients with chylothorax. DtschArztebl Int. 2013;110(48):819-26.
(6) Ohtsuka A, Inoue Y, Asano Y, Woodhams R, Shiomi K. Lymphoscintigraphy using dynamic imaging and SPECT/CT in Chylothorax. Open Journal of Medical Imaging. 2013;3:86-9.
(7) Togashi Y, Kim YH, Miyahara R, Irisa K, Sakamori Y, Masago K et al. Octreotide, a somatostatin analogue, in the treatment of chylothorax associated with idiopathic fibrosingmediastinitis. Tohoku J Exp Med. 2010;222:51-3.




