Introdução:
A Bartonella henselae é uma causa importante de doença tanto em imunocomprometidos como em imunocompetentes.1
O espectro de doenças causado por este microrganismo é muito variado podendo causar a doença da arranhadela do gato, angiomatose bacilar, peliose hepática, bacteriemia febril recidivante, endocardite e sépsis.1
Nos humanos a Bartonellahenselae está associada a peliose hepática.1 Esta é uma doença muito rara do fígado, que se caracteriza por proliferação vascular, resultando na formação de pequenos e múltiplos quistos sanguíneos no interior do parênquima que pode ou não ser de causa infeciosa.2,3
Geralmente afeta doentes imunodeprimidos, podendo associar-se a lesões cutâneas de angiomatose bacilar.3
A patogénese da PH permanece incerta, mas estudos revelaram que pode estar associada a causas farmacológicas (corticóides, contracetivos orais, tamoxifeno, metrotrexato, tiopurina, azatioprina e quelantes de ferro), autoimunes, infeciosas e neoplásicas (carcinoma hepatocelular, doença linfoproliferativa).2
Contudo o álcool também está descrito como podendo potenciar o aparecimento de PH por reduzir a glutationa, que tem um efeito protetor das células sinusoidais.2
Geralmente a infeção por Bartonella manifesta-se com quadro de febre, arrepios e hipersudorese após um período de incubação de poucos dias a meses. Pode ainda estar associada a artralgias, hiperemia conjuntival, náuseas, vómitos, dor abdominal, cefaleias ou tonturas. Em alguns casos a febre pode ser crónica com astenia marcada associada.1,3
Caso clínico:
Doente sexo masculino, 77 anos, autónomo, com antecedentes de hipertensão arterial (HTA), dislipidemia, insuficiência venosa periférica e hábitos alcoólicos ligeiros (20g/dia). Medicado habitualmente com losartan e hidroclorotiazida 50mg/12,5mg 1 comprimido ao pequeno-almoço; lorazepam 1mg 1 comprimido ao deitar e sinvastatina 20 mg 1 comprimido ao jantar.
Recorreu ao serviço de urgência (SU) por quadro de febre vespertina (temperatura axilar máxima 39ºC) e hipersudorese com 3 semanas de evolução, associado a mialgias generalizadas, astenia e noção de perda de força nos membros inferiores. Referia ainda adenopatias cervicais e obstipação com cerca de 2 semanas de evolução.
Relativamente ao contexto epidemiológico, havia história de contacto com gatos no mês anterior. Negava anorexia ou perda de peso.
Ao exame objetivo, o doente estava consciente, orientado, com pele e mucosas descoradas, desidratado e com adenopatias cervicais de consistência elástica, dolorosas e móveis. A temperatura timpânica era de 37,7º C. Apresentava-se eupneico em ar ambiente com saturações periféricas de O2 de 99%, tensão arterial de 108/72 mmHg e frequência cardíaca de 80 batimentos por minuto, tempo de preenchimento capilar <2 segundos. À auscultação pulmonar e cardíaca: murmúrio vesicular mantido, sem ruídos adventícios. S1 e S2 rítmicos sem sopros. Abdómen mole e depressível, indolor à palpação, sem defesa e sem sinais de irritação peritoneal. Membros inferiores sem edemas. Sem rash cutâneo ou exantemas.
Dos exames complementares de diagnóstico é de realçar: anemia normocítica/normocrómica (Hb 11g/dL; Hematócrito 31%), leucocitose (13,01x103/µL), plaquetas de 394 x103/µL, creatinina 0,74 mg/dL, ureia 36 mg/dL, LHD 150 U/L, TGO 92 U/L; TGP 167 U/L (2x o límite superior do valor normal), bilirrubina total 1,73 mg/dL; bilirrubina directa 1,07 mg/dL, gama GT 643 U/L (10x o límite superior do valor normal), fosfatase alcalina 1059 U/L (8x o límite superior do valor normal), PCR de 32,38 mg/dL e VS de 120mms.
A prova de mantoux que foi negativa, bem como as hemoculturas para aeróbios, anaeróbios, micobactérias e exame micológico que foram negativas. Exame micobacteriológico do suco gástrico foi negativo.
As serologias para HIV 1 e 2, VHC, VHB, EBV, CMV, Leptospira, Bartonella e Rickettsia foram negativas. Serologia da Sífilis foi não reativa. Função tiroideia não apresentou alterações. No estudo autoimune verificou-se Fator Reumatoide negativo, ANA negativo, Anticorpos (Ac) anti mitocôndria negativo, ANCA negativo, Imunoglobulinas (Ig) G, M e A normais, C3 e C4 sem alterações, Antigénios hepáticos negativos e Ac anti dsDNA também negativo. Enzima Conversora da Angiotensina normal.
A eletroforese das proteínas não revelou alterações, β2 microglobulina normal, imunofixação das proteínas séricas e urinárias negativas, pesquisa de cadeias leves na urina também negativas. PSA e alfa-fetoproteína negativos.
Realizou ecocardiograma transtorácico que não revelou lesões sugestivas de endocardite.
Realizou ainda ecografia abdominal que mostrou fígado globoso mas de dimensões normais, contornos regulares e ecoestrutura sem alterações aparentes. Vias biliares intra e extra-hepáticas de normal calibre. Vesícula biliar de paredes finas, com algumas irregularidades milimétricas do contorno endoluminal, sugestivas de pólipos de colesterol. Próstata de textura heterogénea e dimensões aumentadas. Ausência de ascite.
A tomografia computorizada (TC) cérvico-toraco-abdomino-pélvico revelou pequenos gânglios linfáticos cervicais nas principais cadeias ganglionares reativos e pequenos gânglios supraclaviculares milimétricos. Referência ainda a imagem quística com 67mm por 43mm na região do mediastino anterior e superior relacionado com provável quisto pleuropericárdico. Derrame pleural vestigial e lâmina de líquido livre na escavação pélvica.
Realizou ainda TC-CE que mostrou sinais de leucoencefalopatia isquémica com alargamento generalizado das vias de circulação de líquido cefalorraquidiano, a refletir atrofia cortico-subcortical, com predomínio temporal.
A endoscopia digestiva alta (EDA) revelou gastropatia papulosa-erosiva e a biópsia gástrica mostrou uma mucosa do antro e corpo com gastrite crónica com atividade moderada, sem atrofia, identificando-se microrganismos tipo Helicobacter pylori. A Colonoscopia e a Tomografia por Emissão de Positrões (PET) não revelaram alterações.
Realizou ainda Colangio-Ressonância (RM) para melhor esclarecimento das alterações hepáticas que revelou “lesão no segmento VI, com cerca de 7mm, compatível com quisto biliar. Vesícula biliar distendida de parede aparentemente fina, embora com alguns pólipos, não excedendo os 5mm. Não foram observadas alterações imagiológicas no baço. No pâncreas observou-se uma milimétrica formação quística no processo unciforme rondando os 6 mm. Quistos parapiélicos bilateralmente, o maior à esquerda com 3 cm.
Por não se encontrar a causa para as alterações das enzimas de colestase hepática realizou biópsia hepática, que revelou parênquima com dilatação sinusoidal multifocal do tipo peliótico (imagem 1,2,3,4). O exame cultural foi negativo.
Durante o internamento, por ter sido diagnosticada uma gastrite crónica por Helicobacter pylori iniciou tratamento com Amoxicilina 1g 12/12h, Claritromicina 500mg de 12/12h e pantoprazol 40 mg 1 x dia durante 14 dias, tendo-se verificado uma melhoria clínica progressiva. O Doente ficou subfebril e houve uma descida da PCR de 30 para 11 mg/dL associada a redução ligeira da VS (de 120 para 108 mms).
Face à clínica arrastada de febre vespertina, hipersudorese, astenia, adenopatias cervicais, história de contacto com gatos 1 mês antes do internamento, alteração das enzimas hepáticas, melhoria clínica após tratamento com macrólido e perante o diagnóstico de peliose hepática na biópsia (com exclusão de outras causas de PH nomeadamente causas autoimunes, farmacológicas, neoplásicas ou linfoproliferativas) foi assumida PH no contexto de infeção por Bartonella apesar de a serologia ter sido negativa e de não se ter isolado Bartonella nas hemoculturas. Iniciou tratamento com doxiciclina 100 mg 1 comp 2x ao dia durante 4 meses com melhoria clínica progressiva, resolução das queixas e das alterações analíticas.
Discussão:
Esta é doença potencialmente fatal se não for tratada, daí a necessidade de um diagnóstico precoce e o início de tratamento adequado. Contudo a abordagem terapêutica varia consoante a doença associada à infeção por Bartonella.2
Relativamente ao diagnóstico, existem diferentes métodos de diagnóstico disponíveis nomeadamente exames culturais, testes serológicos e a determinação do DNA da Bartonella no tecido afetado.
No que diz respeito ao exame cultural da Bartonella, este é um exame complicado de se realizar na maioria dos laboratórios de patologia clínica, pelo facto de ser necessário um tempo de incubação prolongado (2 a 6 semanas) e de haver necessidade de se utilizar meios enriquecidos com CO2.1,4
Relativamente aos testes serológicos, a deteção de Ac contra a B. henselae tem baixa sensibilidade e foi demonstrado em alguns estudos que alguns doentes não têm uma resposta com Ac detetáveis.4
Por outro lado a deteção do DNA da Bartonella no tecido afetado tem alta especificidade, mas baixa sensibilidade, permitindo uma rápida identificação da bactéria.4,5,6,7
Como tal, não existe um método ´Gold standard´ para o diagnóstico das bartoneloses.8
O diagnóstico definitivo é muitas vezes difícil, e nos casos em que a confirmação microbiológica não se verifica, a suspeição clínica e os antecedentes epidemiológicos são fundamentais. Uma vez excluídas outras causas possíveis, está indicado o tratamento para aBartonella.3,9
Relativamente ao tratamento, a eritromicina é o antibiótico de eleição no tratamento da PH e da angiomatose bacilar. Contudo nos doentes em que a duração do tratamento foi inferior a 15 dias, verificou-se um aumento do risco de recidiva, pelo que o tratamento deve ser prolongado durante 3 a 4 meses.3
Em doentes com doença grave, a associação de doxiciclina com rifampicina foi efetiva, necessitando de realizar mais 3 meses de tratamento.3
Em doentes intolerantes ou que não responderam ao tratamento inicial, está recomendada a utilização da doxiciclina, que é um fármaco bem tolerado por longos períodos de tempo e muito eficaz no tratamento da PH.3
Conclusão:
A histopatologia é importante nos casos das infeções por Bartonella, havendo ainda pouco conhecimento sobre este tipo de infeções, porém é certo, que as bartoneloses são potencialmente fatais, o que justifica que maiores esforços sejam aplicados no desenvolvimento de testes diagnósticos mais rápidos, sensíveis e específicos para que seja feito o diagnóstico precoce e se inicie terapêutica dirigida.
Figura I
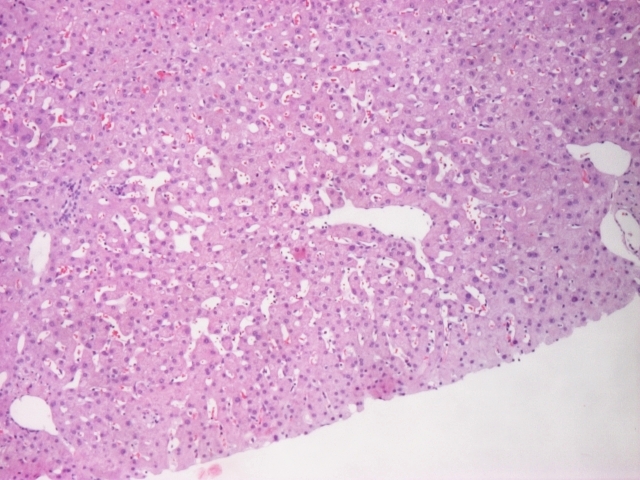
Hematoxilina e eosina: parênquima hepático com dilatação sinusoidal multifocal do tipo peliótico
Figura II
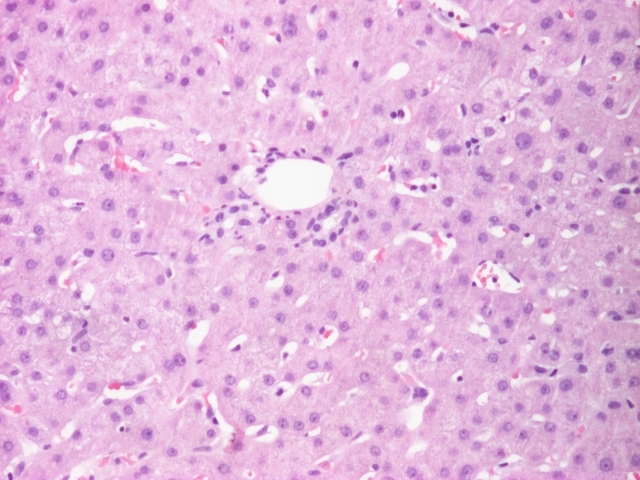
Hematoxilina e eosina: parênquima hepático com dilatação sinusoidal multifocal do tipo peliótico
Figura III
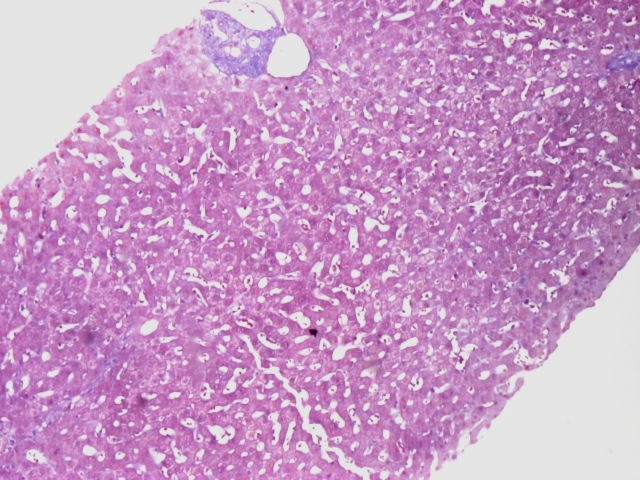
Imagem 3: coloração de tricrómio: parênquima hepático com dilatação sinusoidal multifocal do tipo peliótico
Figura IV
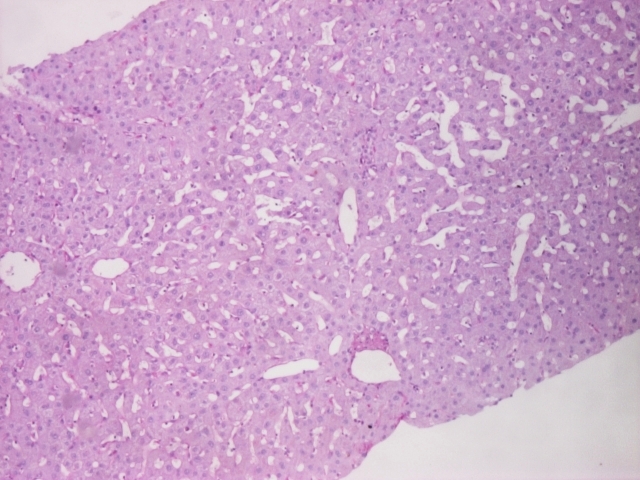
Imagem 4: coloração de PAS: parênquima hepático com dilatação sinusoidal multifocal do tipo peliótico
BIBLIOGRAFIA
Bibliografia:
1. Iralu J, Bai Y, Crook L, et al. Rodent-associated Bartonella febrile illness, Southwestern United States.Emerg Infect Dis. 2006. 12(7):1081-6
2. Crocetti D, Palmieri A, Pedullà G, Pasta V, D’Orazi V, Grazi G. Peliosis Hepatis: Personal experience and literature review. World J Gastroenterol. 2015. 21(46):13188-13194.
3. Pérez-Martinez L, Blanco J, Oteo J. Tratamiento de las infeciones por Bartonella spp. Ver esp quimioter. 2010. 23(3): 109-114.
4. Chondrogiannis K, Vezakis A, Derpapas M, Melemeni A, Fragulidis G. Seronegative cat-scratch disease diagnosed by PCR detection of Bartonella henselae DNA in lymph node samples. Braz J infect Dis. 2012. 16(1): 96-99
5. Velho PENF, Moraes AM, Uthida-Tanaka AM, Cintra ML, Gilioli R. Ultrastructural changes in a standard strain ofBartonella henselaeafter passages through BALB/cAn mice. Ultrastruct Pathol. 2002;26:161-9.
6. Velho PENF, Souza EM, Cintra ML, Moraes AM; Uthida-Tanaka AM. Diagnóstico da infecção por Bartonella spp.: a propósito de um caso de angiomatose bacilar. An. Bras. Dermatol. 2006; 81 (4): 349-353
7. Jensen WA, Fall MZ, Rooney J, Kordick DL, Breitschwerdt EB. Rapid identification and differentiation ofBartonellaspecies using a single-step PCR assay. J Clin Microbiol. 2000;38:1717-22.
8.Velho PENF. Estudo das bartoneloses humanas e daBartonellahenselae: infecção experimental, microbiologia e microscopia de luz e eletrônica de transmissão [dissertação]. Campinas (SP): Faculdade de Ciências Médicas da Universidade Estadual de Campinas; 2001.
9. Hansmann Y, DeMartino S, Piémont Y, Meyer N, Mariet P, Heller R, et al. Diagnosis of Cat scratch Disease with detection of Bartonella henselae by PCR: a study of Patients with Lymph Node Enlargement. J. Clin. Microbiol. 2005. 43(8): 3800-3806.





