. Introdução
A pericardite constritiva (PC) consiste num compromisso da função cardíaca diastólica causado por um pericárdio fibrótico, inflamado ou calcificado, geralmente espessado.1,2,3,4Pode ocorrer disfunção sistólica devido à fibrose e/ou atrofia do miocárdio.4
No ocidente, a principal causa é a idiopática, seguida pela cirurgia cardíaca, irradiação do mediastino e pericardite. As causas infeciosas, sobretudo a tuberculose, têm vindo a diminuir.1,2,3,5,6,7,8,9,10Esta última é a causa mais comum em áreas endémicas, devendo ser considerada em países em desenvolvimento e em imunocomprometidos.1,3,7,8,9Outras causas incluem doenças do tecido conjuntivo, neoplasias, trauma, fármacos, sarcoidose e pericardite urémica.8,9
Os sinais e sintomas devem-se à sobrecarga de fluídos (edema periférico, hepatomegália, ascite, derrame pleural) e/ou à redução do débito cardíaco (dispneia de esforço, fadiga, hipotensão).2,3,4,7,8,9Um gradiente sero-ascítico de albumina ≥1.1g/dL e um nível de proteínas no líquido ascítico (LA)>2.5g/dL sugerem PC.2,11,12O sinal de Kussmaul, o pulso paradoxal, o knockpericárdico e a elevação inexplicada da pressão venosa jugular, favorecem o diagnóstico.2,3,8,11
O eletrocardiograma (ECG) pode apresentar complexos QRS de baixa voltagem, anomalias da repolarização e, em estádios avançados, fibrilhação auricular.8
O diagnóstico baseia-se na demonstração da calcificação e/ou espessamento do pericárdio e da fisiologia constritiva.7
A calcificação pericárdica pode ser detetada, com baixa sensibilidade, em radiografia do tórax.7A tomografia axial computorizada (TAC) e a ressonância magnética nuclear (RMN) cardíacas detetam o espessamento e calcificação pericárdicos com elevada precisão.2,8
Sinais sugestivos no ecocardiograma modo M ou 2D incluem: espessamento pericárdico (melhor estimado via transesofágica), movimento anormal do septo interventricular (SIV), achatamento da parede posterior do ventrículo esquerdo (VE) durante a diástole, dilatação da veia cava inferior (VCI) e das veias hepáticas (VH).3,7,8O ecocardiograma com doppler (ED) distingue a PC da cardiomiopatia restritiva.4,7Devido ao pericárdio rígido, na inspiração a diminuição da pressão intratorácica não é transmitida às câmaras cardíacas esquerdas e a interacção entre o tamanho e função dos ventrículos (interdependência ventricular) é exacerbada.3,7,8Assim, na inspiração, o VE é subpreenchido, aumentando o enchimento do ventrículo direito (VD), com desvio esquerdo do SIV; na expiração, verifica-se enchimento diminuído do VD e aumentado do VE, com desvio direito do SIV.3,8O aumento proeminente da velocidade mitral E na expiração e a diminuição na inspiração, bem como o aumento do fluxo reverso diastólico nas VH na expiração, são típicos da PC.7
O cateterismo cardíaco égold standardpara o diagnóstico.2,7,9Devido à pressão venosa sistémica elevada, o enchimento ventricular diastólico é rápido inicialmente [descida y íngreme da pressão da aurícula direita (AD)], sendo depois amortecido pelo pericárdico rígido (dip e plateauou sinal da raiz quadrada da pressão ventricular diastólica).2,3,7,8,9No fim da diástole, as pressões nas 4 câmaras cardíacas são elevadas e equalizadas.2,3,7,8,9,12
A pericardiectomia é o tratamento da PC crónica4, devendo ser tão completa quanto possível.2,8,9Com constrição prolongada, poderá ocorrer fibrose e/ou atrofia do miocárdio, responsável por uma síndrome de baixo débito após a cirurgia e relacionada com maior morbi-mortalidade do procedimento.3,4Isto realça a importância do diagnóstico e tratamento precoces.
Caso Clínico
Doente do género masculino, 66 anos de idade, recorreu ao Serviço de Urgência (SU) por aumento do volume abdominal e edema dos membros inferiores (MI) com 4 meses de evolução. Referia dispneia para esforços moderados, obstipação e perda ponderal (12Kg em 3 meses). Tinha antecedentes de derrames pericárdicos com necessidade de pericardiocentese 11 e 4 meses antes. O líquido pericárdico era um exsudato, com predomínio de mononucleares e exame bacteriológico negativo. Tratava-se de um ex-fumador (30 unidades-maço-ano), com consumo etílico superior a 80 gramas/dia durante 2 anos, 20 anos antes. Dos antecedentes familiares, referir mãe, avós, tios falecidos de patologia oncológica não especificada e filho falecido com SIDA e tuberculose.
Objetivamente, apresentava tensão arterial de 104/75mmHg, auscultação cardíaca rítmica e sem sopros, auscultação pulmonar com fervores bibasais, abdómen globoso, com bordo do fígado palpável 3 cm abaixo do rebordo costal, timpanismo central e macicez dos flancos modificável com a rotação do doente, edema das pernas. Analiticamente, apresentava alteração dos tempos de coagulação, das provas hepáticas e PCR elevada (Tabela 1). A ecografia abdominal revelou volumoso derrame peritoneal, tendo sido realizada paracentese. O LA era um transudato, com albumina de 1,8g/dL (gradiente sero-ascítico de albumina de 1,5g/dL) e proteínas de 3,1g/dL, citologia negativa para células neoplásicas e predomínio de mononucleares.
Realizou TAC tóraco-abdómino-pélvica, que revelou derrame pleural bilateral, irregularidades pleurais, três imagens nodulares no lobo superior direito; fígado com hipertrofia relativa do lobo esquerdo, colocando-se a hipótese de hepatopatia crónica; volumosa ascite, área de irregularidade peritoneal.
A investigação diagnóstica foi orientada pelas possíveis causas de polisserosite (Tabela2).
Pela suspeita de cirrose, realizou-se biópsia hepática, que revelou colestase hepatocanalicular, sem outras alterações.
Colocou-se a hipótese de insuficiência cardíaca (IC). O ECG revelou ritmo sinusal e inversão da onda T de V3 a V6. Realizou ED que mostrou AD ligeiramente alargada, VE com ligeira redução da função sistólica global (FSG), movimento anómalo do SIV, insuficiência tricúspide ligeira.
Ponderou-se uma etiologia neoplásica. Realizou broncofibroscopia que não revelou alterações, com citologia do lavado broncoalveolar (LBA) negativa. A colonoscopia revelou micropólipos no reto e sigmóide e pólipo aos 25cm da margem anal, correspondendo a pólipos hiperplásicos de células caliciformes e adenoma tubular com displasia de baixo grau, respetivamente.
Para excluir uma causa infeciosa, realizou serologias, exame bacteriológico e pesquisa de BK no LA e no aspirado brônquico, bem como prova tuberculínica, que foram negativos. A ADA no LA era normal.
Apesar de o quadro clínico não ser sugestivo de síndrome nefrótica, mixedema, sarcoidose ou doença autoimune, realizou proteinúria das 24horas, provas da tiróide, enzima conversora da angiotensina (ECA), rácio de CD4/CD8 no LBA e autoanticorpos, que eram normais/negativos.
Ao longo de nove meses, o doente manteve ascite refratária, apesar do tratamento com diuréticos, com múltiplos internamentos no Serviço de Medicina. Apresentou agravamento progressivo do edema periférico, ingurgitamento jugular, hepatomegália e hipotensão, com necessidade de aminas vasopressoras.
Considerando o quadro clínico, o valor de proteínas no LA, as alterações detetadas no ECG e no ecocardiograma e os derrames pericárdicos prévios, colocou-se a hipótese de PC.
Pediu-se novo ED que revelou, além das alterações previamente descritas, pericárdio espessado. Realizou nova TAC torácica que revelou cardiomegália, refluxo da AD para a VCI, veias supra-hepáticas e veia renal direita; espessamento do pericárdio (3mm), sem calcificação (Fig. 1). Realizou cateterismo cardíaco, que foi compatível com PC. Foi submetido a pericardiectomia antefrénica, tendo o exame anátomo-patológico do pericárdio revelado uma pericardite crónica colagenizante. Após a cirurgia, ocorreu resolução da ascite, sem novas vindas ao SU por este motivo. Nove meses após a pericardiectomia, o doente mantinha clínica de insuficiência cardíaca, NYHA II. Realizou ED que revelou compromisso ligeiro da FSG e pericárdio posterior espessado. Mantém seguimento em consultas de Cardiologia e Medicina Interna.
Discussão
Perante um doente com derrame pericárdico, pleural e ascite, a investigação etiológica foi orientada pelas possíveis causas de polisserosite. Sendo o LA um transudato, colocaram-se inicialmente como hipóteses de diagnóstico, aquelas compatíveis com este tipo de líquido. Apesar da ausência de estigmas clínicos de cirrose, perante os antecedentes de consumo etílico, o quadro de ascite, alteração das provas hepáticas e alterações descritas na TAC, esta hipótese foi colocada. Porém, a biópsia hepática não confirmou o diagnóstico. A hipótese de IC foi sugerida pela dispneia de esforço, fervores bibasais à auscultação pulmonar e edema dos MI, e apoiada pelo ECG e ecocardiograma. Sendo o líquido pericárdico previamente drenado um exsudato, investigaram-se as hipóteses diagnósticas compatíveis com este tipo de líquido. Perante os antecedentes familiares, a perda ponderal, obstipação, imagens nodulares pulmonares e irregularidade peritoneal detetadas na TAC e a PCR aumentada, investigou-se uma possível neoplasia, que não foi confirmada. A PCR elevada sugeriu também uma causa infeciosa, sendo fundamental, considerando os antecedentes familiares, excluir tuberculose. Porém, as investigações orientadas neste sentido foram negativas. Atendendo à clínica e resultados dos exames realizados, a síndrome nefrótica, o mixedema e a patologia auto-imune foram excluídos. Atendendo à clínica, ECA negativa, ausência de granulomas na biópsia hepática e ao rácio CD4/CD8 no LBA, a sarcoidose foi considerada improvável.
A ascite recorrente, apesar do tratamento médico otimizado, com gradiente sero-ascítico de albumina ≥1,1g/dL e proteínas no LA>2,5g/dL, aliada ao agravamento progressivo do edema e da hipotensão, ao ingurgitamento jugular, antecedentes de derrames pericárdicos e às alterações descritas no ECG e no ED, levantou a suspeita de PC. Este diagnóstico foi apoiado pelo ED e TAC subsequentes e confirmado pelo cateterismo cardíaco.
Assim, parece provável que os derrames pericárdicos tenham levado a uma inflamação (possível causa da elevação da PCR) e espessamento progressivo do pericárdio (não visível no primeiro ED e TAC) e consequente PC. Porém, a investigação realizada, incluíndo o exame anátomo-patológico desta serosa, não permitiu esclarecer a etiologia da patologia pericárdica. O facto de a pericardiectomia ter sido parcial poderá ter contribuído para a persistência da sintomatologia de insuficiência cardíaca.
Em conclusão, um quadro de polisserosite implica uma extensa investigação etiológica, orientada pelo exame citoquímico dos líquidos. A PC é uma causa rara de ascite recorrente, sendo um elevado índice de suspeição essencial para o diagnóstico, sobretudo em doentes com valor elevado de proteínas no LA e distensão venosa jugular.
Figura I
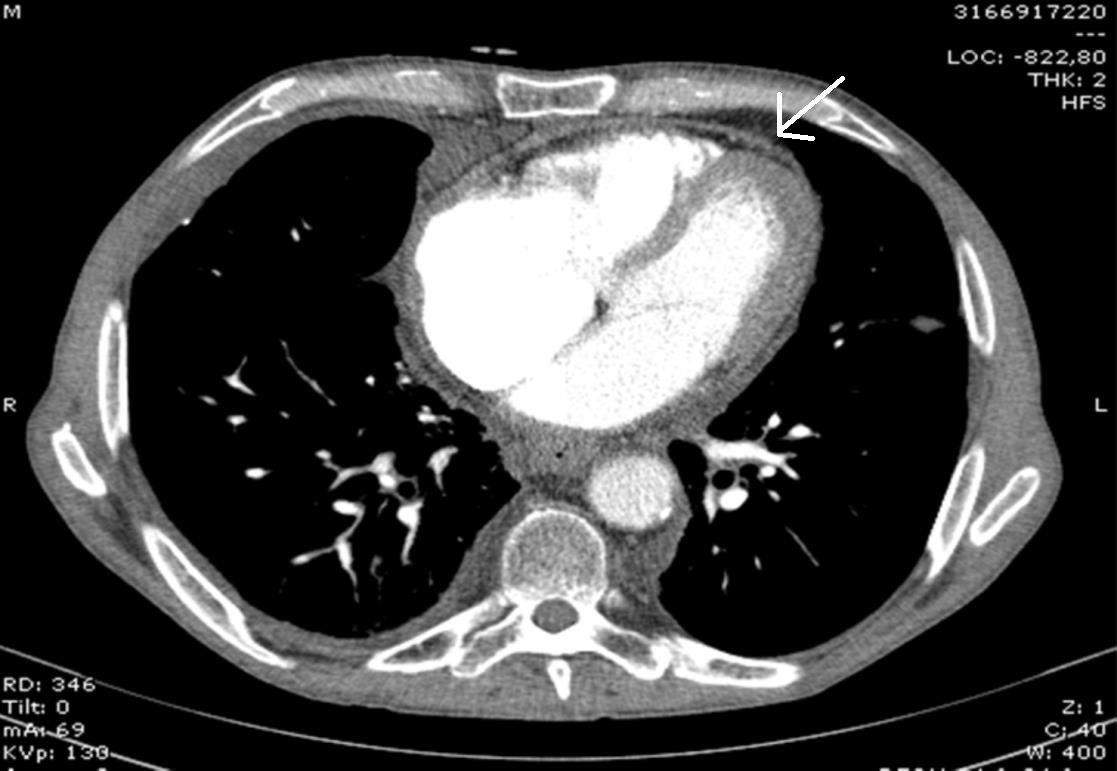
Figura 1. TAC torácica revelando espessamento pericárdico
Figura II
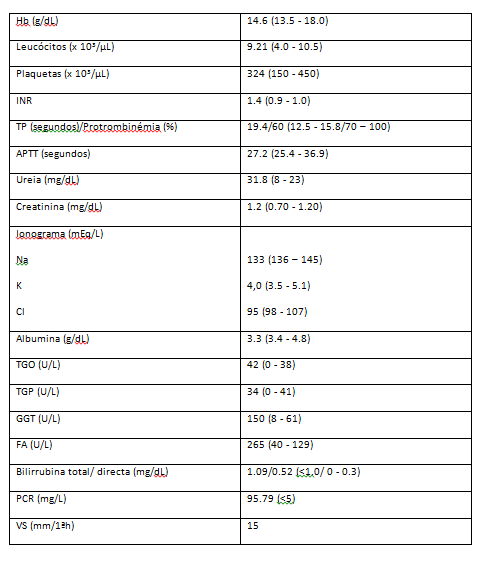
Tabela 1. Avaliação analítica inicial Legenda: APTT – tempo de tromboplastina parcial ativada; Cl - cloro; FA – fosfatase alcalina; GGT – gama glutamil transferase; INR – international normalized ratio; K - potássio; Na - sódio; PCR – proteína C reativa; TP – tempo de protrombina; VS – velocidade de sedimentação
Figura III

Tabela 2. Diagnóstico diferencial das possíveis causas de polisserosite Legenda: Ac – anticorpos; ADA – adenosina desaminase; ANA – anticorpo antinuclear; ANCA – anticorpo anti-citoplasma de neutrófilos; Ac Anti-DNA ds – anticorpo anti-DNA de dupla cadeia; BK – bacilo de Koch; CMV – citomegalovírus; ECA – enzima conversora da angiotensina; LBA – lavado broncoalveolar; PCC – peptídeos citrulinados cítricos; TSH – hormona estimulante da tiróide; T4L – tiroxina livre; T3L – triiodotironina livre; VDRL - Venereal Disease Research Laboratory; VHB – vírus da hepatite B; VHC – vírus da hepatite C; VIH – vírus da imunodeficiência humana.
BIBLIOGRAFIA
1.Chen RF, Lai CP. Clinical Characteristics and Treatment of Constrictive Pericarditis in Taiwan. Circ J. 2005; 69: 458 –460.
2.Doustkami H, Hooshyar A, Maleki N, Tavosi Z, Feizi I. Chronic Constrictive Pericarditis. Case Rep Cardiol. 2013;2013:957497. doi: 10.1155/2013/957497. Epub 2013 Sep 24.
3.Sengupta PP, Eleid MF, Khandheria BK. Constrictive Pericarditis. Circ J. 2008; 72(10):1555-1562.
4.Maisch B, Seferović PM, Ristić AD, Erbel R, Rienmüller R, Adler Y. Guidelines on the Diagnosis and Management of Pericardial Diseases; The Task Force on the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology. Eur Heart J. 2004; 25(7):587-610.
5.George TJ, Arnaoutakis GJ, Beaty CA, Kilic A, Baumgartner WA, Conte JV. Contemporary Etiologies, Risk Factors, and Outcomes after Pericardiectomy. Ann Thorac Surg. 2012; 94(2): 445–451.
6.Ghavidel AA, Gholampour M, Kyavar M, Mirmesdagh Y, Tabatabaie M-B. Constrictive Pericarditis Treated by Surgery. Tex Heart Inst J. 2012; 39(2):199-205.
7.Sohn DW. Constrictive Pericarditis as a Never Ending Story: What’s New?. Korean Circ J. 2012; 42(3):143-150.
8.Khandaker MH, Espinosa RE, Nishimura RA, Sinak LJ, Hayes SN, Melduni RM et al. Pericardial Disease: Diagnosis and Management. Mayo Clin Proc. 2010; 85(6):572-593.
9.Malkowska AM, Waring WS. Constrictive pericarditis is an easily overlooked cause of right heart failure: a case report. Cases J. 2008; 1(1):27.
10.Ling LH, Oh JK, Schaff HV, Danielson GK, Mahoney DW, Sewardet JB al. Constrictive pericarditis in the modern era: evolving clinical spectrum and impact on outcome after pericardiectomy. Circulation. 1999; 100(13):1380-1386.
11.George BA, Deprisco G, Trotter JF, Henry III AC, Stoler RC. Ascites with elevated protein content as the presenting sign of constrictive pericardial disease. Proc (Bayl Univ Med Cent). 2013; 26(2):168–170.
12.Alkaddour A, Vega KJ, Shujaat A. An Unusual Case of Cirrhosis. Case Rep Gastrointest Med. 2014;2014:670176. doi: 10.1155/2014/670176. Epub 2014 Feb 4.




