Introdução: A metastização cutânea é uma manifestação incomum de neoplasia. A incidência descrita aumentou drasticamente de 2,7% em 1969 para 4,5% em 1993 e para 10,4% actualmente1, 2 devido a vários factores: maior consciência para a sua existência, taxas crescentes de cancro e maior sobrevivência global que permite o seu desenvolvimento1. Representa 2% de todos os tumores cutâneos2. Em 20% dos casos surge como primeira manifestação clínica3.
A sua frequência relativa está relacionada com a frequência dos tumores primários em cada sexo. Nas mulheres, por ordem decrescente: mama, ovário, cavidade oral, pulmão e colo-rectal. Nos homens: pulmão, colo-rectal, cavidade oral, rim, mama, esófago, pâncreas, estômago e fígado.2 Comparada com outras neoplasias, a do pulmão é a que mais precocemente desenvolve metastização cutânea após o diagnóstico4, não sendo consensual a histologia com maior dermatotropismo5. Presentemente, investigam-se, com resultados promissores, as assinaturas génicas que modulam o organotropismo das metástases dos diferentes tumores primários6, 7.
A infiltração cutânea pode ocorrer por via hematogénea, via linfática, invasão contígua directa ou implantação iatrogénica, sendo que apenas as duas primeiras representam metastização à distância.3
O espectro clínico inclui nódulos, pápulas, placas, tumores e úlceras. O espectro histopatológico inclui 4 padrões morfológicos envolvendo a derme: nodular, infiltrativo, difuso e intravascular.2
Surge em fase avançada e está associada a mau prognóstico, com sobrevivência média de 3 a 10 meses na neoplasia do pulmão2, 7. Não existe evidência que o diagnóstico mais precoce da neoplasia primária através da metastização cutânea melhore o prognóstico, apesar de o indicarem alguns casos clínicos publicados1.
O tratamento dirigido a metástases cutâneas de tumores viscerais tem praticamente sempre objectivo paliativo, sendo as opções primárias excisão ou radioterapia.1 A resposta das lesões cutâneas, em tamanho e em número, pode permitir monitorizar a resposta do tumor à terapêutica sistémica em curso.1
Caso Clínico: Homem de 78 anos, fumador (30UMA) e com antecedentes pessoais de doença cerebrovascular (AVC isquémico 10 anos antes com discreta hemiparésia direita sequelar), fibrilhação auricular permanente e hipertensão essencial, recorreu ao Serviço de Urgência por aparecimento, nos últimos 3 meses, de 2 nódulos no tórax, com aumento progressivo do tamanho e de sinais inflamatórios. Concomitantemente apresentava astenia, adinamia, anorexia, dispneia de esforço e perda ponderal (10% da massa corporal), queixas pouco valorizadas pelo doente. Apresentava Performance Status ECOG 1 e Karnofsky scoring 70%.
À observação, 2 nódulos pétreos subcutâneos (3cm), para-esternais, violáceos, ulcerados, não aderentes aos planos profundos, dolorosos [Fig. 1]; e 2 nódulos semelhantes, mais pequenos e não ulcerados, palpáveis nas regiões inguinais. Sem adenopatias palpáveis, com murmúrio vesicular ligeiramente diminuído no campo pulmonar direito e fervores crepitantes bibasais, sem outras alterações relevantes ao exame objectivo.
Na radiografia de tórax, hipotransparência para-hilar direita, ovalada e com contornos irregulares, com cerca de 10cm de maior eixo [Fig. 2]. Tomografia computorizada tóraco-abdómino-pélvica evidenciou massa (8cm) no pulmão direito, para-hilar, obliterante no brônquio segmentar anterior do lobo superior, com compressão da artéria pulmonar e invasão da pleura mediastínica [Fig. 3 e Fig. 5], adenomegalias múltiplas, metastização supra-renal e massas subcutâneas na parede torácica anterior [Fig. 4 e Fig. 5], abdominal e região glútea.
A broncofibroscopia revelou obstrução completa do segmento posterior do brônquio lobar superior direito, coberto com mucosa hiperemiada e friável, e obstrução parcial do segmento interno do brônquio lobar médio, confirmando-se após biópsia carcinoma de pequenas células do pulmão. Citologia do lavado bronco-alveolar revelou-se negativa.
Analiticamente, elevação de LDH (889 U/L) e PCR (5,4 mg/dL), inespecífica e compatível com inflamação e lise celular, sem outras alterações relevantes.
As biópsias das lesões cutâneas apresentavam padrão misto (carcinoma de pequenas células e de grandes células neuroendócrino). NSE basal elevado (142µg/L), de acordo com o diagnóstico de neoplasia do pulmão em estadio avançado e indicador de mau prognóstico.
Considerou-se, então, carcinoma pulmonar de pequenas células estadio IV e iniciou quimioterapia com cisplatina e etoposido. Após 3 ciclos, que completou verificando-se apenas anemia grau 2 (CTCAE 4.03), houve resposta parcial (RECIST 1.1) e descida de marcador tumoral (NSE 29,1µg/L), mas com significativa deterioração do estado geral para Performance Status ECOG 3.
Quatro meses após o diagnóstico, viria a falecer por insuficiência respiratória hipoxémica grave no contexto de presumível tromboembolismo pulmonar.
Discussão: Apesar de raras e indicadoras de mau prognóstico, as metástases cutâneas devem ser conhecidas e valorizadas pelo clínico, na medida em que a sua investigação pode permitir o diagnóstico do tumor primário e/ou condicionar o estadiamento, tratamento e prognóstico de uma neoplasia previamente conhecida. Representam ademais uma potencial fonte de sofrimento físico e psicológico para o doente1.
Figura I
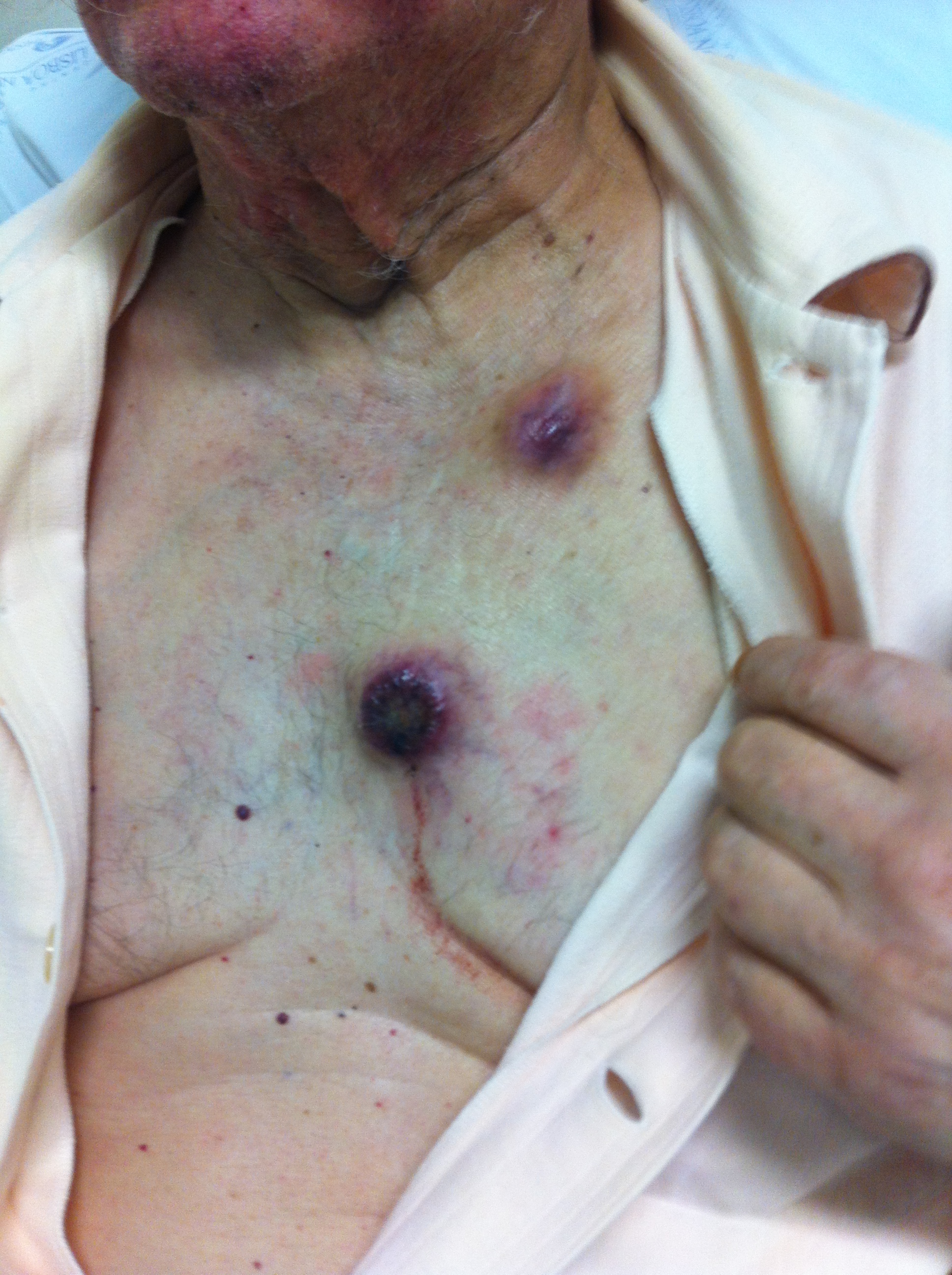
Metástases cutâneas de neoplasia do pulmão
Figura II
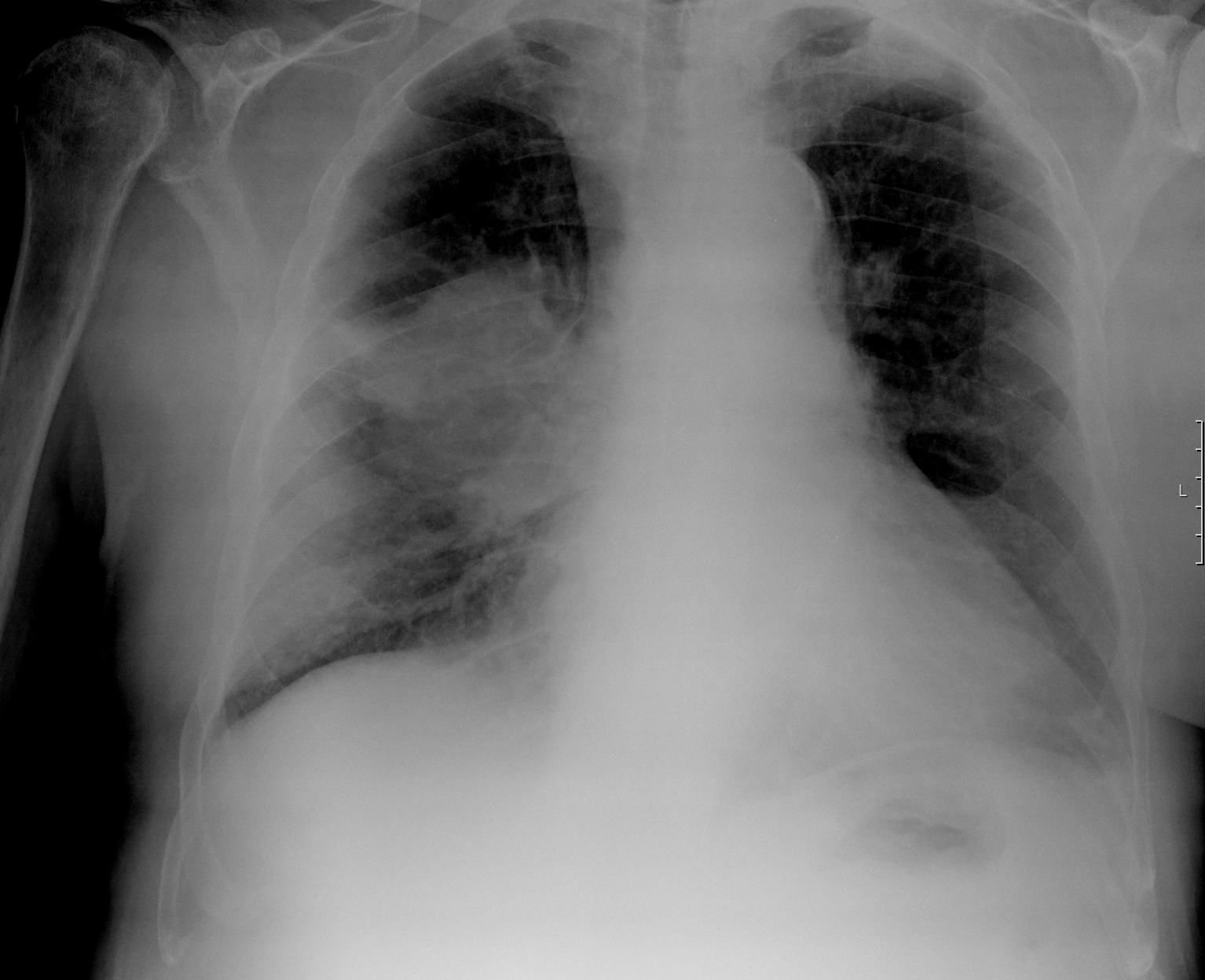
Radiografia do tórax com massa peri-brônquica direita
Figura III
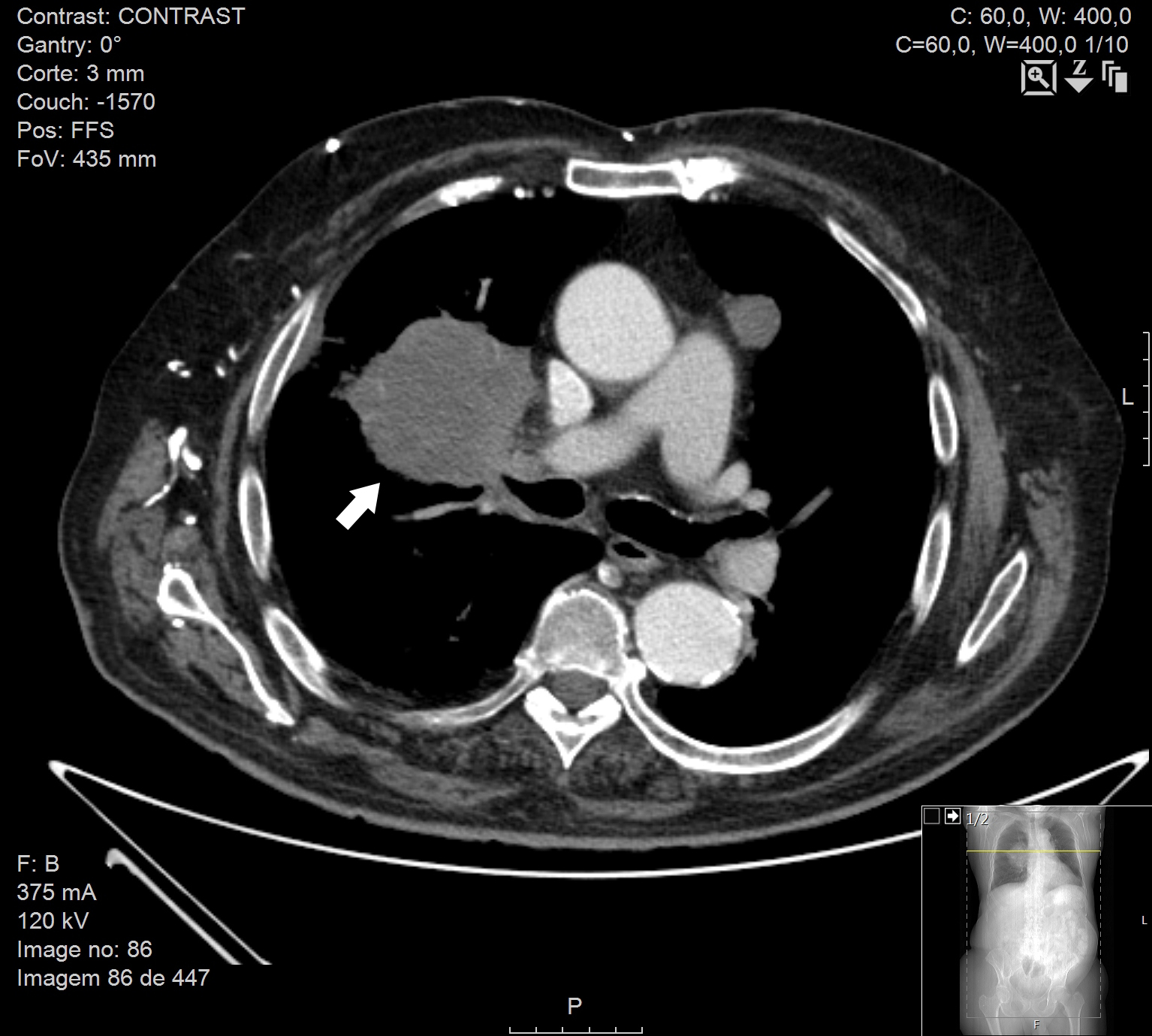
Tomografia computorizada com massa para-hilar direita (seta)
Figura IV
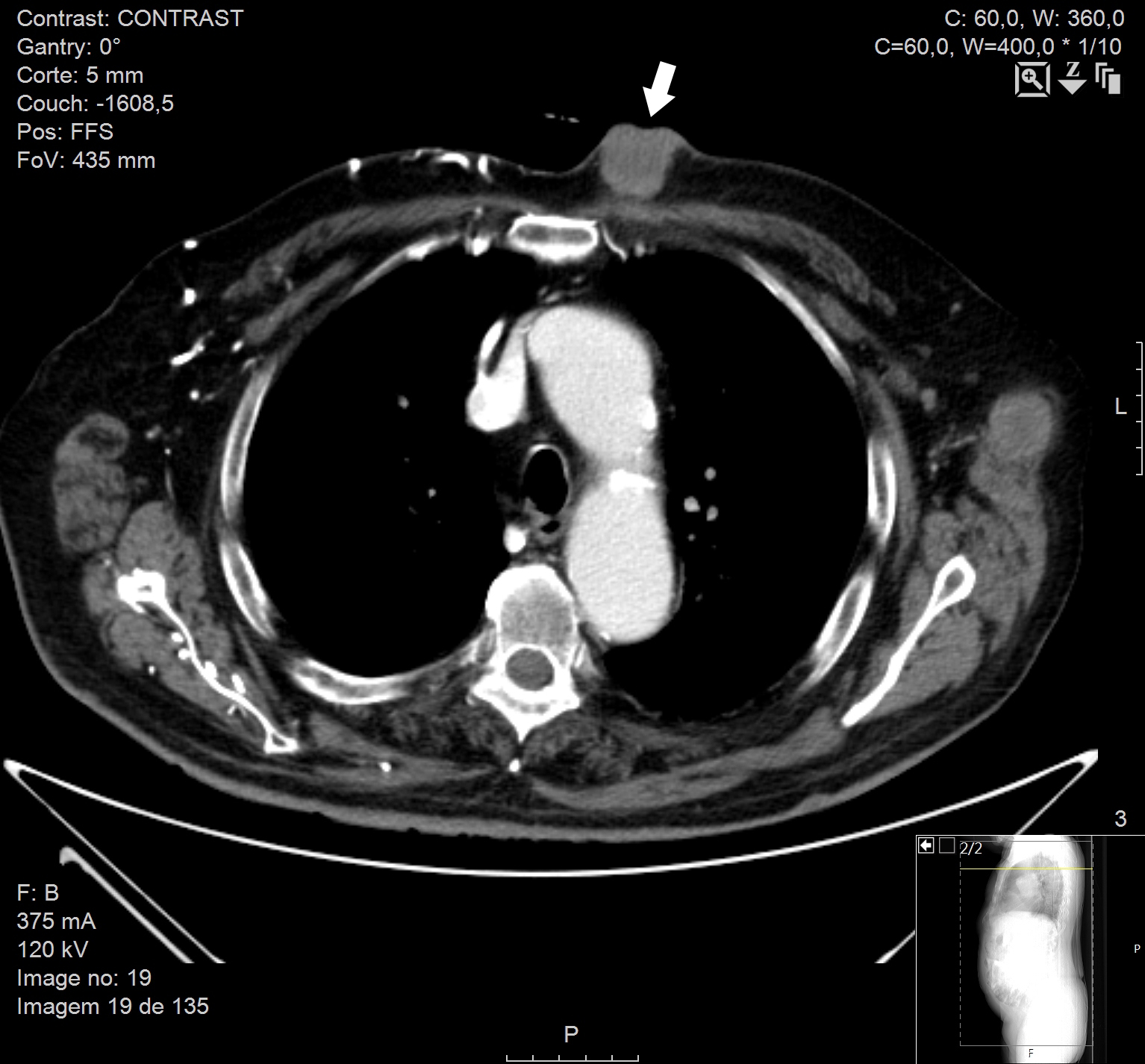
Tomografia computorizada com metástase cutânea (seta)
Figura V
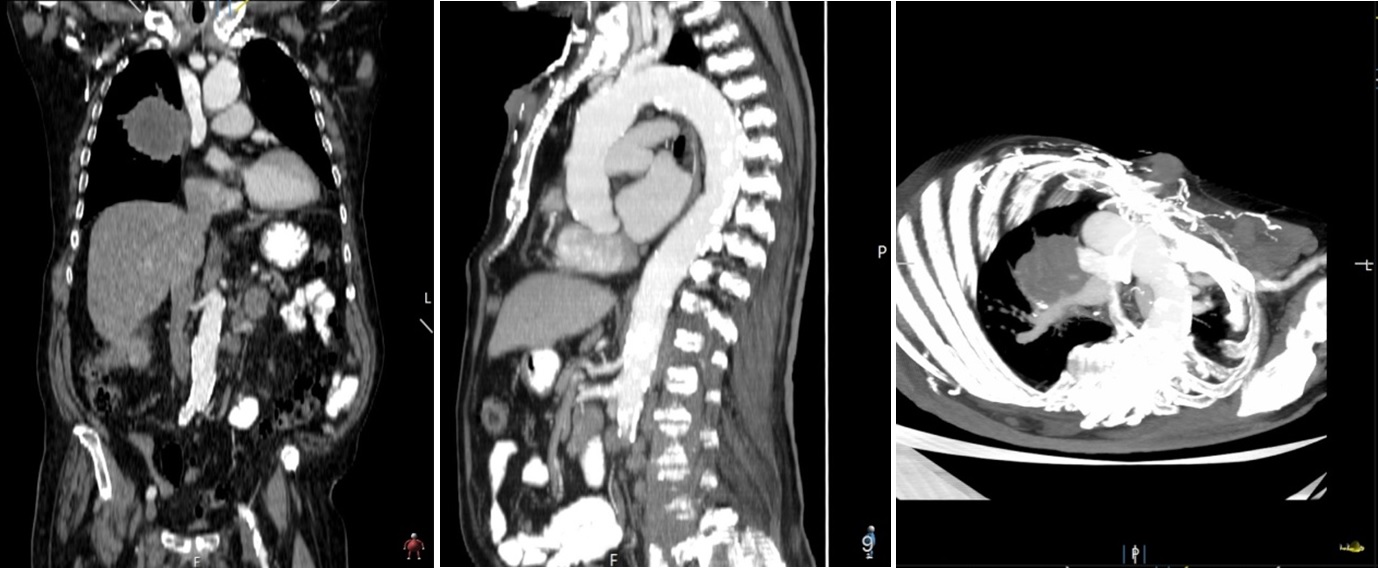
Tomografia computorizada com massa para-hilar direita e metástase cutânea
BIBLIOGRAFIA
Bibliografia:
1: Nashan D, Müller M, Braun-Falco M, Reichenberger S, Szeimies R, Bruckner-Tuderman L. Cutaneous metastases of visceral tumours: a review. Journal of Cancer Research and Clinical Oncology. 2008;135(1):1-14. s de mau prognóstico, as metástases cutâneas da neoplasia do pulmão devem ser conhecidas
2: Alcaraz I, Cerroni L, Rütten A, Kutzner H, Requena L. Cutaneous Metastases From Internal Malignancies. The American Journal of Dermatopathology. 2012;34(4):347-393.
3: Hu S, Chen G, Wu C, Chai C, Chen W, Lan C. Rates of cutaneous metastases from different internal malignancies: Experience from a Taiwanese medical center. Journal of the American Academy of Dermatology. 2009;60(3):379-387.
4: Marcoval J, Moreno A, Peyrí J. Cutaneous infiltration by cancer. Journal of the American Academy of Dermatology. 2007;57(4):577-580.
5: Pajaziti L, Hapçiu S, Dobruna S, Hoxha N, Kurshumliu F, Pajaziti A. Skin metastases from lung cancer: a case report. BMC Research Notes. 2015;8(1)
6: Kall SL, Koblinski JE. Genes That Mediate Metastasis Organotropism. In: Madame Curie Bioscience Database [Internet]. Austin (TX): Landes Bioscience; 2000-2013.
7: Wan L, Pantel K, Kang Y. Tumor metastasis: moving new biological insights into the clinic. Nature Medicine. 2013;19(11):1450-1464.






