INTRODUÇÃO:
A dermatomiosite (DM) é uma doença rara, com incidência anual de 5 a 10 casos por milhão de habitantes, predominando no sexo feminino. Apresenta pico de incidência bimodal, o primeiro entre os 7 e os 15 anos e o segundo, entre os 30 e os 50 anos. A DM paraneoplásica surge com maior frequência após os 50 anos.1
É uma doença inflamatória autoimune dos músculos e da pele, de etiologia desconhecida, que se caracteriza por fraqueza muscular proximal associada a exantema cutâneo típico. O diagnóstico definitivo de DM establece-se quando o exantema cutâneo está associado a pelo menos 3 dos 4 critérios de Bohan e Peter.1,2 Podem, ainda, estar presentes outras manifestações, em graus variáveis, nomeadamente sintomatologia sistémica (febre, mal-estar, emagrecimento), alterações músculo-esqueléticas (disfonia, artralgias), gastrointestinais como disfagia e má-absorção, alterações pulmonares como pneumonia de aspiração e doença intersticial pulmonar, alterações cardiovasculares, como miocardiopatia dilatada, arritmias auriculares e ventriculares, fenómeno de Raynaud, entre outras.1,2
Em indivíduos com mais de 50 anos, a DM constitui frequentemente uma síndrome paraneoplásica, sendo esta rara em doentes abaixo desta faixa etária. A associação entre miopatia inflamatória e neoplasia é conhecida desde 1916 com a publicação de 2 casos de polimiosite (PM) e neoplasia gástrica. Esta associação é mais forte para os doentes com DM em relação à PM. A evidência para esta associação baseia-se em: a) evidência epidemiológica após vários estudos populacionais; b) relação temporal entre o diagnóstico da miopatia e da neoplasia; c) a melhoria clinica da miopatia após tratamento da neoplasia; d) recaída ou desevolvimento de miopatia associada ao surgimento da neoplasia.1 Enquanto que nas mulheres, a neoplasia do ovário e mama são as mais frequentes, nos homens destacam-se as neoplasias da próstata e pulmão.3 A DM paraneoplásica apresenta pior prognóstico do que quando surge isoladamente. A neoplasia pode ser diagnosticada antes, durante ou após o diagnóstico da miopatia, sendo que atinge o pico de incidência no primeiro ano após o diagnóstico da DM e, decresce progressivamente até aos 5 anos. Existem factores de risco associados a um aumento do risco de malignidade, entre eles: a) evidência de lesão capilar na biópsia muscular; b) necrose cutânea; c) vasculite cutânea leucocitoclástica; d) idade avançada; e) disfagia.4,5,6 Alguns anticorpos também estão associados a um aumento do risco de malignidade, como são os anticorpos anti factor intermediário de transcripção (anti-TIF-1gamma) e anti proteína da matriz nuclear (NPX-2).7,8
A presença de mais de um factor de risco associado a malignidade (tabela 1) deve fazer-nos suspeitar de DM paraneoplásica, tornando-se obrigatório o rastreio de um eventual tumor até, pelo menos, 5 anos após o diagnóstico da miopatia, especialmente no primeiro ano e, sempre que ocorra recidiva da doença e/ou esta for refractária ao tratamento imunossupressor.7,9,10,11 O rastreio deve ser baseado na anamnese e exame objetivo, adequado à idade, género e incidência de neoplasia na população geral.
A terapêutica dirigida à neoplasia geralmente resulta na regressão clínica da dermatomiosite paraneoplásica.2
As complicações pulmonares, cardíacas e sistémicas são as causas mais frequentes de morte.1,2
CASO CLÍNICO:
Homem com 51 anos, operador de máquinas, casado e com 2 filhos. Apresenta vários factores de risco cardiovascular, nomeadamente HTA, diabetes mellitus tipo 2, sobrepeso, hiperuricémia e ex-fumador (10 UMA). Medicado no domicilio com metformina 850 mg 12/12h, telmisartan / hidroclortiazida 80 / 25 mg, nebivolol 5 mg e alopurinol 300 mg.
Recorre ao Serviço de Urgência do Hospital de Abrantes a 3 de Abril de 2016, por quadro caracterizado por edema inicialmente da mão direita e posteriormente dos membros inferiores e periorbitário sem predomínio horário, associado a mialgias generalizadas. À admissão apresentava-se em anasarca e na avaliação analítica inicial mostrou VS 80 mm/h, elevação de CK 12376 U/L (0-170 U/L), mioglobina 2230 ng/mL (0-85 ng/mL), TGO 364 U/L (10-37 U/L), TGP 103 U/L (10-37 U/L) e LDH 577 U/L (0-248 U/L). Perante este quadro foi colocada a hipótese de rabdomiólise secundária ao alopurinol, pelo que se internou o doente para se prosseguir o estudo.
Durante o internamento, inicia quadro de fraqueza muscular progressiva e generalizada mas de predomínio proximal, associada a lesões cutâneas (decote em V e lesão em xaile - figuras 1 e 2) e espessamento cutâneo nas palmas das mãos, pelo que nesta fase foi reequacionado o diagnóstico e admitida a possibilidade de dermatomiosite.
Perante o diagnóstico clínico tornou-se necessário rastrear a eventual associação com doença autoimune e/ou neoplasia. Do estudo autoimune destacava-se ANA positivo 1/320, padrão fino granular com alguns pontos nucleares, anti SSA / Ro52 positivo, com restante estudo imunológico sem alterações. Função tiroideia normal; serologias virais (VHB, VHC, VIH, HBV, CMV) negativas; VDRL negativo; HbA1c 7%; perfil lifpidico sem alterações. Realizou biópsia muscular com infiltrado inflamatório mononucleado perivascular e perifascicular, com degeneração e regeneração de fibras musculares e atrofia perifascicular.
Iniciou prednisolona na dose de 1 mg/Kg/dia (100 mg/dia) durante 10 dias, 3 dias de metilprednisolona 1 g/dia sempre com agravamento clínico e analítico, tendo posteriormente realizado 5 dias de imunoglobulina humana na dose de 0.4 g/Kg/dia. Diariamente cumpriu fisioterapia adequada ao grau de déficit de força muscular.
Paralelamente, fez-se estudo exaustivo na suspeita de DM como síndrome paraneoplásico. Realizou radiografia do tórax e ecocardiograma transtorácico que não revelaram alterações, TAC tórax alta resolução com presença de nódulo de 8 mm no lobo inferior direito (LID) mas sem características suspeitas, “a controlar”. Marcadores tumorais negativos (CEA, CA 15.3, CA 125, CA 19.9, alfa-fetoproteina, PSA, beta-HCG, beta-2-microglobulina, CYFRA 21.1 e NSE). Repetiu TAC toraco-abdomino-pélvico com contraste sem qualquer alteração.
Apesar da terapêutica dirigida houve progressiva perda de força muscular com necessidade de colar cervical para equilíbrio e conforto, alem de sialorreia, disfonia e disfagia para sólidos e líquidos, que motivaram entubação nasogastrica. Dada a refractariedade à terapêutica convencional e a possibilidade de utilização de fármacos off label, optou-se pela transferência para o Hospital de referência de Doenças Autoimunes (Hospital Curry Cabral). Neste hospital manteve padrão de miosite com CK 7763 U/L em perfil ascendente (0-170 U/L), mioglobina 11786 ng/mL (0-85 ng/mL), TGO 374 U/L (10-37 U/L), TGP 137 U/L (10-37 U/L) e LDH 674 U/L (0-248 U/L). Perante o estudo efectuado admitiu-se DM paraneoplasica em contexto de provável neoplasia do pulmão.
Mais especificamente colheu reavaliação analítica com estudo complementar e painel de miosites que revelou imunologia: ANA positivo 1/320, Anti-Ro52 +2, anti-NPX-2 +2. Realizou RMN de corpo com sinais de miopatia generalizada com características inflamatórias e sinais de atrofia muscular nos grupos afectados, com áreas de necrose / hematomas intra-musculares, sugerindo miopatia inflamatória com mionecrose importante associada. PET scan revelou doença inflamatória em actividade e ávida para fluorodesoxiglicose (FDG) na musculatura esquelética; provável processo infeccioso / inflamatório no LID; alterações morfológicas e metabólicas no lobo superior direito que poderiam ter a mesma etiologia contudo a hipótese de natureza maligna não podia ser excluída (figura 3).
Houve inicialmente melhoria do quadro de anasarca, com optimização da terapêutica diurética sempre sem alteração significativa da função renal, pelo que perdeu cerca de 6 Kg de peso e tendo tolerado levante para cadeirão com redução das secreções / sialorreia , ficando sem sonda nasogástrica mas sempre com necessidade de apoio na alimentação. Como intercorrência, destaca-se pneumonia nosocomial, com melhoria inicial sob piperacilina / tazobactam, mas por agravamento fez-se switch para meropenem, sem qualquer isolamento microbiológico. O doente entrou em PCR, tendo-se efetuado manobras SAV sem sucesso.
Procedeu-se a autópsia onde se destaca: “…derrame pleural bilateral (400ml à esquerda e 250ml à direita); … pulmão direito com congestão vascular nos lobos inferior e médio, identificando-se nódulo firme com aproximadamente 5mm no lobo inferior e áreas sugestivas de broncopneumonia …”. Foram colhidos fragmentos de vários órgãos, onde se salienta o diagnostico histológico de broncopneumonia no pulmão direito, sem qualquer tecido de neoplasia nos órgãos analisados.
DISCUSSÃO / CONCLUSÃO:
O diagnóstico de DM é feito com base nos 5 critérios de Bohan e Peter. Para um diagnóstico definitivo é necessária a presença de exantema cutâneo típico e 3 dos 4 critérios.
O caso apresentado é, sem dúvida, um caso de dermatomiosite. Apresenta exantema cutâneo típico (“decote em V” e “lesão em xaile”) associado a mais 3 critérios, fraqueza muscular proximal e simétrica, elevação das enzimas musculares séricas e evidência de inflamação crónica na biópsia muscular.
O tratamento é empírico e depende da gravidade da doença, sendo o objetivo principal alcançar a remissão. Com o tratamento pretende-se eliminar a inflamação, restaurar a performance muscular, prevenir o défice muscular crónico e prevenir o dano em órgãos atingidos. Tal como descrito na literatura e tendo em conta a ausência de sinais de gravidade ao início do internamento, começou-se terapêutica imunossupressora com prednisolona per os na dose de 1 mg/Kg/dia. Com o progressivo agravamento clínico, nomeadamente o surgimento de disfonia e disfagia, a literatura recomenda a realização de metilprednisolona 1 g/dia durante 3 dias e, em casos refractários, a realização de imunoglobulina humana na dose de 0.4 g/Kg/dia durante 5 dias, esquemas realizados neste caso clínico.12
A não resposta a estes esquemas deve fazer-nos suspeitar de associação a neoplasia, já que nestes casos não existe melhoria clínica sem controlo da neoplasia.
A associação com neoplasia é hoje universalmente aceite, variando entre 15 e 50% dos casos de DM, de acordo com diferentes autores. Nos homens a neoplasia pulmonar e da próstata são as mais frequentemente envolvidas, sobretudo a partir da quinta década de vida.11Dos 6 factores de risco associados a um aumento do risco de malignidade, o doente apresentava 5 (idade avançada, doença cutânea severa, resistência ao tratamento, ausência de doença intersticial pulmonar e anti-NPX-2), pelo que foi mandatório o despiste de neoplasia associada. No caso apresentado havia imagiologia sugestiva de neoplasia pulmonar (TAC tórax e PET scan) e teve-se em conta o facto de ser um ex-fumador. Apesar do estudo anatomopatológico não ter confirmado a presença de neoplasia pulmonar, esta poderia estar ainda num estadio inicial e vir posteriormente a confirmar-se. Por outro lado, clinicamente, este caso teve um comportamento do tipo paraneoplásico, pelo que os autores destacam a importância de um estudo exaustivo na procura da neoplasia em doentes com DM.
O doente veio a falecer por pneumonia nosocomial, provavelmente por aspiração, uma das complicações descritas nos casos mais severos.
Quadro I
Factores de risco associados ao aumento do risco de malignidade
| 1. Idade > 50 anos no momento do diagnóstico de DM; |
| 2. Doença cutânea severa (necrose cutânea e sinal do xaile); |
| 3. Resistência ao tratamento; |
| 4. História prévia de neoplasia; |
| 5. Ausência de doença intersticial pulmonar; |
| 6. Presença de anti-TIF-1gamma e anti-NPX-2. |
DM - dermatomiosite; anti-TIF-1gamma - anti factor intermediário de transcrição; anti-NPX-2 - anti proteína da matriz nuclear.
Figura I
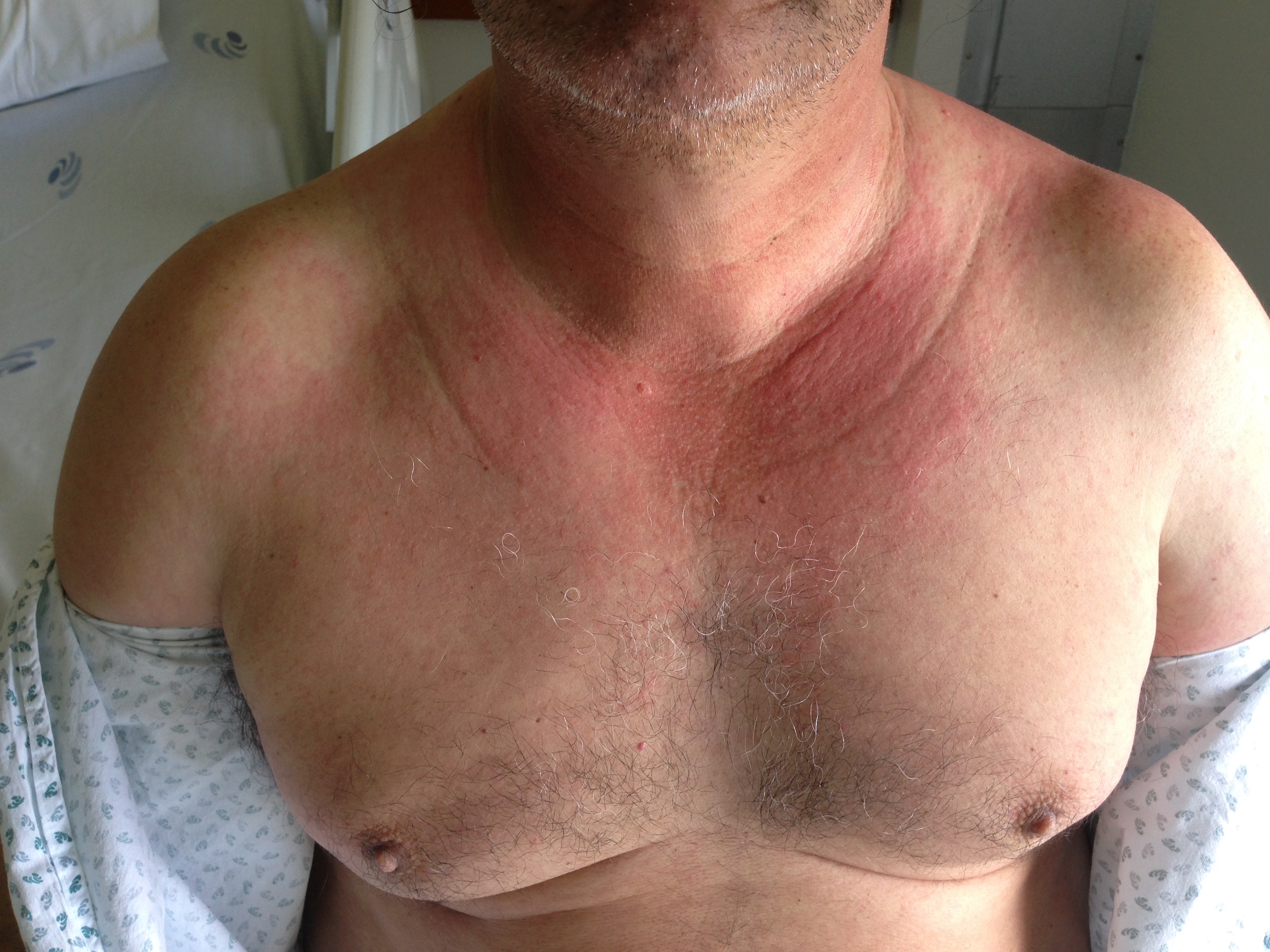
Lesão “Decote em V” - áreas confluentes de eritema veoláceo na região do pescoço, peito e ombros.
Figura II
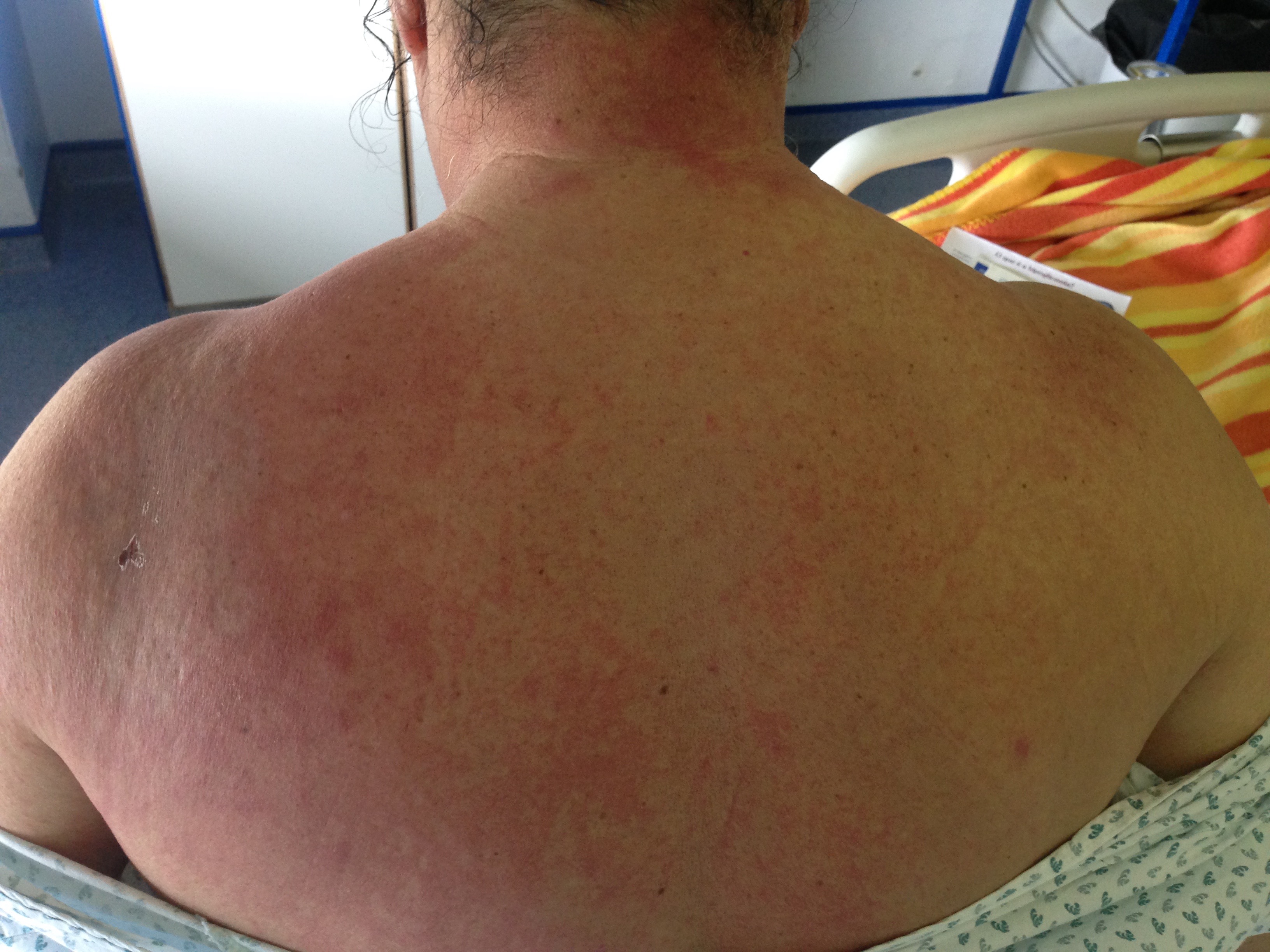
Sinal do “xaile” - erupção poiquilodermatosa na região do dorso.
Figura III
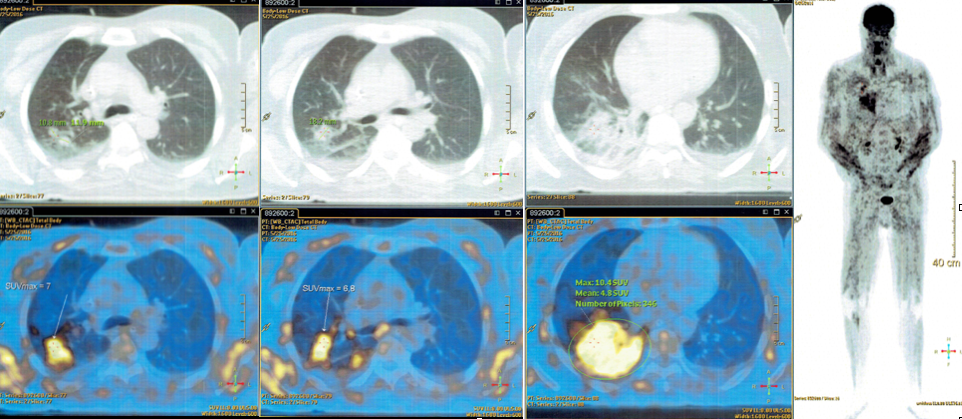
PET/CT com FDG (corpo inteiro) - doença inflamatória em atividade ávida para FDG na musculatura esquelética. Provável processo infeccioso / inflamatório no LID.
BIBLIOGRAFIA
BIBLIOGRAFIA
1. Miller F. Polymyositis and Dermatomyositis. Lee Goldman and Dennis Ausiello Cecil Textbook of Medicine, Vol. 2, 22a ed, Philadelphia, Pennsylvania, Saunders 2004; 283: 1680-84.
2. Marques S, Pacheco M, Baptista A, Freitas M, Malhado J. Dermatomiosite com enzimas musculares normais e envolvimento pulmonar. Medicina Interna 2003; 10 (4): 199-202.
3. Barnes BE, and Mawr B. Dermatomyositis and malignancy. A review of the literature. Ann Intern Med 1976; 84:68.
4. Urbano-Márquez A, Casademont J, Grau JM. Polymyositis/dermatomyositis: the current position. Ann Rheum Dis 1991; 50:191.
5. Hunger RE, Dürr C, Brand CU. Cutaneous leukocytoclastic vasculitis in dermatomyositis suggests malignancy. Dermatology 2001; 202:123.
6. Wang J, Guo G, Chen G, Wu B, Lu L, Bao L. Meta-analysis of the association of dermatomyositis and polymyositis with cancer. Br J Dermatol 2013; 169:838.
7. Targoff IN, Mamyrova G, Trieu EP, Perurena O, Koneru B, O´Hanlon TP, et al. A novel autoantibody to a 155-kd protein is associated with dermatomyositis. Arthritis Rheum 2006; 54:3682.
8. Chinoy H, Fertig N, Oddis CV, Ollier WE, Cooper RG. The diagnostic utility of myositis autoantibody testing for predicting the risk of cancer-associated myositis. Ann Rheum Dis 2007; 66:1345.
9. Sigurgeirsson B, Lindelöf B, Edhag O, Allander E. Risk of cancer in patients with dermatomyositis or polymyositis. A population-based study. N Engl J Med 1992; 326:63.
10. Chen YJ, Wu CY, Huang YL, Wang CB, Shen JL, Chang YT. Cancer risks of dermatomyositis and polymyositis: a nationwide cohort study in Taiwan. Arthritis Res Ther 2010; 12:R70.
11. Chen YJ, Wu CY, Shen JL. Predicting factors of malignancy in dermatomyositis and polymyositis: a case-control study. Br J Dermatol 2001; 144:825.
12.Dalakas MC, Illa I, Dambrosia JM, Soueidan SA, Stein DP, Otero C, et al.A controlled trial of high-dose intravenous immune globulin infusions as treatment for dermatomyositis.N Engl J Med. 1993; 329(27):1993.

