INTRODUÇÃO
A sarcoidose é uma doença inflamatória granulomatosa de etiologia não totalmente esclarecida, caracterizada pela presença de granulomas não caseosos em qualquer órgão. Os órgãos mais frequentemente envolvidos são o pulmão (mais de 90%), os gânglios linfáticos (95% mediastínicos, 30% periféricos), o olho (20-50%) e a pele (25%)1. Epidemiologicamente, a sarcoidose atinge todos os grupos raciais e étnicos, e todas as idades, embora seja mais frequente em indivíduos com menos de 50 anos, entre os 20 e 39 anos2, nos países do norte da Europa, em indivíduos de raça negra e em mulheres2. O diagnóstico é realizado através da avaliação detalhada do conjunto da informação clínica, imagiológica, histológica, citológica, e da exclusão de outras patologias com apresentação clínica ou histológica semelhante. A obtenção de granulomas não caseosos na amostra histológica confirma o diagnóstico3,4.
A associação entre neoplasias e sarcoidose começou a ser investigada há 40 anos por Brincker et al. e tem sido documentado o risco aumentado de neoplasias em doentes com sarcoidose5,6. As neoplasias mais frequentemente identificadas foram os linfomas e as neoplasias sólidas do pulmão, útero e testículo. No entanto, ocasionalmente é encontrado tecido granulomatoso em torno de vários tipos de neoplasias (designada por reacção tipo sarcóide). As reacções tipo sarcóide, descritas por Wolbach7 em 1911, em doentes com neoplasias e que não cumprem critérios para sarcoidose sistémica, surgem principalmente nos gânglios linfáticos que drenam o tumor, sendo muito raro surgirem à distância. É proposto que a sarcoidose aumenta o risco de neoplasia ao causar um estado de inflamação crónica (hipótese sarcocêntrica)6 ou que a sarcoidose surja como resposta imunológica à neoplasia (hipótese oncocêntrica)8. A determinação de uma relação temporal entre as duas entidades é, no entanto, muito difícil de estabelecer na maioria dos casos. Permanece por identificar uma correlação conclusiva entre as duas entidades.
CASO CLÍNICO
Homem de 71 anos, leucodérmico, comerciante reformado, com tabagismo crónico não activo (40 unidades maço-ano, em abstinência há 3 anos). Referenciado à consulta de Doenças Auto-Imunes por uveíte granulomatosa intermédia bilateral com 3 meses de evolução, para investigação de envolvimento sistémico e por necessidade de tratamento prolongado com corticoterapia oral.
O doente negava outra sintomatologia de órgão ou sistema além de fotofobia, dor e diminuição da acuidade visual (AV) à direita. Ao exame objectivo, apresentava hiperémia conjuntival bilateral, com acuidade visual do olho direito (OD) sem correcção (sc) 6/10 e esquerdo (OE) sc 8/10; fundoscopia com vitrite bilateral e depósitos granulomatosos periféricos; tomografia de coerência óptica com edema macular bilateral; angiografia fluoresceínica com edema macular cistoide, algumas áreas de vasculite periférica bilateral, com maior atingimento das veias retinianas; e membrana epi-retiniana bilateral.
Analiticamente, destacava-se a elevação da enzima conversora da angiotensina 78,27 U/L (Tabela 1). A tele-radiografia do tórax mostrava ingurgitamento hilar à direita, pelo que realizou tomografia axial computorizada (TC) torácica de alta resolução (Fig. 1 e 2) que revelou uma lesão nodular espiculada no segmento ápico-posterior do lobo superior esquerdo com 28x25 mm, com algumas pontes pleurais, e múltiplos gânglios mediastínicos. Realizou teste de tuberculina que se mostrou anérgico. A espirometria com difusão de monóxido de carbono (DLCO) revelou diminuição (4 mmol/min/kPa face ao normal de 5.57 mmol/min/kPa).
Perante o contexto epidemiológico, clínico e laboratorial, as principais hipóteses diagnósticas colocadas: a sarcoidose, a tuberculose e a uveíte associada a neoplasias (síndrome mascarada).
Para a caracterização histológica da lesão nodular espiculada o doente realizou punção transtorácica guiada por TC, que revelou carcinoma pavimento celular (CPC) do pulmão com moderada diferenciação; broncofibroscopia óptica com lavado bronco-alveolar sem alterações da contagem celular e sem células neoplásicas.
Para o estadiamento do CPC, realizou tomografia de emissão de positrões/TC com fludesoxiglicose (PET/TC-18F-FGG) (Fig.3) que mostrou nódulo hipermetabólico no lobo superior esquerdo e envolvimento ganglionar mediastínico, sem captação noutra localização. O estadio do CPC seria, com os métodos complementares de diagnóstico realizados até ao momento, IIIB (T2aN3M0). Permanecendo a dúvida da natureza das lesões ganglionares, foi submetido a videomediastinoscopia cervical com biópsia de gânglios sub-carinal, hilar direito, para-traqueais superior e inferior, e cervicais inferiores. O resultado histopatológico demonstrou, em todos as amostras, tecido ganglionar ocupado por granulomas não caseosos uniformes, compostos por histiócitos de citoplasma amplo e eosinofílico, núcleo e nucléolo proeminente, células gigantes de Langhans, ausência de bacilos álcool-ácido resistentes (BAAR) por Ziehl-Neelsen e de tecido neoplásico.
Reunindo os achados clínicos, imagiológicos e histopatológicos, os diagnósticos foram: CPC do pulmão estadio IB (T2aN0M0) e sarcoidose sistémica com envolvimento ganglionar e ocular. Os critérios de diagnóstico de sarcoidose foram cumpridos: clínica e imagiologico compatível; evidência de granulomas não caseosos; e a exclusão de outras doenças granulomatosas, nomeadamente a tuberculose.
Face ao estadiamento foi tratado com lobectomia superior esquerda com esvaziamento ganglionar. A peça operatória revelou CPC moderadamente diferenciado, com moderada reacção fibro-inflamatória, sem atingimento da pleura visceral e sem invasão vascular hemática, linfática ou peri-neural (Fig. 4). Os gânglios hilares bilaterais mostraram apenas granulomas epitelióides sem necrose (Fig. 5).Não realizou quimioterapia adjuvante e permaneceu em vigilância na consulta de Oncologia.
Relativamente à sarcoidose ocular e ganglionar, desde o diagnóstico até ao pós-operatório, foi medicado prednisolona (PDN) 20 a 60mg/dia, com resposta parcial quanto ao envolvimento oftalmológico, AV sc OD 8/10+/ AVsc OE 8/10++. A opção de não adicionar outro imunossupressor no período peri-operatório foi assumida pelo risco aumentado de complicações infecciosas e de interacções medicamentosas caso fosse necessário o início de quimioterapia, e porque apesar de permanecer activa, a uveíte anterior não comprometia a visão do doente não interferindo de forma significativa na sua qualidade de vida.
Ao 12º mês pós-operatório, sob PDN 20 mg/dia, apresentou cansaço para esforços menores e agravamento de novo da uveíte anterior do OD, com compromisso grave da AV. Foram excluídas outras causas para o cansaço, nomeadamente cardíaca. Repetiu a TC (Fig. 6) que mostrou aumento dimensional e alteração morfológica, com áreas de necrose de novo, das adenopatias mediastínicas. Perante o agravamento da sarcoidose, realizou três pulsos de metilprednisolona 1 g/dia, seguido de PDN 1 mg/Kg/dia e início de metotrexato (MTX) 15 mg/semanal. Houve melhoria rápida do quadro de cansaço e resolução da uveíte anterior. Teve como intercorrência infecção a Herpes zoster cutânea, associada a encefalite de provável etiologia herpética, que foram resolvidos com aciclovir durante 14 dias.
Após 24 meses de seguimento não há qualquer evidência clínica ou imagiológica de recidiva tumoral.
DISCUSSÃO
O doente apresentado necessitou de uma abordagem multi-disciplinar e faseada com o objectivo de estadiamento adequado da doença. A realização do PET-CT-scan com FDG não permitiu excluir um estadio IIIb (pela presença de adenomegálias mediastínicas bilaterais). Comparativamente à TC isolada, a PET pode diferenciar mais correctamente adenomegálias benignas de malignas, e avaliar a presença de metastização local e à distância. Para a identificação de metástases ganglionares, a sensibilidade e especificidade da TC isolada é avaliada em 51% e 85%, respectivamente, o que demonstra o seu papel limitado no estadiamento ganglionar, enquanto a PET FDG apresenta sensibilidade e especificidade superiores, 74% e 85%, respectivamente9. Apesar disso, a FDG-PET comporta uma taxa de falsos positivos elevada no contexto de lesões com elevada taxa metabólica, tais como a sarcoidose, tuberculose, infecções fúngicas, sendo por isso mais importante para identificar metástases à distância. Assim, foi necessária a obtenção de biópsias dos gânglios que demostravam maior actividade metabólica na FDG-PET. A biópsia por punção-aspirativa transbrônquica (TBNA) é utilizada frequentemente nestes casos; a sensibilidade e especificidade desta técnica no estadiamento mediastínico do carcinoma do pulmão não pequenas células (NSCLC) são estimadas em 60,9 % e 100%, respectivamente10. No entanto, pela elevada taxa de falsos negativos, uma TBNA não exclui a presença de metastização ganglionar11.
No nosso doente, as biópsias ganglionares obtidas por videomediastinoscopia em duas ocasiões não mostraram tecido neoplásico, mas sim granulomas não caseosos, compatíveis com sarcoidose. A presença de adenopatias mediastínicas contra-laterais colocaria o doente no estadio IIIB (T2aN3M0), com implicações na sua terapêutica e prognóstico. A marcha diagnóstica efectuada permitiu o diagnóstico de CPC do pulmão estadio IB (T2aN0M0) e de sarcoidose sistémica com envolvimento pulmonar e ocular.
A co-existência de neoplasia do pulmão com sarcoidose já foi reportada, Kim et al. 201112, salientando a importância da avaliação histopatológica de adenomegalias mediastínicas para o estadiamento, prognóstico e tratamento do doente. Contudo, no caso que apresentamos há compromisso sistémico pela sarcoidose, com envolvimento ocular, além de mediastínico. Ao contrário do caso apresentado por Kim et al. 2011, podemos afirmar que os achados clínicos não se enquadravam numa reacção sarcóide à neoplasia. Após a lobectomia pulmonar sem necessidade de quimioterapia adjuvante, a sarcoidose permaneceu activa e resistente à corticoterapia, o que sugere que era desde o início uma doença autónoma e não relacionada com o CPC pulmonar. Neste caso, a apresentação inicial de CPC do pulmão e a sarcoidose sistémica podem não ter nenhuma correlação.
O doente continuou a necessitar de doses elevadas de PDN (20 a 60 mg/dia) para controlo da uveíte, pelo que se decidiu adicionar MTX 15 mg/semanal. O início de MTX permitiu a redução da corticoterapia sistémica para 15 mg/dia, com o controlo da doença. As complicações infecciosas e a reactivação de Herpes zoster associadas ao MTX estão descritas principalmente em doentes com artrite reumatóide. No caso apresentado, motivaram a interrupção transitória (15 dias do fármaco), sem evidência de agravamento da sarcoidose.
Em suma, o caso clínico aqui apresentado mostra uma associação rara entre duas entidades com implicações terapêuticas e prognósticas muito distintas. É destacada a importância da marcha diagnóstica sequencial e a relevância da colaboração multidisciplinar para alcançar o estadiamento e tratamento adequados da neoplasia maligna do pulmão e da sarcoidose. No caso em questão, é também importante salientar a monitorização das adenopatias cujas alterações quanto e qualitativas podem corresponder à activação de ambas as patologias.
Figura I
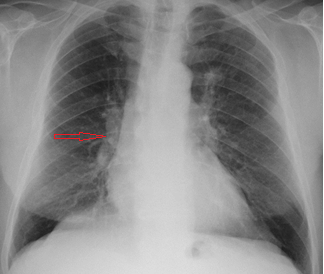
Teleradiografia do tórax mostra ingurgitamento hilar à direita (seta vermelha).
Figura II
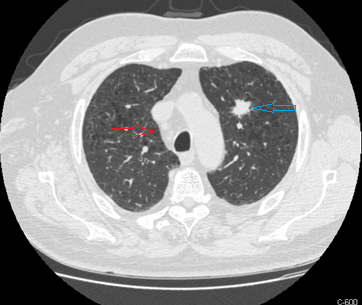
Tomografia axial computorizada torácica de alta resolução: lesão nodular espiculada no segmento ápico-posterior do lobo superior esquerdo com 28x25 mm com algumas pontes pleurais (seta azul); múltiplos gânglios mediastínicos latero-traqueais superior e inferior, latero-aórticos, subcarinal e hilares (seta vermelha)
Figura III
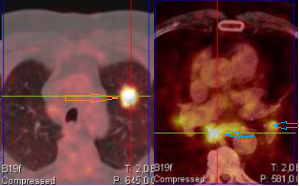
Tomografia de emissão de positrões/TAC com fludesoxiglicose (PET/TAC-18F-FGG): nódulo hipermetabólico no lobo superior esquerdo de limites espiculados (seta vermelha); e envolvimento hilar bilateral e mediastínico (setas azuis).
Figura IV
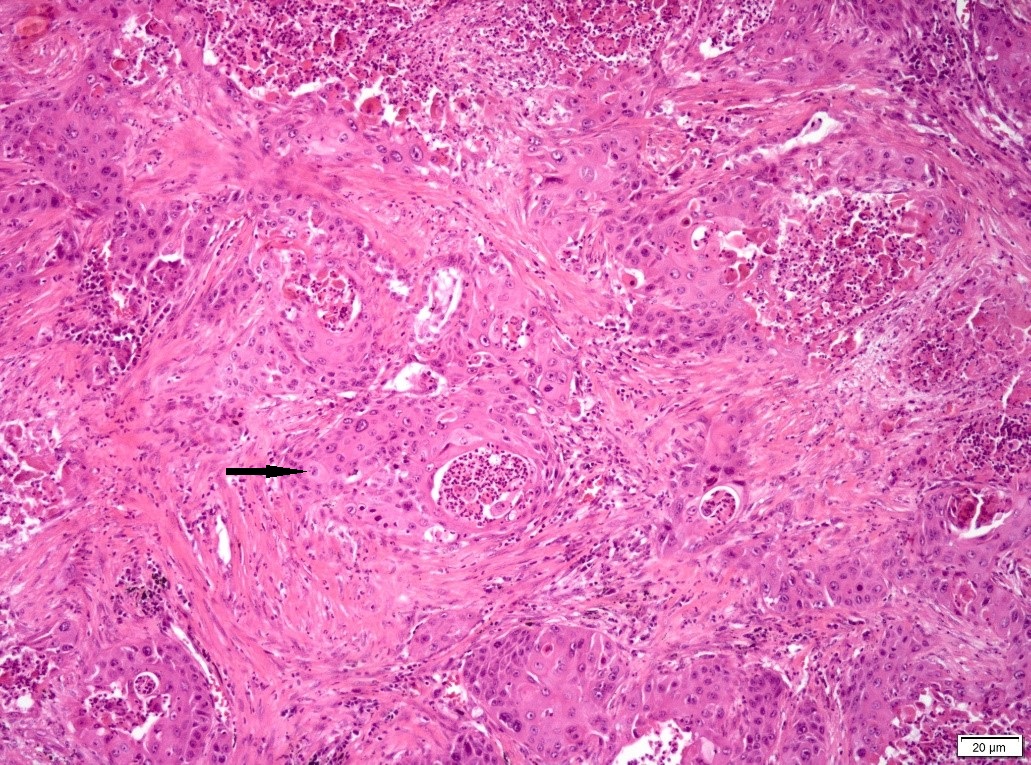
Figura 4. Histologia de peça operatória (lobectomia pulmonar), microscopia óptica, hematoxilina-eosina, 10x: carcinoma pavimento celular do pulmão.
Figura V
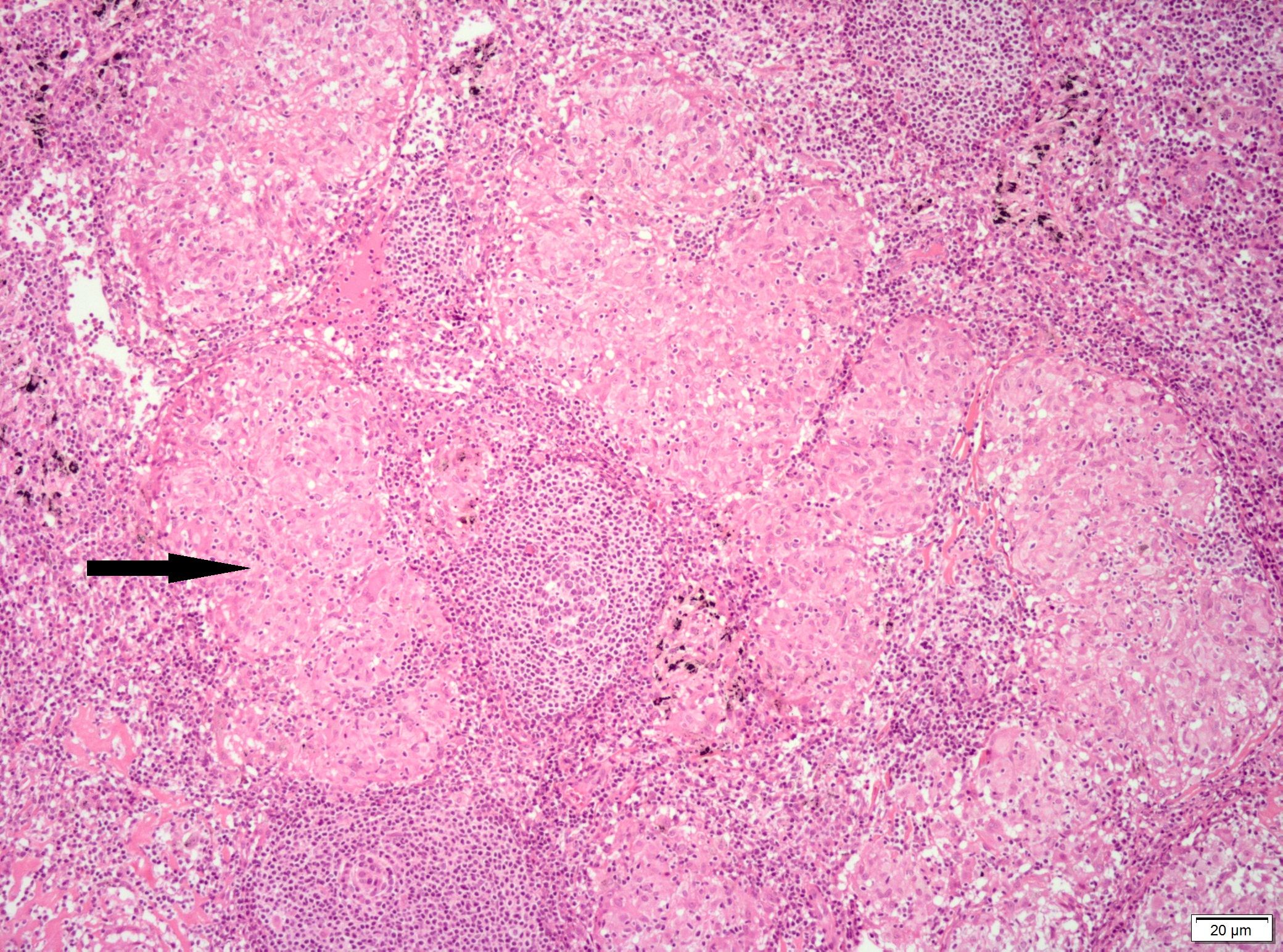
Histologia de peça operatória (gânglios hilares removidos durante a lobectomia), microscopia óptica, hematoxilina-eosina, 10x: granulomas epitelióides sem necrose (seta).
Figura VI
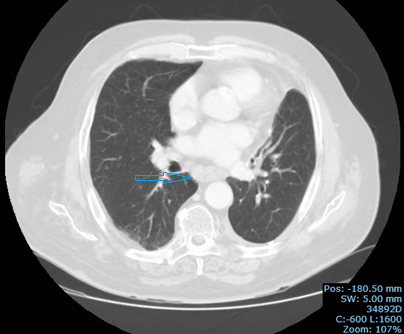
Tomografia axial computorizada torácica de alta resolução: adenopatias subcarinais, do recesso ázigo esofágico e do hilo pulmonar direito com áreas de necrose de novo (seta azul).
BIBLIOGRAFIA
1. Costabel U. Sarcoidosis: clinical update. Eur Respir J. 2001; 18: Suppl. 32, 56s–68s
2. Rybicki BA, Major M, Popovich J Jr, Maliarik MJ, Iannuzzi MC. Racial differences in sarcoidosis incidence: a 5-year study in a health maintenance organization. Am J Epidemiol. 1997. 145(3):234-41
3. Heinle R, Chang C. Diagnostic criteria for sarcoidosis. Autoimmunity Reviews. 2014. 13: 383–387
4. Valeyre D. et al. Sarcoidosis. Lancet. 2014;383(9923):1155-67
5. Asking J, Grunewald J, Eklund A., Hillerdal G, Ekbom A. Increased risk for cancer following sarcoidosis. Am J Respir Crit Care Med 1999; 160:1668–1672
6. Brincker H, Wilbek E. The incidence of malignant tumors in patients with respiratory sarcoidosis. Br J Cancer 1974; 29: 247–251
7. Wolbach SB. A new type of cell inclusion, not parasitic, associated with disseminated granulomatous lesions. J Med Res 1911;24: 243-58
8. Judson M. The etiologic agent of sarcoidosis: what if there isn’t one [editorial]? Chest. 2003; 124:6–8
9. Silvestri GA, Gould MK, Margolis ML, Tanoue LT, McCrory D, Toloza E, et al. Noninvasive staging of non-small cell lung cancer: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest. 2007;132 (3 Suppl):178S-201S.
10. Zhu Bo, Maldonado F, Bungum AO, dell ES. Sensitivity and specificity of TBNA in a large academic center. J Thorac Oncol. 2007. 2(8) - p S591
11. Kim ES, Bosquée L. The importance of accurate lymph node staging in early and locally advanced non-small cell lung cancer: an update on available techniques. J Thorac Oncol. 2007. 2 (2):S59-67
12. Kim JJ, Park JK,l Wang YP, Choi SH, Jo KH. Lung Cancer Associated with Sarcoidosis - A case report. Korean J Thorac Cardiovasc Surg 2011; 44:301-303

