Caso Clínico
Doente do género masculino de 77 anos de idade, viúvo. Recorreu ao Serviço Urgência com quadro de dispneia acompanhada de tosse produtiva com dificuldade em expelir a expectoração e ligeira disfagia para sólidos. O doente referia história com 3 meses de evolução de disfagia para sólidos de agravamento progressivo. Nas ultimas 3 semanas disfonia e nos últimos dias aparecimento de tosse produtiva, sem febre. Dois dias antes do internamento tinha recorrido ao SU com as queixas acima referidas, tendo tido alta com o diagnóstico de infeção respiratória e medicado com Amoxicilina mais Acido Clavulânico e Prednisolona. Por agravamento dos sintomas voltou ao SU. Pelas queixas de disfonia e disfagia o seu Médico Assistente já lhe tinha pedido endoscopia digestiva alta, tomografia computorizada (TC) crânio encefálica e observação por Otorrinolaringologia, não tendo estes exames mostrado alterações.
Antecedentes pessoais de Situs inversus, Cardiopatia isquémica com doença coronária de 2 vasos, PTCA com colocação 2 stents, HTA, Diabetes tipo 2, Hiperuricemia, Hiperplasia benigna da próstata, Tabagismo 30 UMA, em remissão há 5 anos. Nunca tinha realizado provas de função respiratória. Na admissão o doente encontrava-se consciente, lúcido, orientado e colaborante. Subfebril, polipneico em ar ambiente. A auscultação pulmonar tinha murmurio vesicular rude com fervores na base esquerda. No exame neurológico (EN) destacava-se: disfonia, com discurso difícilmente perceptivel, disfagia para líquidos, dificuldade em manter a cabeça em posição ereta, dificuldade em manter os braços estendidos á frente, com agravamento após movimentos repetitivos e com recuperação de força após um periodo de descanso, reflexos osteotendinosos normais ausência de fasciculações. Analiticamente salientava-se aumento dos parâmetros inflamatórios com leucocitose 12,900 uL e PCR 7,5 mg/dl. A radiografia do tórax mostrou Situs inversus (Figura 1) e reforço bronquico á esquerda. A gasimetria realizada em FiO2 21% apresentava insuficiência respiratória tipo II com pH 7,47, pCO2 de 49mmHg, pO2 de 50mmHg, HCO3 32,5 e StO2 86%. Inicialmente foram admitidas as seguintes hipóteses de diagnostico: DPOC agudizada por traqueobronquite aguda, dado os antecedentes de tabagismo e valores gasimetricos, mas esta hipótese acabou por ser excluída porque o doente não tinha historia compatível com DPOC e doença neuromuscular a esclarecer: miastenia gravis, paresia bulbar, esclerose lateral amiotrófica e síndrome Eaton-Lambert. As alterações encontradas no exame neurologico eram mais a favor de Miastenia grávis. Apesar da terapêutica instituída, com broncodilatadores e antibiotico, houve deterioração clinica-analítica com agravamento da insuficiência respiratória até acidemia respiratória grave com necessidade de Ventilação Mecânica Invasiva (VMI) e de transferência para Unidade de Cuidados Intensivos Respiratórios (UCIR) do Hospital de Santa Maria. Durante a permanência nesta unidade evoluiu favorávelmente, tendo sido possível extubação ao 5º dia de VMI. Houve progressiva melhoria gasimetrica, á data da alta desta unidade, GSA em FiO2 21% com pH 7,46, PCO2 de 43mmHg, pO2 de 80mmHg, HCO3 26,4 e StO2 96%. Realizou electromiograma que não mostrou alterações. Por forte suspeita clinica de miastenia gravis foram feitas pesquisas de Anticorpos anti-receptor da acetilcolina que foram positivos: 80,0 (N<0,25) confirmando-se o diagnostico de Miastenia Gravis. Das outras analises efectuadas destacam-se Anticorpos anti DNA Positivos, ANA Positivos, TSH 2,317, T4Livre 1,25. Fez TC torácico que mostrou timoma (Figura 2). O doente iniciou terapêutica com Prednisolona 25 mg por dia e brometo de piridostigmina 60 mg 8/8h com melhoria clinica. Teve alta ao 27º dia de internamento, tendo sido observado em consulta de cirurgia cardio-torácica, ficou a aguardar ser chamado para timectomia. Posteriormente tivemos conhecimento que doente faleceu (menos de 48 horas após entrada) num Hospital no Algarve (onde estava a passar férias), foi internado de urgência por falência respiratória em contexto de provável crise miasténica, chama-se a atenção para o fato que o calor é uma das possiveis causas desencadeantes de crises miasténicas.
Discussão:
A miastenia gravis é uma doença neuromuscular que causa fraqueza e fadiga anormalmente rápida dos musculos voluntários (1) e nunca afetando a musculatura intrínseca. A fraqueza é secundária a um funcionamento anormal da junção neuromuscular: anticorpos contra receptores pós-sinpaticos da acetilcolina (ACh) bloqueiam a acção da acetilcolina evitando que o potencial da placa terminal seja insuficiente para desencadear contração muscular (2). Os sintomas variam de doente para doente, mas tipicamente o inicio é insidioso; no entanto, o estabelecimento do quadro pode ser desencadeado por uma infeção (como neste caso), durante a gravidez, puerpério, stress, hipo ou hipertiroidismo, após utilização de fármacos tais como agentes anestésicos, sedativos ou relaxantes musculares, beta-bloqueantes, aminoglicosideos e tetraciclinas. Os músculos mais frequentemente afetados são o músculo elevador da pálpebra superior e musculatura extraocular, com aparecimento de ptose diplopia e estrabismo, (o que não se verificou neste caso) podendo igualmente haver alterações na musculatura da mandíbula (fadiga na mastigação), da face (o sorriso num “esgar”), da orofaringe (disfagia com regurgitação nasal dos líquidos), da laringe (disfonia) e do pescoço (incapacidade em suster a cabeça), estando os últimos 3 sinais presentes no nosso doente. Raramente, os primeiros sintomas são referidos aos membros e tronco (incluindo o diafragma, nos casos mais graves). O quadro clinico é invariavelmente mais proeminente ao fim do dia é bilateral, mas assimétrico.
A doença raramente é fatal, mas pode ameaçar a vida quando atinge deglutição e/ou os músculos respiratórios. Neste caso o quadro clinico pode mimetizar patologia respiratória com insuficiencia respiratória tipo II (como no caso apresentado).
Em sensivelmente 85% dos casos a progressão é rápida e a sintomatologia torna-se generalizada (miastenia generalizada), ficando a sintomatologia nos restantes 10-15% confiada à musculatura ocular (miastenia ocular). Um agravamento súbito do quadro clínico, com falência respiratória, denomina-se crise miasténica é uma emergência médica, sendo necessária a ventilação mecânica.
O diagnóstico desta entidade clinica baseia-se na identificação precoce de sintomas típicos, apoiado na realização exames complementares: anticorpos anti Acetilcolina, , TAC tóracico, Electromiograma, sendo recomendado fazer o teste de estimulação eletrica repetida (o EMG deste doente era normal, mas não foi efectuado este teste).
Diagnóstico diferencial com síndromes miasténicos:
- Sídrome Eaton-Lambert. Triada clássica: diminuição proximal da força muscular, hiporreflexia osteotendinosa e disautomonia(3).
- Botulismo. Caracterizado por parésia muscular descendente, diplopia, disartria e/ou disfagia. História clínica, electromiograma e doseamento de anticorpos ajudam na distinção destas patologias.
O tratamento mais indicado é à base de anticolinesterásicos - neostigmina 15 a 90 mg 6/6h a a piridostigmina 7,5 a 45 mg cada 2 até 6 h. A terapêutica com glucocorticoides em doses baixas, é por vezes necessária nos doentes mais graves. Os glucocorticoides assim como os outros imunossupressores, são bastante eficazes produzindo remissão dos sintomas. A plasmaferese ou imunoglobulina IV (4) pode ser um recurso terapêutico em casos de risco de vida e/ou para preparação de doentes para cirurgia.
Em doentes com timoma é necessária timectomia, cerca de 50 % dos doentes ficam em remissão pós timectomia.
Com tratamento, a maioria dos doentes pode ter uma boa qualidade de vida, pelo que o diagnóstico desta entidade clinica e a identificação precoce duma crise miasténica são essenciais para que se possa instituir atempadamente a terapêutica adequada e assim evitar uma evolução desfavorável. Os doentes devem ser ensinados a reconhecer as crises miasténicas e saberem quais os possíveis fatores desencadeantes (5).
Figura I
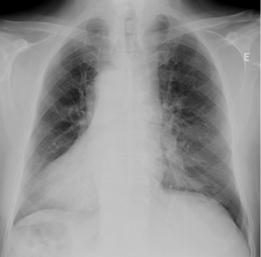
Rx tórax
Figura II
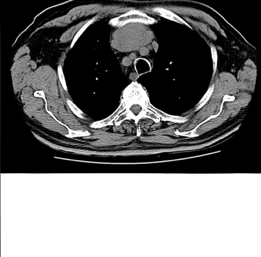
TAC tóracico
BIBLIOGRAFIA
1. Murray Longmore, Ian Wilkinson, Andrew Baldwin, Elizabeth Wallin. Oxford Handbook of Clinical Medicine, 9th Edition, 2014; 516-517.
2. Merggioli M, Sanders D. Autoimmune myasthenia gravis: emerging clinical and biological heterogeneity. Lancet Neurol 2009;8:475-490.
3. Tormoehlen LM, Pascuzzi RM. Thymoma, Myasthenia Gravis, and Other Paraneoplastic Syndromes. Hematol Oncol Clin N Am 2008;22:509-526.
4. Zinman L, Ng E, Bril V. IV immunoglobulin in patients with myasthenia gravis. A randomized controlled trial. Neurology 2007; 68:837-841.
5. Shawn JB, Jeremy MS, John FD,Treatment of myasthenia gravis,www.uptodate.com



