Introdução
A angiopatia amiloide cerebral (AAC) é uma doença inflamatória decorrente da deposição amilóide nos vasos de pequeno e médio calibre do cérebro e leptomeninges. Trata-se de uma causa de hemorragia intracerebral lobar primária,1,2 quase sempre assintomática abaixo dos 65 anos. 3
A AAC pode ocorrer como doença esporádica, associada a doença de Alzheimer ou como síndrome familiar. A incidência é crescente com a idade. 3 O alelo APOE ε2 comporta maior risco de hemorragia assim como uma instalação mais precoce da doença e maior risco de recorrência.4
A patogénese está relacionada com depósitos congofílicos de fragmento 39-43 da proteína percursora amilóide bioquimicamente semelhante às placas senis na doença de Alzheimer. Nas fases mais avançadas, ocorre destruição da parede do vaso sanguíneo com hemorragia consequente.5
Raros doentes são assintomáticos. As manifestações clínicas consistem em hemorragia intracerebral e microhemorragias, sintomas neurológicos transitórios e demência. A manifestação mais frequente da AAC é a hemorragia lobar espontânea. A hemorragia por AAC é mais frequente em doentes hipocoagulados.5 A evolução clínica na hemorragia lobar depende da idade, localização e volume, tendo as hemorragias mais superficiais e sem envolvimento dos ventrículos uma evolução mais favorável, e as hemorragias volumosas e em doentes idosos pior prognóstico. 4,6,7 A mortalidade geral da hemorragia lobar relacionada com AAC é de 10 a 30%. 6,7
O diagnóstico da AAC deve ser suspeitado em doentes com mais de 60 anos e hemorragias lobares múltiplas na ausência de uma causa óbvia. Os critérios de Boston definem a probabilidade de AAC, sendo que a doença só pode ser definitivamente diagnosticada por exame anatomopatológico: (Tabela 1)
A inflamação perivascular/vascular da AAC (AACi) parece determinar um subtipo de AAC com diferente expressão anatomopatológica – predomina a deposição perivascular da proteína congófila sendo este o local predominante da inflamação – e clínica - de declínio cognitivo subagudo ou agudo associada a convulsões, cefaleias e sinais focais.8A RM revela hiperintensidades da matéria branca em T2, em placas ou confluentes. Os marcadores sistémicos de inflamação costumam ser normais,9 e o liquido cefalo-raquidiano (LCR), revela frequentemente pleiocitose e/ou proteínas ligeiramente elevadas.5
Em relação ao tratamento na fase aguda, deve ser abordada da mesma forma que outras hemorragias intracerebrais.5 Numa fase posterior, podem ser ponderadas: a) cirurgia, com pouco ou nenhum risco acrescido na AAC;10 b) evicção do uso de antiagregantes e anticoagulantes; c) controlo tensional; d) evicção do uso de estatinas em pacientes que beneficiem pouco da sua toma; e) imunossupressão.
Scolding N. et al e Sakaguchi, H et al relataram resultados favoráveis com terapêutica corticóide e/ou imunosupressora.11,12 Scolding N. et al analisaram os desfechos de 20 pacientes com AAC tratados com esteróides, dos quais 8 com ciclofosfamida associada, tendo verificado uma resposta favorável com tratamento com qualquer um dos esquemas, embora em 2 doentes, de curta duração. Melhorias sustidas ou quase completas são raras mas 4 pacientes mostraram reversão completa de lesões da substância branca em RMN-CE.11
Caso clínico
Doente de 80 anos, com antecedentes de dislipidémia e síndrome demencial diagnosticado sete anos antes, acamado, medicado com estatina, memantina, donepezilo, mirtazapina, risperidona e rivastigmina, internado após duas crises convulsivas, tónico-clónicas generalizadas com duração não especificada, sem mordedura de língua ou incontinência de esfíncteres espaçadas por 2 semanas. Após o primeiro episódio, foi instituída terapêutica com ácido valpróico. À admissão apresentava sinais vitais estáveis; o exame neurológico revelou doente vigil, que emitia sons incompreensíveis, não cumpria ordens, mobilizava os 4 membros espontaneamente; com pupilas isocóricas e isoreactivas, sem assimetrias faciais, sem sinais meníngeos. Não apresentava alterações de relevo relativamente a marcadores sistémicos de inflamação, função renal, ionograma, radiografia do tórax, eletrocardiograma. Realizou tomografia computorizada cranioencefálica com áreas lesionais intra-axiais hipodensas na substância branca subcortical bi-hemisférica de predomínio periférico, mais extensas à direita, com envolvimento cortical frontal e parietal e atenuação dos sulcos corticais, com discreta captação de contraste nas leptomenínges da convexidade direita. (Figura 1)
A punção lombar revelou apenas proteinoráquia de 92,1 mg/dL, sem isolamento microbiológico ou evidência de células neoplásicas. As serologias do vírus da imunodeficiência humana e sífilis foram negativas.
Realizou RMN-CE (Figura 2A) que revelou múltiplas áreas de hipersinal nas sequências de TR longo, e hipossinal em T1, com limites irregulares e mal definidos, parcialmente confluentes, localizadas no córtex e substância branca subcortical fronto-parieto-occipital bilateralmente de forma assimétrica, de predomínio direito, associando-se extensão à substância branca dos centros semi-ovais e lobos temporais. Adicionalmente observavam-se múltiplas áreas punctiformes/nodulares com hipossinal em T2*. Estes achados foram interpretados como síndrome de leucoencefalopatia posterior reversível (encefalopatia hipertensiva aguda) associados a múltiplos depósitos de hemossiderina que traduziam micro-hemorragias.
Apesar de ligeira melhoria do quadro neurológico, a RM-CE (Figura 2B) de controlo evolutivo, não mostrou significativa regressão das lesões, o que não era compatível com a hipótese colocada.
Iniciou corticoterapia com dexametasona 1mg/Kg durante 3 dias e nos dias seguintes 60 mg/dia de prednisolona, com ligeira melhoria do quadro neurológico.
Observado em consulta, 3 semanas depois, era objectivável franca melhoria do quadro neurológico, estando a deambular autonomamente e com discurso coerente. Sendo o mini-mental test 13/30. A RMN-CE realizada 1 mês após a alta (Figura 2C) mostrou regressão marcada das lesões.
Alguns meses depois, com o desenvolvimento de diabetes mellitus secundária, por opção da família suspendeu-se corticoterapia que coincidiu com agravamento do quadro neurológico, regressando o doente ao estado prévio, acamado.
Discussão
O caso relatado refere-se a um doente idoso com antecedentes de síndrome demencial não especificado com quadro de convulsões tónico-clónicas que preenche os critérios de Boston para provável AAC. Foram considerados diagnósticos alternativos inicialmente, englobando causas infecciosas ou metabólicas, que rapidamente foram excluídas pela avaliação analítica inicial, direccionando o diagnóstico para um quadro neurológico. Considerando a idade avançada, na presença de factores de risco cardiovascular, o acidente vascular cerebral pareceria a hipótese mais provável, seguido de tumor primário ou secundário do sistema nervoso central ou malformação arteriovenosa, com ou sem componente hemorrágico. No entanto, o estudo imagiológico inicialmente com TC CE complementado com RMN CE excluiu esta hipótese, conduzindo à AACi pelo típico padrão imagiológico descrito.Embora para cumprimento estrito dos critérios de Boston a biópsia cerebral seja necessária para o diagnóstico de AAC, esta não foi realizada dada a idade avançada e a resposta muito favorável à terapêutica corticóide.
A RMN-CE é o melhor método não invasivo imagiológico para diagnóstico.5
A notável melhoria do estado clínico com a terapêutica corticoide está de acordo com os dados da literatura.
Esta entidade nosológica deve ser suspeitada em doentes idosos com défice cognitivo de aparecimento ou agravamento súbitos de carácter agudo/subagudo, especialmente se este cursar com hemorragia intracraniana, convulsões ou sinais neurológicos focais. A identificação destes casos permite o inicio de terapêutica tendo em vista a melhoria da qualidade de vida do doente.
Quadro I
Critérios de Boston
| AAC definitiva | Exame póstumo completo demonstrando: |
| | Hemorragia lobar, cortical ou corticosubcortical |
| | AAC grave com vasculopatia |
| | Ausência de outra lesão diagnóstica |
| Provável AAC com patologia concordante | Dados clínicos e histologia (hematoma evacuado ou biópsia) demonstrando: |
| | Hemorragia lobar, cortical ou corticosubcortical |
| | Algum grau de AAC na amostra |
| | Ausência de outra lesão diagnóstica |
| Provável AAC | Dados clínicos e RMN ou TC demonstrando: |
| | Hemorragias múltiplas lobar, cortical ou corticosubcortical |
| | Idade = ou > 55 anos |
| | Ausência de outra causa de hemorragia |
| Possível AAC | Dados clínicos e RMN ou TC demonstrando: |
| | Hemorragia única lobar, cortical ou corticosubcortical |
| | Idade = ou > 55 anos |
| | Ausência de outra causa de hemorragia |
| | |
| | |
| | |
Para hemorragia relacionada com AAC
Figura I
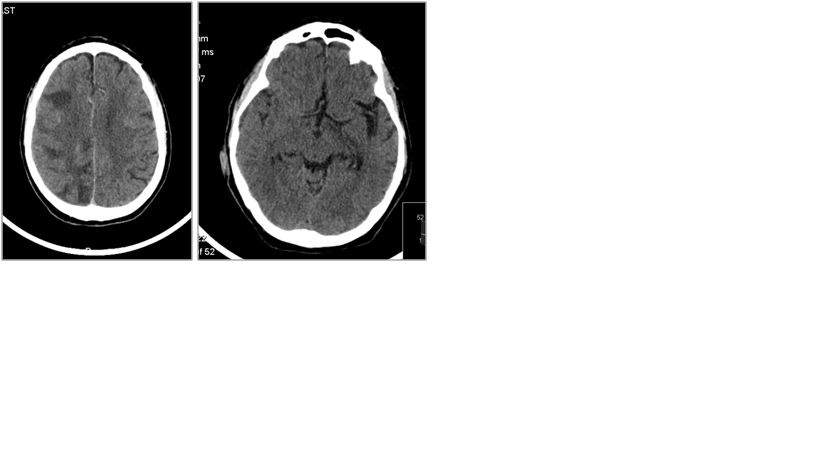
Tomografia computorizada cranio-encefálica à admissão
Figura II
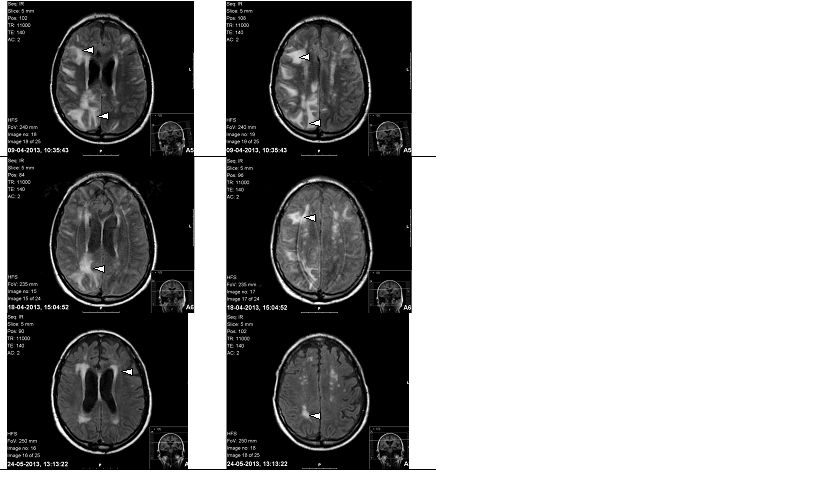
Evolução da imagem em tomografia computorizada cranio-encefálica
BIBLIOGRAFIA
Bibliografia
1) Viswanathan A, Greenberg SM. Cerebral amyloid angiopathy in the elderly. Ann Neurol 2011; 70:871.
2) Charidimou A, Gang Q, Werring DJ. Sporadic cerebral amyloid angiopathy revisited: recent insights into pathophysiology and clinical spectrum. J Neurol Neurosurg Psychiatry 2012; 83:124.
3) Greenberg SM, Vonsattel JP. Diagnosis of cerebral amyloid angiopathy. Sensitivity and specificity of cortical biopsy. Stroke 1997; 28:1418.
4) Greenberg SM, Briggs ME, Hyman BT, et al. Apolipoprotein E epsilon 4 is associated with the presence and earlier onset of hemorrhage in cerebral amyloid angiopathy. Stroke 1996; 27:1333.
5) Uptodate, Cerebral amyloid angiopathy, actualizado a 31 de Outubro de 2013
6) Oide T, Tokuda T, Takei Y, et al. Serial CT and MRI findings in a patient with isolated angiitis of the central nervous system associated with cerebral amyloid angiopathy. Amyloid 2002; 9:256.
7) Le Coz P, Mikol J, Ferrand J, et al. Granulomatous angiitis and cerebral amyloid angiopathy presenting as a mass lesion. Neuropathol Appl Neurobiol 1991; 17:149.
8) Linn J, Halpin A, Demaerel P, et al. Prevalence of superficial siderosis in patients with cerebral amyloid angiopathy. Neurology 2010; 74:1346. Copyright © 2010 Lippincott Williams & Wilkins.
9) Vernooij MW, Haag MD, van der Lugt A, et al. Use of antithrombotic drugs and the presence of cerebral microbleeds: the Rotterdam Scan Study. Arch Neurol 2009; 66:714.
10) Peca S, McCreary CR, Donaldson E, et al. Neurovascular decoupling is associated with severity of cerebral amyloid angiopathy. Neurology 2013; 81:1659.
11) Scolding, Neil J.; Joseph, Fady; Kirby, Patricia A.; Mazanti, Ingrid; Gray, Françoise; Mikol, Jacqueline; Ellison, David; Hilton, David A.; Williams, Timothy L.; MacKenzie, James M.; Xuereb, John H.; Love, Seth. (2005) Aβ-related angiitis: primary angiitis of the central nervous system associated with cerebral amyloid angiopathy.Brainvol. 128 issue 3 March. p. 500-515
12) Sakaguchi, Hideya; Ueda, Akihiko; Kosaka, Takayuki; Yamashita, Satoshi; Kimura, En; Yamashita, Taro; Maeda, Yasushi; Hirano, Teruyuki; Uchino, Makoto. (2011) Cerebral amyloid angiopathy-related inflammation presenting with steroid-responsive higher brain dysfunction: case report and review of the literature. Journal of Neuroinflammation vol. 8 issue 1 . p. 116



