IntrodušŃo:
O aumento de espessura da parede do ventrÝculo esquerdo (VE) pode dever-se a sobrecarga de pressŃo, hipertrofia dos miˇcitos de causa genÚtica ou ao depˇsito de substÔncias anˇmalas intra ou extra-celulares. Apesar de poder ser assintomßtica, surgindo como um achado num exame complementar, Ú essencial efectuar o diagnˇstico etiolˇgico pelas implicaš§es terapŕuticas e prognˇsticas. Apresenta-se um caso em que apenas a investigašŃo completa e sistematizada permitiu obter o diagnˇstico.
Caso clÝnico:
Homem caucasiano de 60 anos, assintomßtico, foi observado em consulta de Cardiologia para controlo do risco cardiovascular. Tinha antecedentes de hipertensŃo arterial >10 anos, controlada com valsartan+hidroclorotiazida 160mg/12,5mg e lercanidipina 10mg, hipercolesterolÚmia sob rosuvastatina 10mg, anomalia da glicÚmia em jejum, obesidade grau 1 e tabagismo prÚvio, em evicšŃo hß 20 anos. Na histˇria familiar nŃo havia referŕncia a doenša cardÝaca ou morte s˙bita.
Na observašŃo destacava-se: pressŃo arterial 138/81mmHg, frequŕncia cardÝaca 60 bpm e sopro sistˇlico grau II/VI, apical, com irradiašŃo axilar. No electrocardiograma (ECG) apresentava ritmo sinusal, frequŕncia de 55 bpm, desvio esquerdo do eixo elÚctrico, alteraš§es inespecÝficas da repolarizašŃo ventricular, sem critÚrios de voltagem para hipertrofia ventricular esquerda (HVE). Analiticamente sem alteraš§es relevantes.
Para esclarecimento do sopro cardÝaco realizou ecocardiograma transtorßcico (ETT) que mostrou ventrÝculo esquerdo de cavidade pequena, com hipertrofia concŕntrica de todas as paredes (ĹHVE simÚtricaĺ), mßxima ao nÝvel do septo interventricular (Fig.1-A) (21mm ľ referŕncia <10 mm);1 presenša de movimento sistˇlico anterior (SAM) do folheto anterior da vßlvula mitral, sem obstrušŃo significativa (gradiente mßximo intraventricular de 22mmHg em repouso); disfunšŃo diastˇlica grau I, provßvel elevašŃo das press§es de enchimento ventricular e dilatašŃo auricular esquerda (48ml/m2 ľ referŕncia <34 ml/m2).1
Com o objectivo de caracterizar a HVE realizou ressonÔncia magnÚtica cardÝaca (RM-C) que mostrou um padrŃo de realce tardio intramiocßrdico a nÝvel basal e mediano na parede Ýnfero-lateral, sugestivo de doenša de Anderson-Fabry (Fig.1-B). Esta suspeita excluiu-se pelo doseamento normal de α-galactosidase. Nesta faixa etßria, com HVE simÚtrica e RM-C sugestiva de infiltrašŃo, optou-se por descartar amiloidose atravÚs de imunofixašŃo de imunoglobulinas no sangue e urina, que foi negativa, e biˇpsia de gordura abdominal que revelou tecido adiposo sem substÔncia amilˇide. Perante os resultados negativos, sabendo-se da existŕncia de formas de deposišŃo miocßrdica preferencial, efectuou-se biˇpsia endomiocßrdica do VD e tambÚm do VE. Histologicamente havia fibrose intersticial e hipertrofia miocitßria sem padrŃo especÝfico, sem depˇsito de substÔncias anˇmalas, sinais inflamatˇrios ou neoplßsicos. (Fig.1-C e D)
Mantendo-se a d˙vida quanto Ó etiologia, pediu-se estudo genÚtico das proteÝnas sarcomÚricas que nŃo revelou mutaš§es patogÚnicas mas identificou variantes genÚticas rs2303510 e rs45533739 em homozigotia nos genes FHOD3 e TNNT2, respectivamente, que aumentam a susceptibilidade para miocardiopatia hipertrˇfica (MCH).2,3
Fez-se entŃo o diagnˇstico provßvel de MCH sarcomÚrica de instalašŃo tardia, tendo-se procedido Ó estratificašŃo de risco arrÝtmico do doente. Foi proposto rastreio aos familiares, que, mesmo depois de esclarecidos sobre a sua importÔncia, o recusaram.
DiscussŃo
A classificašŃo das miocardiopatias tem sido alvo de vßrias actualizaš§es que acompanham os avanšos na compreensŃo dos seus mecanismos fisiopatolˇgicos. Em 2008 a Sociedade Europeia de Cardiologia prop˘s um sistema de classificašŃo baseado na morfologia e funšŃo do VE, independentemente da etiologia,4 que se manteve nas recomendaš§es de 2014.5 Nesses documentos, a MCH Ú definida como um aumento da espessura das paredes do VE>15mm no adulto, nŃo explicßvel por condiš§es de sobrecarga. Esta definišŃo inclui os casos de hipertrofia dos miˇcitos de causa genÚtica, bem como algumas situaš§es de infiltrašŃo intersticial ou acumulašŃo de substÔncias intracelulares condicionando aumento da espessura ventricular.
Esta abordagem implica excluir situaš§es de sobrecarga de pressŃo ventricular que originem hipertrofia miocßrdica compensatˇria. As mais frequentes nos adultos sŃo a hipertensŃo arterial e a estenose aˇrtica, podendo tambÚm ocorrer em atletas de alta competišŃo. Neste caso, o diagnˇstico diferencial colocou-se com a cardiopatia hipertensiva, embora a espessura parietal>15mm favorecesse o diagnˇstico de MCH.5
Cerca de 60% dos casos de MCH surgem por mutaš§es autossˇmicas dominantes nos genes das proteÝnas sarcomÚricas, denominando-se ôMCH sarcomÚricaö5 e afectando 1/500 indivÝduos da populašŃo.6 Menor percentagem (5-10%) deve-se a um conjunto de doenšas infiltrativas, metabˇlicas, endocrinolˇgicas, neuromusculares, mitocondriais ou sÝndromes malformativos. Infelizmente nŃo Ú possÝvel chegar ao diagnˇstico etiolˇgico em cerca de 25-30% dos casos. Quando diagnosticada em adulto, a lista de causas nŃo relacionadas com as proteÝnas sarcomÚricas diminui, incluindo fundamentalmente a doenša de Fabry e a amiloidose cardÝaca. Ainda assim, as diferentes etiologias tŕm significados distintos quanto a tratamento, prognˇstico e implicaš§es familiares, pelo que a suspeita de MCH deve desencadear a procura da causa subjacente, seguindo uma abordagem diagnˇstica faseada. (Fig 2)
A avaliašŃo do doente comeša na histˇria clÝnica. Muitos portadores de MCH sŃo assintomßticos, sendo a sua detecšŃo um achado fortuito. Quando sintomßticos, podem referir angor de esforšo ou em repouso, palpitaš§es, sintomas de insuficiŕncia cardÝaca ou sÝncope.5 Nesta avaliašŃo deve ser incluÝda a histˇria familiar, identificando os casos de morte s˙bita, transplante cardÝaco, implantašŃo de pacemaker ou cardiodesfibrilhador, sintomas de insuficiŕncia cardÝaca inexplicßvel ou doenšas sistÚmicas associadas a MCH.5
O exame fÝsico pode igualmente ser inocente ou identificar um sopro sistˇlico de ejecšŃo tÝpico de obstrušŃo do tracto de saÝda VE - no bordo esquerdo do esterno, irradiando ao ßpex, que aumenta de intensidade com manobra de Valsalva. ╔ igualmente importante identificar sintomas e sinais extra-cardÝacos que sugiram doenšas especÝficas nŃo-sarcomÚricas como por exemplo surdez, cataratas, dor neuropßtica e angioqueratomas (na doenša de Fabry) ou sÝndrome nefrˇtico, sÝndrome do canal cßrpico, macroglossia, p˙rpura peri-orbitßria e parestesias (na amiloidose).7,8
No electrocardiograma, embora com baixa sensibilidade, as alteraš§es mais frequentes sŃo o aumento de voltagem do QRS, desvio esquerdo do eixo elÚctrico e aumento da durašŃo do QRS. Pode ainda existir inversŃo profunda e simÚtrica das ondas T precordiais quando a HVE Ú sobretudo apical; baixa voltagem Ú um achado paradoxal e sugere amiloidose.5
A ecocardiografia, essencial na abordagem diagnˇstica, avalia a espessura parietal e sua distribuišŃo e identifica a presenša de obstrušŃo dinÔmica do tracto de saÝda do VE por SAM da vßlvula mitral. Esta obstrušŃo, nŃo sendo patognomˇnica, estß presente em repouso em um teršo dos doentes com MCH e noutro teršo durante manobras que aumentam a sobrecarga ventricular (Valsalva). Determinadas caracterÝsticas ecocardiogrßficas podem evocar doenšas especÝficas: HVE assimÚtrica sugere MCH sarcomÚrica, enquanto a simÚtrica Ú mais comum em doenšas metabˇlicas e infiltrativas; o aspecto granulado do miocßrdio, a hipertrofia do septo inter-auricular e derrame pericßrdico sŃo sugestivos de amiloidose. No presente caso, o ecocardiograma foi equÝvoco pois a hipertrofia afectava todas as paredes. Por este motivo optou-se pela realizašŃo de RM-C, exame que deve ser considerado nos casos de MCH em que o ecocardiograma deixa d˙vidas. O realce tardio com gadolÝneo pode apresentar padr§es caracterÝsticos, fornecendo pistas para o diagnˇstico etiolˇgico: na MCH sarcomÚrica estß habitualmente presente nas ßreas de hipertrofia e nos pontos de inseršŃo anterior e posterior do VD; na doenša de Fabry Ú mais frequentemente observado na poršŃo basal da parede infero-lateral; na amiloidose assume uma distribuišŃo difusa subendocßrdica.9 No caso apresentado, o padrŃo era sugestivo de doenša de Fabry, que nŃo se confirmou.
Na marcha diagnˇstica da MCH, os testes laboratoriais destinam-se sobretudo Ó exclusŃo de doenšas especÝficas. A doenša de Fabry Ú diagnosticada pelos nÝveis reduzidos da enzima α-galactosidase A e, nas mulheres, tambÚm pela pesquisa de mutaš§es no gene GLA (Xq22).10 A imunofixašŃo sÚrica e urinßria de imunoglobulinas Ú ˙til no diagnˇstico de amiloidose primßria, devendo ser confirmado atravÚs de biˇpsia. O local mais acessÝvel Ú a gordura abdominal ľ positiva em 65-95% dos casos ľ seguindo-se as glÔndulas salivares e recto, ou a biˇpsia do ˇrgŃo afectado se estas forem inconclusivas e a suspeita se mantiver.8 Efectivamente, a biˇpsia endomiocßrdica estß recomendada quando hß suspeita de doenša infiltrativa, inflamatˇria ou de armazenamento impossÝvel de confirmar por outros mÚtodos.5 Foi o caso deste doente.
Porque a biˇpsia revelou hipertrofia miocitßria inespecÝfica, compatÝvel com etiologia sarcomÚrica, e porque o doente tinha descendŕncia em idade fÚrtil, optou-se pela realizašŃo do teste genÚtico que identificou polimorfismos facilitadores do aparecimento de MCH.2,3 O papel do teste genÚtico permanece ainda sob algum debate: por um lado o seu custo impede a realizašŃo em todos os doentes com diagnˇstico clÝnico de MCH, por outro lado a identificašŃo da mutašŃo especÝfica permite confirmar o diagnˇstico no caso-Ýndice e rastrear casos prÚ-sintomßticos entre os familiares ľ evitando-se vigilÔncia clÝnica prolongada em muitos indivÝduos. Assim, as orientaš§es europeias recomendam o teste genÚtico nos doentes que preenchem os critÚrios de MCH quando este permite o rastreio e aconselhamento dos familiares.5
Ainda que muitos doentes com MCH sarcomÚrica sejam assintomßticos, apresentam risco aumentado de insuficiŕncia cardÝaca, arritmias, sÝncope e morte s˙bita. Recomenda-se o seguimento regular ľ observašŃo clÝnica, ECG e ETT anual ou bianual - focado na detecšŃo precoce de disfunšŃo VE, obstrušŃo do tracto de saÝda VE e arritmias. Com base nessa avaliašŃo, os doentes podem ser candidatos a terapŕutica mÚdica ou colocašŃo de cardioversor-disfibrilhador implantßvel, para prevenšŃo de morte s˙bita cardÝaca.5 Por outro lado, o aparecimento recente de novas terapŕuticas dirigidas ao gene mutado ou Ós alteraš§es moleculares responsßveis pela doenša (sensibilidade das miofibrilhas ao cßlcio, desregulašŃo dos canais iˇnicos, etc.)11 constituem uma nova estratÚgia de prevenšŃo que torna ainda mais premente o diagnˇstico precoce.
Figura 1: Exames complementares de diagnˇstico
A - Ecocardiograma transtorßcico ľ VentrÝculo esquerdo em plano apical quatro cÔmaras
B - RessonÔncia magnÚtica cardÝaca ľ padrŃo de realce tardio com gadolÝnio ( → )
C - Biˇpsia Endomiocßrdica: Hematoxilina eosina - Miˇcitos hipertrofiados ( →), Fibrose (*).
D -Biˇpsia Endomiocßrdica: Tricˇmico de Masson - Miˇcitos hipertrofiados ( → ) Fibrose (*).
Figura 2 -Algoritmo de abordagem diagnˇstica da Hipertrofia Ventricular esquerda (adaptado de Elliot et al.5)
Figura I
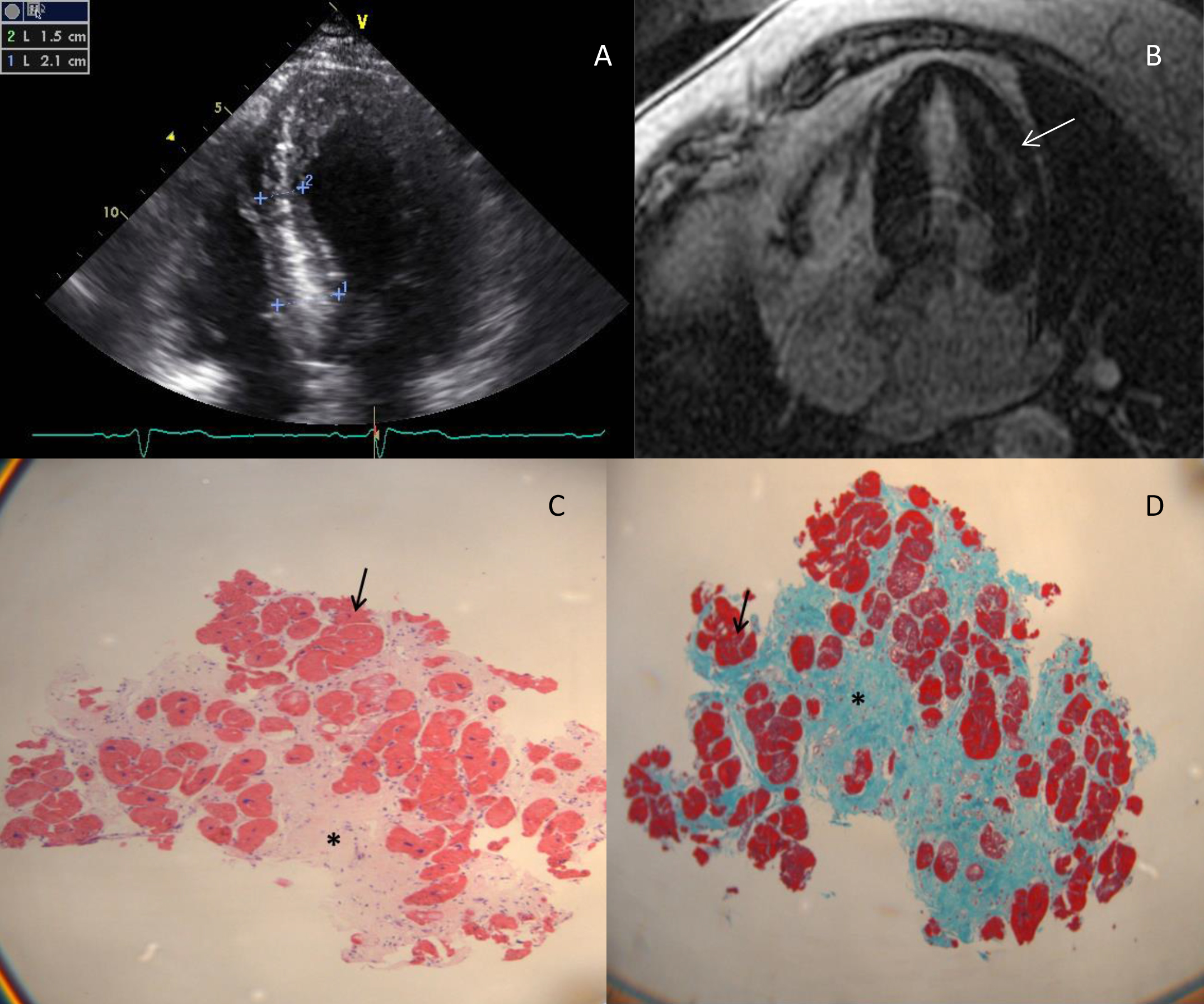
Figura 1: Exames complementares de diagnˇstico A - Ecocardiograma transtorßcico ľ VentrÝculo esquerdo em plano apical quatro cÔmaras B - RessonÔncia magnÚtica cardÝaca ľ padrŃo de realce tardio com gadolÝnio ( → ) C - Biˇpsia Endomiocßrdica: Hematoxilina eosina - Miˇcitos hipertrofiados ( → ), Fibrose (*). D -Biˇpsia Endomiocßrdica: Tricˇmico de Masson - Miˇcitos hipertrofiados ( → ) Fibrose (*).
Figura II
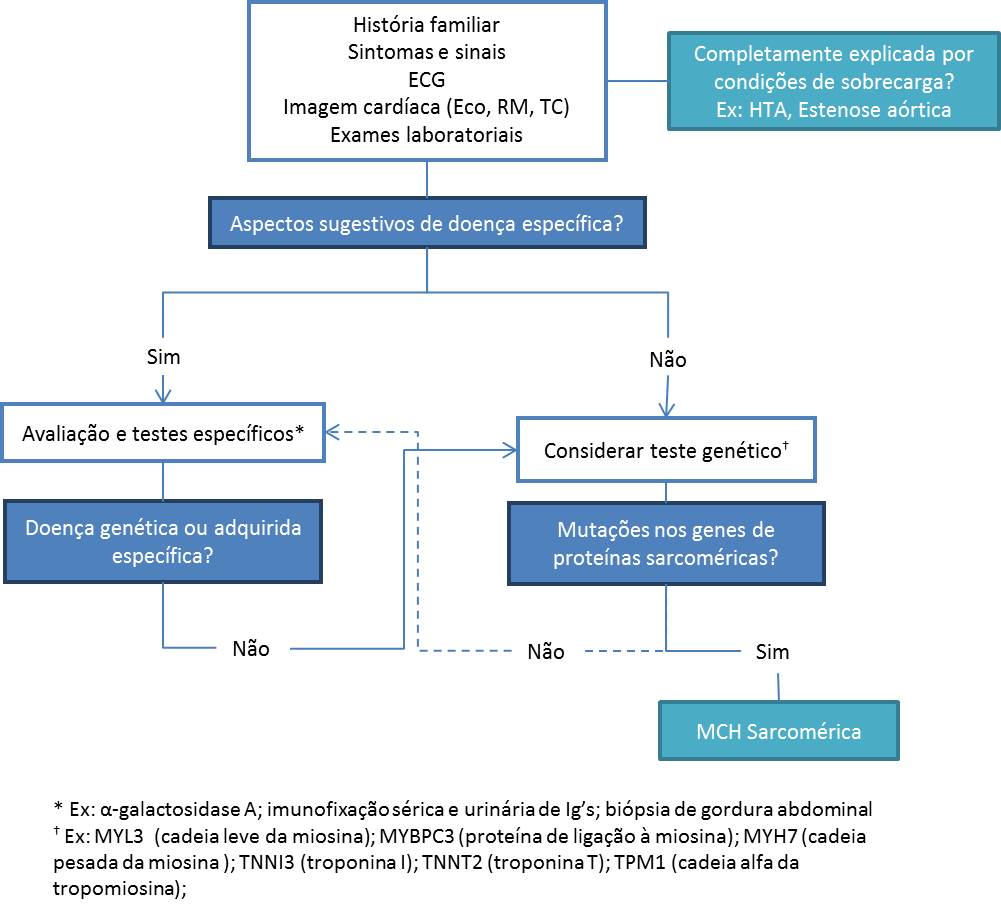
Algoritmo de abordagem diagnˇstica da Hipertrofia Ventricular esquerda (adaptado de Elliot et al.5)
BIBLIOGRAFIA
Referŕncias:
1. Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American society of echocardiography and the European association of cardiovascular imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233ľ71.
2. Wooten EC, Hebl VB, Wolf MJ, Greytak SR, Orr NM, Draper I, et al. Formin homology 2 domain containing 3 variants associated with hypertrophic cardiomyopathy. Circ Cardiovasc Genet. 2013;6(1):10ľ8.
3. Jßchymovß M, Muravskß a., Paleček T, Kuchynka P, Řehßkovß H, Magage S, et al. Genetic variation screening of TNNT2 gene in a cohort of patients with hypertrophic and dilated cardiomyopathy. Physiol Res. 2012;61(2):169ľ75.
4. Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, et al. Classification of the cardiomyopathies: a position statement from the european society of cardiology working group on myocardial and pericardial diseases. Eur Heart J. 2007;29(2):270ľ6.
5. Elliott PM, Anastasakis a., Borger M a., Borggrefe M, Cecchi F, Charron P, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;2733ľ79.
6. Maron BJ, Gardin JM, Flack JM, Gidding SS, Kurosaki TT, Bild DE. Prevalence of Hypertrophic Cardiomyopathy in a General Population of Young Adults : Echocardiographic Analysis of 4111 Subjects in the CARDIA Study. Circulation. 1995 Aug 15;92(4):785ľ9.
7. Rapezzi C, Arbustini E, Caforio ALP, Charron P, Gimeno-Blanes J, Heli÷ T, et al. Diagnostic work-up in cardiomyopathies: Bridging the gap between clinical phenotypes and final diagnosis. A position statement from the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(19):1448ľ58.
8. Seldin DC, Berk JL, Sam F, Sanchorawala V. Amyloidotic Cardiomyopathy: Multidisciplinary Approach to Diagnosis and Treatment. Heart Fail Clin. 2011;7(3):385ľ93.
9. Mahrholdt H, Wagner A, Judd RM, Sechtem U, Kim RJ. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies. Eur Heart J. 2005;26(15):1461ľ74.
10. Correia E, Vidinha J, Rodrigues B, Santos L, Moreira D, Garrido J, et al. [Description of a new mutation in a female patient with Fabry disease]. Rev Port Cardiol orgão Of da Soc Port Cardiol = Port J Cardiol an Off J Port Soc Cardiol. 2011 Oct 1;30(10):789ľ93.

