Introdução
A Síndrome de Churg-Strauss (SCS) é uma vasculite que envolve vasos de pequeno e médio calibre e se caracteriza pela presença de asma, rinosinusite, eosinofilia periférica e sinais de vasculite multissistémica. É uma síndrome rara, de etiologia desconhecida, sem predileção por sexo ou faixa etária. Anticorpos citoplasmáticos antineutrófilos (ANCA) estão presentes em cerca de 40% a 60% dos casos, permitindo incluir esta entidade no espectro das vasculites associadas a ANCA1. Os corticóides alteraram dramaticamente o prognóstico da SCS, bem como os imunossupressores e as mais recentes terapias biológicas2.
Caso clínico
Homem de 28 anos com antecedentes de Asma Brônquica medicada com budesonida e formoterol e episódios recorrentes de dispneia sibilante associada a tosse produtiva com secreções respiratórias mucopurulentas de predomínio noturno. Não refere outros antecedentes patológicos ou medicação habitual. Recorreu ao Serviço de Urgência por quadro, com 3 semanas de evolução, de dispneia e broncorreia, epigastralgia, perda ponderal de 10 Kg, mialgias afetando predominantemente os membros inferiores com diminuição progressiva da força muscular impedindo marcha autónoma. Não referiu disfagia, fatigabilidade ou alterações esfincterianas. No exame físico destacavam-se atrofia muscular generalizada, principalmente afetando os grupos musculares das mãos; ausência de reflexos aquilianos; hipoestesia álgica no território do nervo cubital e em peúga alta pelo joelho bilateralmente; sem alterações da sensibilidade postural ou disfunção cerebelosa. Na avaliação laboratorial sublinhava-se a importância de leucocitose e eosinofilia (44 300/mm3 e 67% respectivamente), na ausência de alterações das outras séries de elementos figurados; função renal, ionograma, enzimas hepatobiliares e estudo da coagulação dentro dos valores de normalidade; sedimento urinário normal; teste de tuberculina e marcadores VIH negativos; factor reumatóide de 296,0 UI/mL (Normal <20); ANCA- PR3 de 0,5 UI/mL (negativo se <2); ANCA-MPO> 134 UI/mL (positivo se> 5,0 UI/mL); proteinograma com hipergamaglobilinemia; IgE de 1372 kU/L (normal <85kU/L). As telerradiografias torácicas seriadas revelaram infiltrados alveolares migratórios. Efectuou uma Tomografia axial computadorizada (TAC) torácica com padrão pulmonar em vidro despolido e aparente acentuação dos septos interlobulares (Fig.1). Num lavado broncoalveolar com contagem celular diferencial detectou-se eosinofilia intensa. Num estudo anatomo-patológico de produto de biópsia gástrica não se comprovou a presença de vasculite estando presentes aspectos de inflamação no antro e corpo cujo componente celular incluía eosinófilos (Fig.2. Realizou um electromiograma cujo resultado foi compatível com lesão axonal grave dos nervos mediano esquerdo e cubital, peroneal e tibial bilateralmente. Foi considerado o diagnóstico de Síndrome de Churg-Strauss tendo iniciado terapêutica com 1 g de metilprednisolona endovenosa durante 3 dias e posteriormente 60mg/dia de prednisolona associada a pulsos endovenosos mensais de 40mg de ciclofosfamida. Perante quadro neuropático grave com limitação funcional foi estabelecido programa de reabilitação física. Conseguida a resolução das queixas gástricas e respiratórias com normalização da eosinofilia e leucocitose, iniciou redução progressiva de corticóide nos 6 meses seguintes. Manteve parestesias ligeiras não incapacitantes dos membros inferiores, retomando atividade laboral na construção civil. E com posologia de manutenção com metotrexato 12,5g/semana e prednisolona 5mg/dia, não apresenta alterações dos perfis hematológico e bioquímico. Mantem seguimento regular em consulta de Medicina Interna.
Discussão
O American College of Reumathology3 definiu a SCS como provável se existirem quatro dos seis critérios expostos na Tabela 1.
A presença de fatores confundidores faz com que os pacientes permaneçam com terapêutica apenas dirigida para a asma ou rinite até que o aparecimento de outros achados clínicos, laboratoriais ou imagiológicos sugiram o diagnóstico de SCS. Perante o diagnóstico de asma de difícil controlo, as doenças que mimetizam ou estão associadas à Asma Brônquica (más condições ambientais, hábitos tabágicos, incumprimento terapêutico) devem ser excluídas4.
Um dos diagnósticos diferenciais mais frequentes faz-se com a Aspergilose Broncopulmonar alérgica, a qual se apresenta com bronquiectasias centrais e aumento da IgE. A inexistência de doença multissistémica diferencia este tipo de aspergilose da SCS2.
A pneumonia eosinofílica crónica cursa com febre, dispneia, tosse e perda ponderal, sabendo-se que a maioria dos pacientes sofre de asma. A elevação da contagem de eosinófilos em amostra sanguínea periférica e lavado broncoalveolar está presente em cerca de 90% dos casos. Contudo, a ausência de atingimento multiorgânico e de infiltrados pulmonares na imagem torácica, diferencia estas duas entidades nosológicas1.
Outro diagnóstico diferencial a considerar é a síndrome hipereosinofílica idiopática. À semelhança da SCS, esta patologia tem envolvimento multissistémico, mas pode ser distinguida da Síndrome de Churg-Strauss por uma contagem de eosinófilos no sangue periférico> 1500/mm3 por mais de seis meses. Assim, os achados clínicos e laboratoriais bem como o curso da doença podem ser critérios diferenciadores destas duas síndromes5.
O tratamento é semelhante nas várias vasculites associadas a ANCA e consiste em duas fases: a de indução e a segunda de manutenção.
Os corticoides sistémicos são o tratamento de primeira linha. A prednisolona na dose de 1 mg/kg pode ser iniciada em doentes que não apresentem um comprometimento sistémico grave2. Nos doentes com envolvimento multiorgânico pode ser administrado 1 g de metilprednisolona endovenosa por 3 dias, seguido de 40 a 60 mg/dia de prednisolona. Após o início da corticoterapia é expetável a diminuição dos sintomas de vasculite e dos parâmetros inflamatórios6.
A ciclofosfamida é associada ao tratamento com corticoides, nos doentes com atingimento multissistémico grave, podendo ser administrada em pulsos endovenosos mensais, numa dose de 0,6 g/m2/mês ou de forma contínua, por via oral, em baixa dose (2 mg/kg/dia). A dose de ciclofosfamida pode ser reduzida em 25 mg nos doentes com mais de 60 anos. Em doentes sem envolvimento multissistémico grave, a ciclofosfamida pode ser substituída por metotrexato6.
A ocorrência de efeitos acessórios dos fármacos empregues na terapêutica (42% das situações) constituiu um dos obstáculos ao sucesso terapêutico.
O seguimento clínico e laboratorial do doente é fundamental constituindo a mielossupressão uma das preocupações essenciais, a par do possível surgimento de neoplasia da bexiga, ou de doença linfoproliferativa6.
Atingida a remissão, que acontece geralmente entre três a seis meses, inicia-se a fase de manutenção na qual a ciclofosfamida deve ser substituída por azatioprina. Esta fase deve ter uma duração mínima de 18 meses7. Quando o envolvimento renal não é significativo (creatinina sérica <1,7 mg/dL), o micofenolato mofetil, o metotrexato e a leflunomida podem ser utilizados como alternativas à azatioprina8.
Os agentes biológicos revelam-se promissores no panorama terapêutico da SCS, pela sua eficácia associada a menor toxicidade. O rituximab é um anticorpo monoclonal quimérico anti-células B CD20+ que induz seletivamente a depleção de células B por estímulo direto da apoptose, citotoxicidade dependente de anticorpos e dependente do complemento. Este agente pode ser utilizado como terapêutica de resgate em pacientes refratários ao tratamento convencional ou com contraindicação a esquemas com ciclofosfamida7.
Com a introdução da corticoterapia o prognóstico da SCS alterou-se dramaticamente, com 90% de sobrevida um ano após o diagnóstico, 62-75% em cinco anos e 50% em sete anos. Os fatores associados a mau prognóstico e elevada mortalidade são: envolvimento cardíaco, gastrointestinal, do sistema nervoso central e renal (proteinúria> 1 g/24h, creatinina sérica> 1,6 g/dL). Mais de 90% dos doentes atingem remissão8. Os défices neurológicos motores apresentam uma resolução mais célere que a componente sensitiva, a qual tende a evoluir de forma indolente e, por vezes, com parestesias sequelares. A recorrência de manifestações clínicas da SCS, surge em cerca de 1/4 dos casos, metade das quais no primeiro ano, sendo geralmente precedidas por uma elevação da contagem de eosinófilos8.
Apesar de pouco comum, a Síndrome de Churg-Strauss deve ser considerada como diagnóstico diferencial na asma de difícil controlo, dada a dramática alteração no prognóstico desta doença motivada pelo tratamento atualmente disponível.
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo.
Este trabalho foi apresentado no 19º Congresso Nacional de Medicina Interna e 12th Congress of Internal Medicine.
Quadro I
Critérios do American College of Rheumathology (1990) para diagnóstico de Síndrome de Churg-Strauss
| |
| |
| Asma |
| Eosinofilia superior a 10% no sangue periférico |
| Neuropatia, mononeuropatia, polineuropatia |
| Infiltrados pulmonares |
| Alterações dos seios nasais |
| Infiltrado extravascular e tecidular de eosinófilos |
Síndrome de Churg-Strauss provável quando 4 critérios se encontram presentes
Figura I
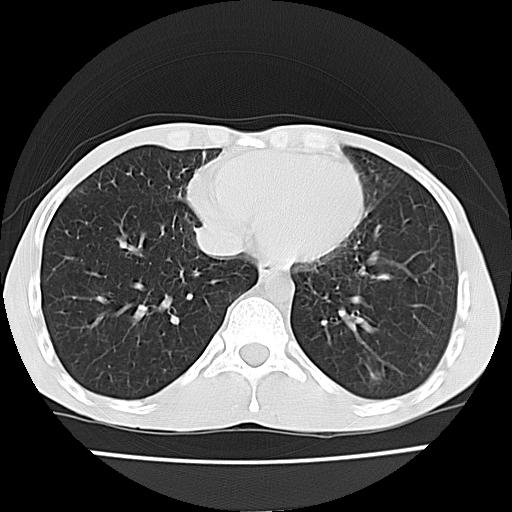
TAC torácica revelando padrão em vidro despolido.
Figura II
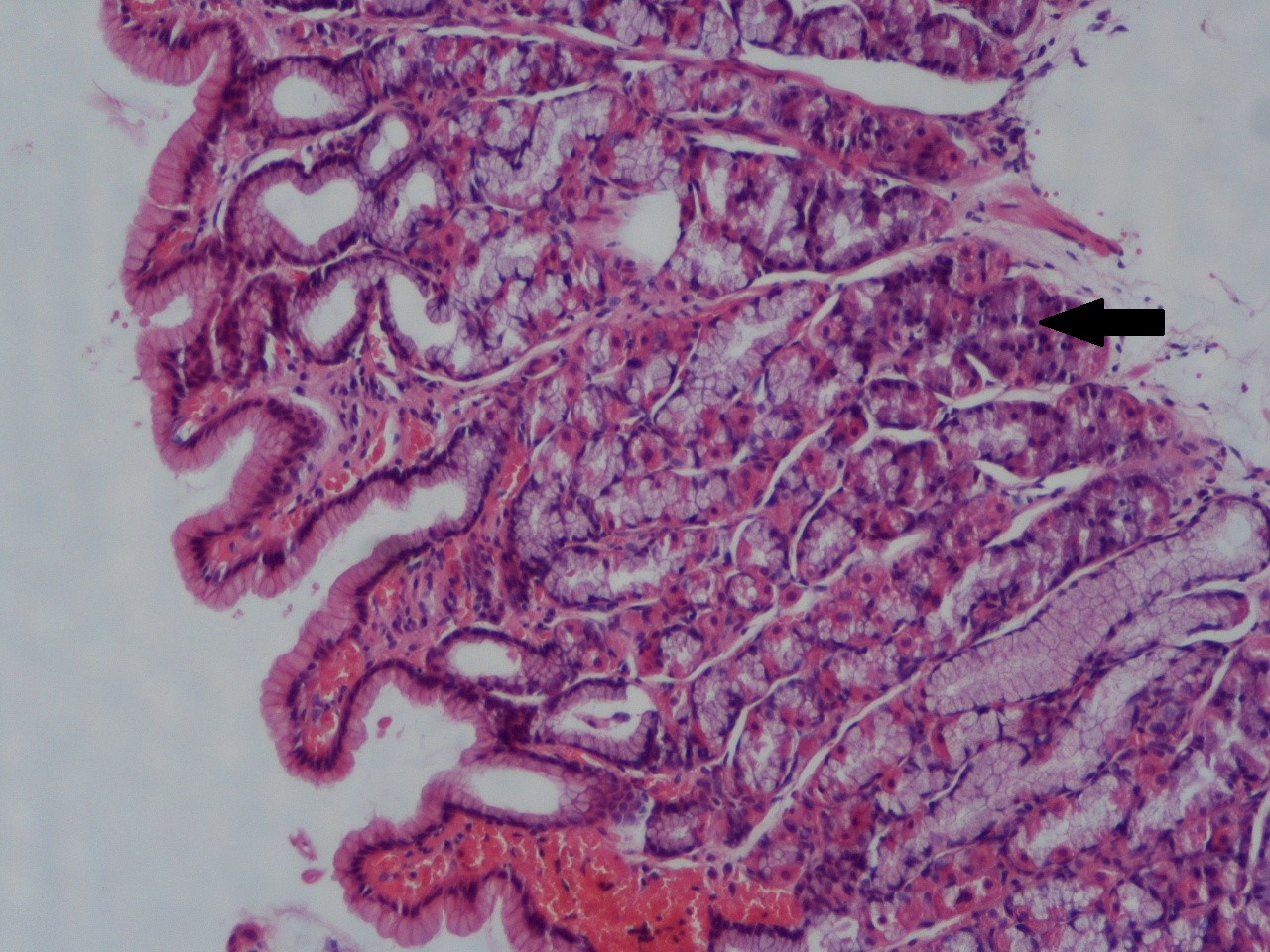
Estroma gástrico evidenciando elevado número de eosinófilos (seta). Coloração com Hematoxilina e Eosina.
BIBLIOGRAFIA
1. Gioffredi A, Maritati F, Oliva E, Buzio C. Eosinophilic Granulomatosis with Polyangiitis: an overview. Front Immunol. 2014; 5:549.
2. Pagnoux C. Updates in ANCA-associated vasculitis. Eur J Rheumatol. 2016 Sep; 3(3): 122–133.
3. Masi AT, Hunder GG, Lie JT, Michel BA, Bloch DA, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis) Arthritis Rheum.1990;33:1094–100.
4. Araujo AC, Ferraz A, Borges MC, et al. Investigação de fatores associados à asma de difícil controle. J Bras Pneumol. 2007; 33:495 – 501.
5. Cogan E, Roufosse F. Clinical management of the hypereosinophilic syndromes.Expert Rev Hematol.2012;5:275–289.
6. Mukhtyar C, Guillevin L, Cid MC, Dasgupta B, de Groot K, Gross W, Hauser T, et al. EULAR recommendations for the management of primary small and medium vessel vasculitis. Ann Rheum Dis.2009; 68(3):310-317.
7. Stone JH, Merkel PA, Spiera R, Seoo P, Langford CA, Hoffman GS, Kallenberg CG, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med.2010 Jul 15;363(3):221-32.
8. Guillevin L, Pagnoux C, Karras A, Khouatra C, Aumaître O, Cohen P, Maurier F, et al. Rituximab versus Azathioprine for maintenance in ANCA-associated vasculitis. N Engl J Med 2014;371:1771-80.



