Introdução
Os tumores do estroma gastrointestinal, designados genericamente na literatura internacional pela sigla “GIST”, derivada da nomenclatura anglo saxónica “Gastrointestinal Stromal Tumours”, são tumores mesenquimatosos com origem preferencial, embora não exclusiva, no tubo digestivo.1
A apresentação clínica destes tumores é muito variável, cursando frequentemente com sintomatologia inespecífica, dependente da localização e das dimensões da lesão.2 Frequentemente constituem achados fortuitos em estudos radiológicos ou endoscópicos.3,4
Mesmo quando implantados em segmentos do tubo digestivo endoscopicamente acessíveis, o diagnóstico pode não ser imediato, como se verifica no caso apresentado.
Caso clínico:
Doente sexo feminino, 77 anos, que recorreu ao Serviço de Urgência por quadro de náuseas, vómitos alimentares recorrentes , anorexia e dor abdominal difusa com cerca de uma semana de evolução.
Negava outras queixas, nomeadamente febre, emagrecimento ou alterações do trânsito intestinal.
Antecedentes pessoais de hioertensão arterial, dislipidémia e Diabetes Mellitus tipo II. Antecedentes familiares eram irrelevantes.
Habitualmente medicada com domperidona, esomeprazol, linagliptina, glimepirida, nifedipina, nebivolol, perindopril e sinvastatina / ezitimib.
Objetivamenta apresentava-se vígil, colaborante, apirética, normotensa. Pele e mucosas descoradas e com sinais de desidratação.
Abdómen difusamente doloroso, sem defesa, sem massas palpáveis ou organomegálias. Murphy vesicular negativo. Sem evidências de ascite. Sem outras alterações relevantes.
Analiticamente destacava-se Hb 10.2 g; VGM 84 fl; leucocitos 10.4 x106; 83% de neutrófilos e 32% de linfocitos ;plaquetas 269 x103;
glicémia 62 mg/dL;urémia 120mg/dL; creatinina 6.3mg/dL;
Na 141 mmol/L; K 5.9mmol/L; Cl 110 mmol/L;
AST 28 UI/L;ALT 30 UI/L; GGT 66UI/L; fosfatase alcalina 95 UI/L;
bilirrubina total 0.07 mg/dL; amilase 124 mg/dL;
A radiografia simples do abdómen não mostrava níveis líquidos ou outras alterações.
Após medidas de hidratação e de estabilização da função renal procedeu-se a endoscopia digestiva alta que identificou, ao nível da grande curvatura, na transição corpo/antro, formação sub-epitelial polipóide com cerca de 6 cm, revestida por mucosa de aspeto normal. Foi efetuada biopsia, compatível com gastrite crónica ligeira, não atrófica.
Para melhor caraterização da lesão foi solicitada ecoendoscopia que detetou lesão subepitelial na vertente anterior da grande curvatura, hipoecogénica, medindo 20 x 10 mm no plano axial, bem delimitada, na dependência da segunda camada. Apresentava ecoestrutura homogénea, sem sinais invasivos das camadas subjacentes.
Efetuou-se punção com agulha para estudo citológico que demonstrou esfregaço com agregados de células fusiformes, com citoplasma eosinófilo e núcleos com pleomorfismo moderado, dispostas em feixes entrecruzados no seio de estroma muito denso, sugerindo tumor mesenquimatoso.
A tomografia axial computorizada (TAC) abdominal identificou volumosa massa quística lobulada em aparente contiguidade com a parede anterior do antro gástrico, medindo 13,7 x 7,9 x 16,8 cm, com cerca de 2 cm de massa procidente no lúmen gástrico suspeita de atipia, exercendo compressão extrínseca sobre o cólon transverso, sem sinais de invasão ( Fig.s 1 e 2).
A doente foi submetida a laparotomia com gastrectomia linear atípica. A peça operatória tinha 6x4cm de maiores eixos, observando-se um tumor com 15x13,5x4cm, envolvendo toda a espessura da parede, sem compromisso da mucosa. A superfície externa era lisa, lobulada com áreas de laceração, a maior com 2,5 cm. Em secção era parcialmente quística, com áreas heterogéneas, de coloração branco-amarelada, com áreas hemorrágicas; a componente quística apresentava-se multilobulada, contendo conteúdo líquido acastanhado.
O estudo anatomopatológico (Fig.s 3 e 4) identificou células fusiformes com áreas de degenerescência quística e esclerose, sem necrose; o estudo imunohistoquimico foi positivo para DOG-1, vimentina, CD34, CD117 e Ki-67 (índice proliferativo <3%); índice mitótico era de 1x 50HPF. Este padrão mostrou-se compatível com o diagnóstico de tumor do estroma gastrointestinal (GIST).
Perante o disgnóstico de GIST, e tratando-se de um tumor de grandes dimensões (superior a 10 cm), encaminhou-se a doente para consulta de oncologia onde foi instituída terapêutica adjuvante com inibidores da Tirosina Kinase (Imatinib) por um período programado de dois anos, encontrando-se clinicamente bem após oito meses de quimioterapia.
Discussão:
Os GIST representam cerca de 3% dos tumores do tubo digestivo e podem ocorrer em qualquer segmento do trato gastrointestinal.4,5 A localização gástrica é a mais frequente, seguida da intestinal, sendo mais rara a topografia esofágica, retal ou apendicular.3,6 Estão também descritos casos de implantação peritoneal, mesentérica e retroperitoneal.3,5 São tumores raros com uma incidência anual estimada de 1 a 1.5 /100.000.7 Ocorrem predominantemente a partir dos 65 anos de idade e mostram distribuição idêntica pelos dois géneros .1,8
A maioria dos casos tem uma incidência esporádica, sendo, porém, conhecidas ocorrências de carater familiar, de transmissão autossómica dominante7,9 Uma percentagem pequena de casos manifesta-se sob a forma de síndrome tumoral, nomeadamente em associação com Neurofibromatose Tipo I ou constituindo a tríade de Carney que engloba tumor gástrico, condroma pulmonar e paraganglioma extra-adrenal.7,10
Os GIST foram primitivamente classificados como tumores originários do tecido muscular liso, e só na década de 80 do século passado foi reconhecida a sua origem mesenquimatosa, derivando das células intersticiais de Cajal presentes no plexo mioentérico.3,4
No estudo histoquímico é praticamente constante a expressão antigénica de CD 117, sendo também a de CD 34 muito frequente.11 Mas a principal característica destes tumores, identificada no final dos anos 90 do século anterior, é a presença de uma mutação a nível dos recetores da proteína tirosino quinase (c-KIT) e do fator de crescimento derivado de plaquetas alfa ( PDGFRA).1,2
O diagnóstico é frequentemente dificultado pela inespecificidade da apresentação clínica, sendo as náuseas, os vómitos e o desconforto abdominal as manifestações mais comuns.2 As complicações major tendem a instala-se quando a dimensão tumoral ultrapassa os 4 cm, podendo nestes casos condicionar quadros de hemorragia digestiva, disfagia, oclusão intestinal ou efeito compressivo, em função da topografia tumoral.11
Os GIST de localização gástrica têm um crescimento frequentemente exofítico, com fraca expressão endoluminal, que se manifesta habitualmente sob a forma polipoide ou apenas por abaulamento da parede do estômago, sem invasão da mucosa, como se verificou no caso descrito.4,6 Nestas circunstâncias a biopsia endoscópica é normalmente negativa,8 como se constatou no presente caso.
A ecoendoscopia e a TAC constituem os meios auxiliares de diagnóstico de eleição para avaliação das dimensões tumorais.8 O diagnóstico definitivo é histológico, com caraterização histoquímica.4,8
O comportamento deste tipo de tumores é incerto, mostrando graus variáveis de agressividade. Os GIST de localização gástrica têm uma evolução para malignidade em 20 a 25% dos casos, risco que aumenta para 40 a 50% nos que têm origem no intestino delegado.3 Os critérios de malignidade assentam essencialmente nas dimensões da lesão tumoral, no índice mitótico e na topografia de implantação.12 Tumores com mais de 5 cm de diâmetro e com índice mitótico superior a 5 são considerados de alto risco. Dimensões tumorais superiores a 10 cm, independentemente do índice mitótico, ou com índice mitótico superior a 10, em qualquer dimensão tumoral, preenchem igualmente critérios de risco elevado.12 As implantações extragástricas tendem também a evoluir com pior prognóstico.1,5
Cerca de 80% dos GIST estão localizados ao órgão afetado no momento do diagnóstico, mas a metastização pode ocorrer, envolvendo predominantemente o fígado e o peritoneu, e muito raramente o pulmão, o osso, o sistema nervoso central e os gânglios linfáticos.10,13
Contudo, dado o potencial de disseminação à distância, é prudente estabelecer planos terapêuticos e de vigilância adequados a cada caso.8,11 No caso de GIST de localização gástrica não metastizado, a resseção cirúrgica completa constitui a terapêutica eletiva.14 Nos tumores com dimensões inferiores a 2 cm, a remoção completa é considerada curativa.4,8,13 A taxa de sobrevivência ao 10 anos, nos casos operáveis, ronda os 60 %.13
A quimioterapia com o inibidor da Tirosina Kinase, Imatinib, está formalmente indicada nas situações em que não é possível a excisão completa da lesão tumoral, ou na presença de metástases.5,7 Nos tumores ressecáveis, mas que apresentam critérios de elevado risco de recidiva, quer pelas dimensões tumorais, como era o caso descrito, quer pelo índice mitótico, a quimioterapia adjuvante pós cirurgia tem sido cada vez mais preconizada, embora, para vários autores subsistam dúvidas quanto ao tempo de duração da terapêutica.13,14 No entanto, as recomendações da European Society for Medical Oncology (ESMO) indicam um período de tratamento standard de três anos nos doentes em que o risco de recidiva seja previsivelmente elevado.15
Apesar de a maioria das massas sub epiteliais gástricas serem de carater benigno, é imprescindível estabelecer um diagnóstico definitivo correto, o qual pode ser subvalorizado perante o aspeto muitas vezes inocente da imagem endoscópica.
Figura I
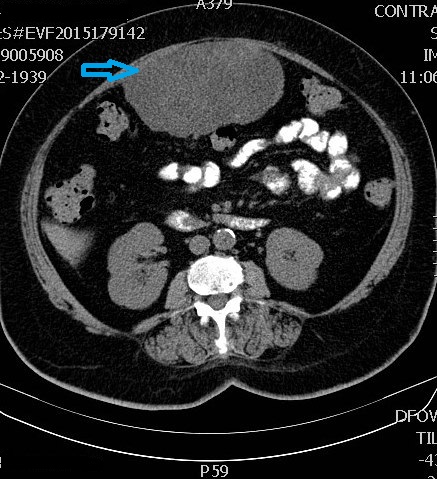
Volumosa massa quística lobulada em contiguidade com a parede anterior do antro gástrico
Figura II
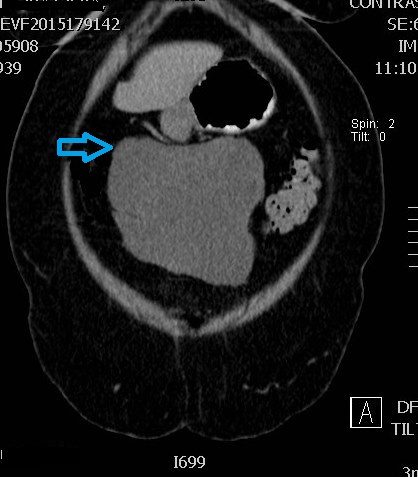
Compressão extrínseca sobre o cólon transverso, sem sinais de invasão
Figura III
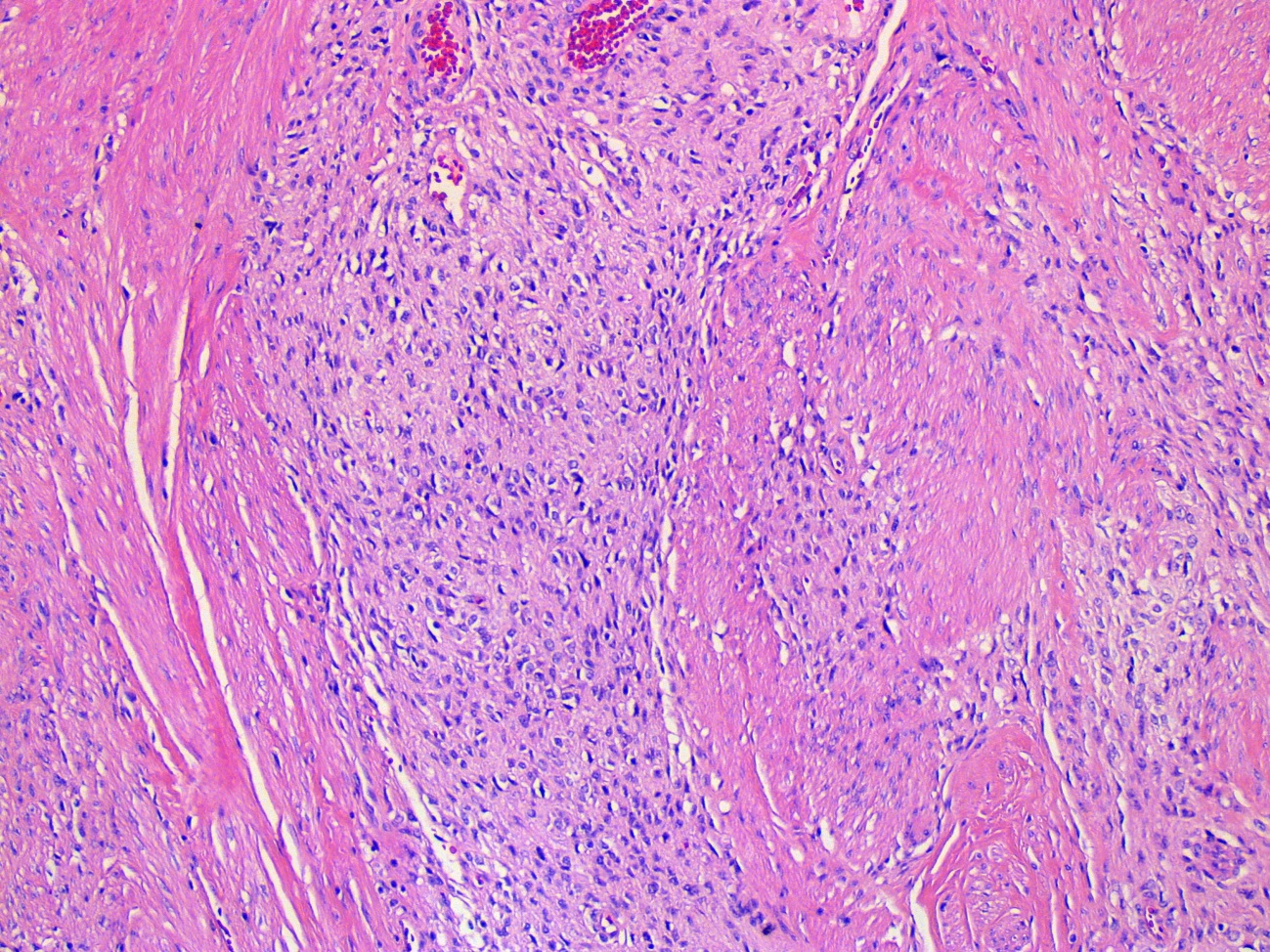
Neoplasia fuso celular com células dispostas em feixes sem imagens de necrose
Figura IV
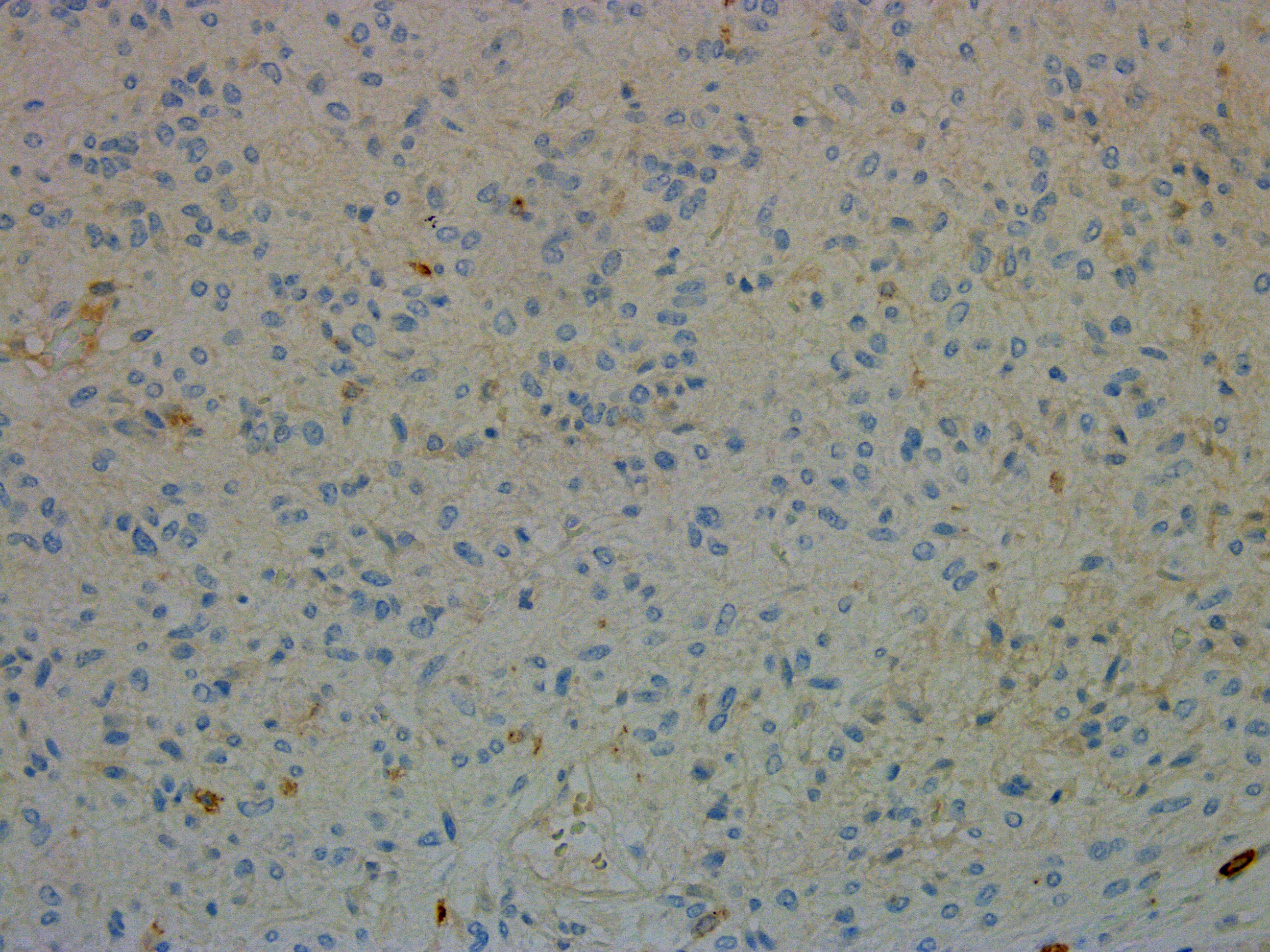
Marcação para CD 117
BIBLIOGRAFIA
1.Demetri G D, Mehren M, Antonescu C R et al. NCCN Task Force Report: Update on the Management of Patients with Gastrointestinal Stromal Tumors .J Natl Compr Canc Netw. 2010 April ; 8(0 2): S1–S44.
2.Søreide K, Sandvik OM, Søreide JA et al. Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol. 2016 Feb;40:39-46.
3.Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med. 2006 Oct;130(10):1466-78.
4.Kang HC, Menias CO, Gaballah AH et al. Beyond the GIST: mesenchymal tumors of the stomach. Radiographics. 2013 Oct; 33(6):1673-90
5.Al-Thani H, El-Menyar A, Rasul K et al. Clinical presentation, management and outcomes of gastrointestinal stromal tumors. Int J Surg. 2014 Oct;12(10):1127-33
6.Kim SW, Kim HC, Yang DM, Won KY. Gastrointestinal stromal tumours (GISTs) with a thousand faces: atypical manifestations and causes of misdiagnosis on imaging. Clin Radiol. 2016 Feb;71(2):e130-42
7.ESMO/European Sarcoma Network Working Group. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014 Sep;25 Suppl 3:iii21-6
8.Akahoshi K, Oya M. Gastrointestinal stromal tumor of the stomach: How to manage? World J Gastrointest Endosc. 2010 August 16; 2(8): 271-7
9.Bhatt NR, Collins D, Crotty P, Ridgway PF. Prognosis and management of adult wild type gastrointestinal stromal tumours (GISTs): A pooled analysis and review of literature. Surg Oncol. 2016 Sep;25(3):152-7
10.O´Regan KN, Shinagare AB, Saboo SS et al. Gastrointestinal stromal tumors (GIST): lesser known facts. Clin Imaging. 2013;37(5):821-9
11.Úria S, Cachado AP, Garcia T. GIST- Gastrointestinal Stromal Tumors. Acta Med Port .2011; 24 (6): 1075-78
12.Jones RL. Practical aspects of risk assessment in gastrointestinal stromal tumors. J Gastrointest Cancer. 2014 Sep;45(3):262-7
13.Joensuu H, Martin-Broto J, Nishida T et al. Follow-up strategies for patients with gastrointestinal stromal tumour treated with or without adjuvant Imatinib after surgery. Eur J Cancer. 2015 Aug;51(12):1611-7
14.Schwameis K, Fochtmann A, Schwameis M et al. Surgical treatment of GIST-an institutional experience of a high-volume center. Int J Surg. 2013;11(9):801-6.
15.ESMO/European Sarcoma Network Working Group.Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014 Sep;25 Suppl 3:iii21-6.

