Introdução:
A miocardite é uma doença inflamatória do miocárdio causada por uma variedade de doença infecciosas e não infecciosas. A apresentação clínica mais frequente é a insuficiência cardíaca aguda, no entanto o espectro clínico é variado, desde formas subclínicas assintomáticas com cardiomiopatia dilatada e disfunção ventricular, até à dor torácica aguda que simula um síndrome coronário agudo ou uma arritmia maligna com morte cardíaca súbita1.O diagnóstico definitivo é estabelecido pela biópsia do endomiocárdio através de critérios imunohistoquímicos e histológicos2. O desenvolvimento de técnicas de biologia molecular, como a PCR e a hibridização in situ, atualmente têm um papel importante no diagnóstico etiológico permitindo a identificação de um patogéneo específico (Fig. 1)3.Os autores apresentam o caso clínico de um doente com miocardite a Parvovírus B19 (Pv-B19) em que um estudo aprofundado e invasivo permitiu a confirmação diagnóstica e a definição de uma estratégia terapêutica dirigida.
Caso Clínico:
Doente do sexo masculino, 32 anos de idade, admitido no Serviço de Urgência de um hospital distrital por dispneia para esforços com agravamento progressivo para repouso, tosse seca e astenia com três semanas de evolução. No dia da admissão teve 3 dejecções aquosas abundantes e febre.
Antecedentes: espinha bífida com mielomeningocelo corrigido e deformidades nos membros inferiores submetido a várias cirurgias ortopédicas com necessidade de apoio em canadianas para deambulação; cistostomia aos 17 anos por bexiga neurogénica. Sem factores de risco cardiovascular, alergias, hábitos etílicos, tabágicos, utilização de drogas endovenosas ou viagens recentes.
Na admissão encontrava-se polipneico com dificuldade respiratória, saturação periférica de oxigénio em ar ambiente: 90%. Tensão arterial: 100/80mmHg. Frequência cardíaca: 120bpmin. Febre (38,1ºC). Pálido. Má perfusão periférica. Auscultação cardíaca: taquiarritmia, sem sopros. Auscultação pulmonar: crepitações na metade inferior de ambos os hemitórax. Edema bilateral dos membros inferiores.
Do estudo inicial efetuado, analiticamente com discreta leucocitose, proteína C reativa e peptídeo natriurético B elevados, mioglobina de 137 mg/dL e troponina I de alta sensibilidade de 41,6 pg/mL (Tabela 1). Electrocardiograma: Taquicardia sinusal, extrassístoles ventriculares isoladas, sem sinais de isquemia. Gasimetria de sangue arterial: pH: 7,43; pO2: 60mmHg; pCO2: 49mmHg; Lact: 2,1mmol/L. Radiografia de tórax: cardiomegalia, acentuação do interstício e cefalização vascular (Fig. 2). Angiografia torácica por tomografia axial computorizada excluiu tromboembolia pulmonar. Ecocardiograma transtorácico: dilatação severa das cavidades esquerdas (aurícula: 100ml/ventrículo: 200ml) e ligeira da aurícula direita, depressão severa da função sistólica do ventrículo esquerdo com fracção de ejecção (FEVE) de 14% e depressão da função sistólica do ventrículo direito, insuficiências mitral e tricúspide funcionais severas, com pressão sistólica na artéria pulmonar (PSAP) estimada em 49mmHg.
Iniciou terapêutica diurética e foi admitido em unidade de cuidados intermédios por insuficiência cardíaca aguda. Apresentou agravamento clínico com instabilidade hemodinâmica, agravamento de insuficiência respiratória e disfunção multiorgânica com necessidade de suporte vasopressor e ventilação não invasiva pelo que foi transferido para um hospital central, por eventual necessidade de técnica veno-arterial de oxigenação por membrana extracorporal e continuação de estudo etiológico. Teve melhoria gradual com resolução de disfunção de órgão, sem necessidade de medidas de suporte invasivas. Repetido ecocardiograma no segundo dia de internamento apresentando FEVE inferior a 10%, PSAP de 62mmHg e trombo no VE (Fig. 3), pelo que iniciou hipocoagulação.
Do estudo etiológico efectuado: serologias para vírus cardiotrópicos com positividade para Pv-B19 (IgM e IgG). Ressonância magnética (RM) cardíaca (Fig. 4) sugestiva de miocardiopatia dilatada de etiologia não isquémica (sem sinais sugestivos de edema ou fibrose miocárdica focal, alterações estruturais sobreponíveis a ecocardiograma). Para melhor esclarecimento clínico e avaliação para eventual transplante cardíaco realizou cateterismo cardíaco direito e esquerdo com biópsia endomiocárdica do ventrículo direito. Apresentava coronárias angiograficamente normais. A análise anatomopatológica do endomiocárdico (Fig. 5) mostrou edema ligeiro e infiltrado linfocítico intersticial escasso, aspetos morfológicos compatíveis com o diagnóstico de miocardite “borderline”. O estudo imuno-histoquímico no fragmento de miocárdio foi negativo para Pv-B19, no entanto o estudo por biologia molecular por técnica de PCR foi positivo. Nesta fase foi pesquisada PCR de Pv-B19 no sangue que foi negativa e repetido estudo serológico verificando-se seroconversão (IgG positiva, IgM negativa).
Apesar da RM não ter demonstrado sinais sugestivos de miocardite, atendendo à evidência de inflamação na biópsia do endomiocárdio com presença de DNA de PV-B19 foi assumido o diagnóstico de miocardite de etiologia infecciosa por Pv-B19 e iniciada Imunoglobulina humana (IgIV) 30 g por dia durante cinco dias. Teve melhoria clínica franca e ao 27º dia de internamento verificou-se recuperação parcial da capacidade funcional prévia, da FEVE (estimada em 27%) e da insuficiência mitral. Teve alta com seguimento em consulta sob terapêutica modificadora de prognóstico otimizada e hipocoagulado. Na reavaliação 3 meses após internamento apresentou-se em classe I de NYHA e o ecocardiograma mostrava cavidades de dimensões normais, recuperação da função sistólica biventricular (FEVE de 55%) e sem insuficiências valvulares.
Discussão:
A heterogeneidade da sintomatologia pode dificultar o diagnóstico de miocardite, contudo a integração com os exames auxiliares de diagnóstico não invasivos permitem a suspeita diagnóstica. Na prática clínica, o diagnóstico de miocardite é frequentemente de presunção pois apenas uma minoria dos doentes é submetido a biópsia endomiocárdica. A biópsia está indicada nas situações de insuficiência cardíaca com início recente (inferior a 2 semanas), com instabilidade hemodinâmica, sem resposta ao tratamento e/ou presença de arritmias ventriculares ou bloqueios cardíacos de alto grau4. O diagnóstico histológico é estabelecido na presença de células inflamatórias e necrose de miócitos (critérios de Dallas5). A miocardite “borderline”, como verificado neste caso, é caracterizada pela presença de células inflamatórias mas ausência de necrose. A realização de biópsia altera o prognóstico ao determinar o diagnóstico e assim, o tipo de tratamento.
No presente caso clínico, na fase inicial, pretendeu-se esclarecer se o quadro de insuficiência cardíaca aguda e cardiomiopatia dilatada, num doente jovem, se tratava de um processo agudo/inflamatório (miocardite) ou uma patologia cardíaca crónica (cardiomiopatia dilatada) sem tradução clínica até à data atendendo à sua limitação funcional de base. A presença de febre e dejeções aquosas na admissão, assim como a serologia de Pv-B19 com IgM e IgG positivas sugeriram uma etiologia aguda possivelmente infeciosa, no entanto os biomarcadores cardíacos foram negativos e a RM cardíaca não mostrou atividade inflamatória miocárdica, tendo sugerido como mais provável o diagnóstico de cardiomiopatia dilatada não isquémica. Atendendo a que o doente não referia sintomas isquémicos ou hábitos alcoólicos a hipótese de cardiomiopatia dilatada de etiologia congénita tomou alguma relevância. Contudo, perante a suspeita de etiologia infeciosa e clínica de instalação aguda, procedeu-se à realização de biópsia do endomiocárdio que mostrou presença de atividade inflamatória concluindo-se pelo diagnóstico de miocardite com cardiomiopatia dilatada neste contexto.
Perante o diagnóstico de miocardite impõe-se a investigação da causa, que pode ser infecciosa ou não infecciosa. É de importância central a distinção entre ambas. O contexto clínico e a identificação de agente no miocárdio permitem estabelecer a etiologia e definir a estratégia terapêutica: terapia antiviral nas infecções virais ou imunossupressão na patologia auto-imune e reações de hipersensibilidade a fármacos.
A miocardite viral e pós viral é a maior causa de cardiomiopatia dilatada aguda e crónica6. Os agentes que causam miocardite são vários, sendo que atualmente o Pv-B19 parece ser o mais prevalente7.
Neste caso, as serologias de Pv-B19 e a sua seroconversão foram sugestivas de infecção recente, no entanto os estudos serológicos não estão recomendados pois as serologias víricas têm baixa sensibilidade e especificidade apresentando apenas 4% de correlação com a identificação do vírus no miocárdio8. Portanto, a confirmação diagnóstica de etiologia viral foi efetuada pela positividade de PCR de Pv-B19 no miocárdio, apesar da sua negatividade no sangue que é explicada pela clearance viral habitualmente mais precoce no sangue9.
O tratamento de miocardite pode ser dividida em duas vertentes conciliadoras: 1) medidas gerais de suporte e tratamento de insuficiência cardíaca com terapêutica modificadora de prognóstico, nomeadamente, inibidores da angiotensina II, bloqueadores beta e antagonistas dos recetores da aldosterona; 2) terapêutica dirigida à causa10.
As armas farmacológicas disponíveis no tratamento da miocardite por Pv-B19 restringem-se à IgIV e à infusão subcutânea de interferon-β. A IgIV promove a eliminação viral e impede a sua replicação11, apesar disto a evidência não suporta a sua utilização12-13. Nos doentes que tiveram eliminação do Pv-B19 após utilização de IgIV verificou-se melhoria da função ventricular e redução dos diâmetros cavitários14. A terapêutica com IFN-β em doentes com miocardite viral tem vindo a consolidar-se como uma opção terapêutica segura e eficaz15. Neste caso clínico optou-se pela terapêutica com IgIV verificando-se, em conjunto com as restantes medidas gerais e farmacológicas, uma excelente evolução clínica.
Conclusão:
Nos doentes com insuficiência cardíaca e cardiopatia dilatada, após estudo etiológico inicial sem identificação de causa, a necessidade de biópsia do endomiocárdio deve ser ponderada de acordo com a probabilidade de que os resultados possam alterar a atitude terapêutica. Perante o diagnóstico histológico de miocardite “borderline” associada a um estudo imuno-histoquímico negativo para Pv-B19 no miocárdio, tornou-se imperativa a confirmação da presença de uma miocardite viral através de técnicas de biologia molecular, de modo a evitar a utilização de imunossupressão nociva. Apesar da evidência ser insuficiente para a utilização de IgIV, este caso sugere que a sua utilização pode ter um papel na miocardite viral.
Agradecimentos: Ao Dr. Pedro Bernardes, Dra. Teresa Pinho e Dr. Rui Rodrigues do Serviço de Cardiologia do Hospital de São João pela colaboração no caso clínico e realização de meios auxiliares de diagnóstico. Ao Dr. Pedro Rodrigues Pereira do Serviço de Anatomia Patológica do Hospital de São João pela colaboração no caso clínico e disponibilização da imagem histológica apresentada.
Quadro I
Tabela 1 - Resultados dos estudos analíticos
| Parâmetro | Valor | Valor de referência |
| Hemoglobina (g/dL) | 12,1 | 11,8-15,8 |
| Volume corpuscular médio (fL) | 71,1 | 80,4-96,4 |
| Hemoglobina Globular Média (pg) | 33 | 26,7-30,7 |
| Leucócitos (/µL) – Neutrófilos (%) | 11,82 (73) | 4,0-10,0 |
| Plaquetas (x109/L) | 213 | 150-400 |
| Ureia (mg/dL) | 51 | 17-43 |
| Creatinina (mg/dL) | 1,18 | 0,6-1,0 |
| Sódio (mmol/L) | 137 | 136-145 |
| Potássio (mmol/L) | 4,3 | 3,5-5,1 |
| Proteína C reactiva (mg/dL) | 9,01 | 0,01-0,82 |
| Desidrogenase láctica (UI/L) | 202 | 125-220 |
| Aspartato aminotransferase (UI/L) | 171 | 8-35 |
| Alanina aminotransferase (UI/L) | 312 | 7-45 |
| Fosfatase alcalina (UI/L) | 140 | 30-120 |
| Gamaglutamiltranspeptidase (UI/L) | 113 | <38 |
| Bilirrubina total (mg/dL) | 0,92 | 0,3-1,2 |
| BNP (pg/ml) | 2850 | < 100 |
| Mioglobina | 137 | 1-147 |
| Troponina I alta sensibilidade (pg/mL) | 41,6 | <34,2 |
| INR | 1,65 | 1,0-1,4 |
| Urina II | Normal | |
| Epstein-barr IgG/IgM | +/- | |
| Citomegalovírus IgG/IgM | -/- | |
| Herpes I/II IgG/IgM | +/- | |
| Parvovírus B19 IgG/IgM | +/+ | |
| ANA/ANCA | Negativos |
BNP - Peptideo natriurético tipo B; INR – Razao normalizada internacional; ANA: Anticorpos antinucleares; ANCA: Anticorpos anti-citoplasma de neutrófilos
Figura I
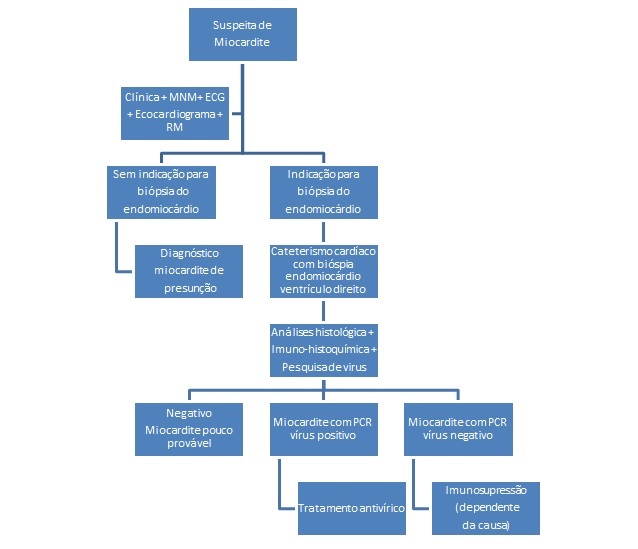
Figura 1 – Algoritmo diagnóstico de miocardite – adaptado de Montera MW, Mesquita ET, Colafranceschi AS, Oliveira Junior AM, Rabischoffsky A., Ianni BM, et al. Sociedade Brasileira de Cardiologia. I Diretriz Brasileira de Miocardites e Pericardites. Arq Bras Cardiol 2013; 100(4 supl. 1): 1-36. Legenda – MNM: Marcadores de Necrose do Miocárdio; ECG: Electrocardiografia; RM: Ressonância Magnética; PCR: Polimerase chain reaction
Figura II
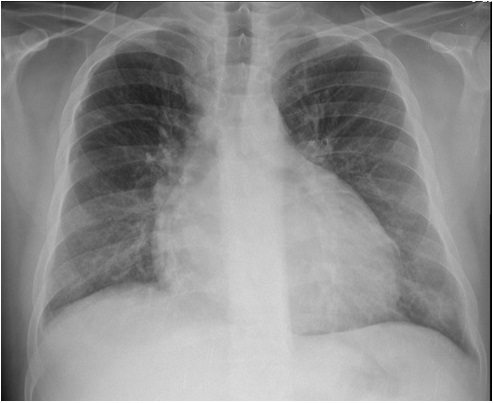
Figura 2 – Radiografia de Tórax na admissão hospitalar - índice cardio-torácico superior a 0,5, acentuação do interstício e cefalização vascular
Figura III
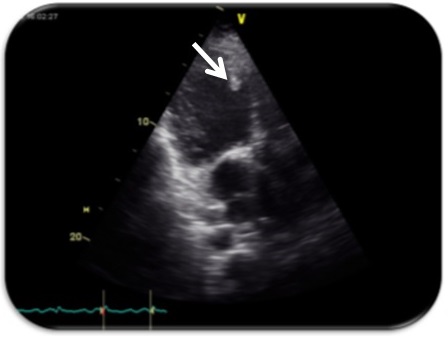
Figura 3 – Ecocardiograma transtorácico – janela apical de 3 câmaras com visualização de trombo séssil aderente ao septo do ventrículo esquerdo (seta)
Figura IV
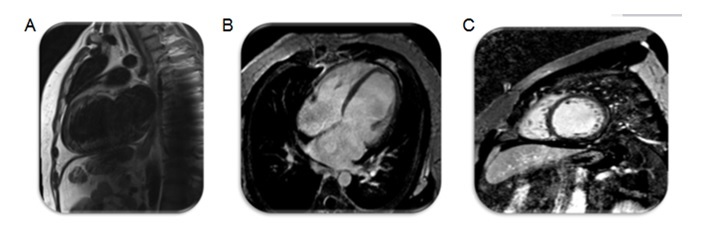
Figura 4 – Ressonância magnética cardíaca – Imagem A (ponderada em T2 no eixo longo): apesar da imagem subóptima não se verificaram áreas hiperintensas sugestivas de edema. Imagem B (pós contraste – eixo longo) e C (pós contraste – eixo curto): sem identificação de áreas de realce tardio sugestivas de fibrose focal, infiltração miocárdica anormal ou cicatriz de enfarte.
Figura V
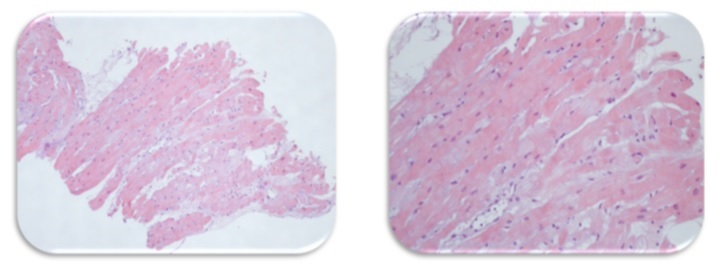
Figura 5 – Estudo histológico de fragmento do miocárdio: Edema ligeiro e infiltrado linfocítico intersticial escasso: aspectos morfológicos compatíveis com miocardite “borderline”.
BIBLIOGRAFIA
1. Kindermann I, Barth C, Mahfoud F, Ukena C, Lenski M, Yilmaz A, et al. Update on myocarditis. J Am Coll Cardiol. 2012;59(9):779-92
2. Montera MW, Mesquita ET, Colafranceschi AS, Oliveira Junior AM, Rabischoffsky A., Ianni BM, et al. Sociedade Brasileira de Cardiologia. I Diretriz Brasileira de Miocardites e Pericardites. Arq Bras Cardiol 2013; 100(4 supl. 1): 1-36
3. Schultz JC, Hilliard AA, Cooper LT Jr, Rihal CS. Diagnosis and Treatment of Viral Myocarditis. Mayo Clin Proc. 2009;84(11):1001-1009
4. Cooper LT, Baughman K, Feldman AM, Frustaci A, Jessup M, Kuhl U, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. Eur Heart J. 2007;28(24):3076-93
5. Aretz HT, Billingham ME, Edwards WD, et al. Myocarditis: a histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1:3–14.
6. Cooper LT Jr. Myocarditis. N Engl J Med 2009;360:1526-1538
7. Pankuweit S, Moll R, Baandrup U, Portig I, Hufnagel G, Maisch B. Prevalence of the parvovirus B19 genome in endomyocardial biopsy specimens. Hum Pathol 2003;34:497–503.
8. Mahfoud F, Gärtner B, Kindermann M, Ukena C, Gadomski K, Klingel K, et al. Virus serology in patients with suspected myocarditis: utility or futility? Eur Heart J. 2011;32(7):897-903.
9. Jordan JA (2014). Clinical manifestations and diagnosis of parvorvirus B19 infection.In Bloom A (Ed), UpToDate (Accessed on December 12, 2016)
10.Dominguez F, Kühl U, Pieske B, Garcia-Pavia P, Tschöp C.Update on Myocarditis and Inflammatory Cardiomyopathy: Reemergence of Endomyocardial Biopsy; Rev Esp Cardiol.2016;69 (2):178-87
11. Schultheiss HP, Kühl U, Cooper LT. The management of myocarditis. Eur Heart J. 2011;32(21):2616-25.
12. McNamara DM, Holubkov R, Starling RC, Dec GW, Loh E, Torre-Amione G, et al. Controlled trial of intravenous immune globulin in recent-onset dilated cardiomyopathy. Circulation 2001;103(18):2254–9.
13. Robinson J, Hartling L, Vandermeer B, Klassen TP. Intravenous immunoglobulin for presumed viral myocarditis in children and adults. Cochrane Database of Systematic Reviews 2015, Issue 5. Art. No.: CD004370.
14. Maisch B, Haake H, Schlotmann S, Funck R, Richter A, Pankuweit S. Intermediate dose of pentaglobin eradicates effectively inflammation in parvo B19 and adenovirus positive myocarditis. Eur Heart J. 2008;29(Abstract Supplement):438
15. Kuhl U, Pauschinger M, Schwimmbeck PL,Seeberg B,Lober C,Noutsias M, et al. Interferon-beta treatment eliminates cardiotropic viruses and improves left ventricular function in patients with myocardial persistence of viral genomes and left ventricular dysfunction. Circulation 2003;107:2793–8.

