A tuberculose (TB) é uma doença multi-sistémica com uma diversidade de formas de apresentação e corresponde à segunda doença infecciosa com maior mortalidade em todo o mundo, a seguir à infecção pelo vírus da imunodeficiência humana (VIH). A Organização Mundial de Saúde estima 9,6 milhões de novos casos de TB e 1,5 milhões de mortes em 2014, contabilizando 480000 casos de TB multirresistente 1.
Apesar do número de mortes ser elevado para uma doença curável, tem-se vindo a assistir a uma redução progressiva da incidência de TB e da mortalidade que lhe está associada (cerca de 47% relativamente a 1990) 1.
A TB é mais comum no Sudeste Asiático (58% dos casos em 2012), em África (27% dos casos em 2012), na Costa Oeste do Pacífico e na Índia devido à limitação de recursos e à maior prevalência de infecção VIH e de TB multirresistentes 1;2.
A TB é causada pelo bacilo Mycobacterium tuberculosis e o pulmão é o local mais afectado, pelo que se estima que a TB pulmonar corresponda à forma de apresentação em cerca de 85% dos casos. A TB extrapulmonar representa cerca de 15% dos casos em doentes imunocompetentes, 5-27% correspondendo à forma ganglionar 3;4. Para além do envolvimento ganglionar existem outras formas de TB extrapulmonar nomeadamente a pleural, gastrointestinal, genitourinária, miliar, osteoarticular e meníngea.
O risco de desenvolver TB ativa quando co-infectados com VIH é 20 a 30 vezes superior ao dos seronegativos para VIH, sobretudo no que diz respeito à TB extrapulmonar 5.
O diagnostico é clinico, anatomopatológico e imagiológico sendo o exame cultural o gold-standart para o diagnóstico de TB (sensibilidade de 80-85% e especificidade de, aproximadamente, 98%), permitindo, ainda, a determinação da sensibilidade aos fármacos antibacilares 6.
Apresentamos o caso atípico de uma doente imunocompetente com TB ganglionar e gástrica sem evidência de doença pulmonar.
Caso clínico:
Expõe-se o episódio clínico o caso de uma doente de 78 anos, sem antecedentes pessoais relevantes nomeadamente história de tuberculose ou de contacto conhecido com doentes com tuberculose, com quadro de astenia, anorexia e perda ponderal (22% do peso corporal), com um ano de evolução. Analiticamente destacava-se anemia normocítica normocrómica do tipo de doença crónica (Hb 11 g/dl), velocidade de sedimentação e proteína C reactiva elevadas (126 mm/1ªh e 12,5 mg/dl, respectivamente) e anticorpos anti-VIH 1 e 2 negativos. Realizou tomografia computadorizada (TC) toraco-abdomino-pélvica que revelou achados compatíveis com lesão neoformativa do corpo gástrico e formações adenopáticas loco-regionais e mediastínicas com algumas áreas de necrose (fig. 1).
Inicialmente realizou uma endoscopia digestiva alta (EDA) com documentação de lesão proliferativa e ulcerada subcárdica com extensão ao cárdia (fig. 2), cuja histologia foi compatível com o diagnóstico de gastrite crónica, não se tendo apurado a presença de morfologia neoplásica. Neste contexto, realizou uma ecoendoscopia que confirmou a presença de uma lesão ulcerativa na região subcárdica com perda de estratificação da parede, atingindo todas as camadas até à serosa.
Perante uma clínica e os achados imagiológicos altamente sugestivos de neoplasia, realizou outras duas EDAs, que documentaram processo inflamatório crónico granulomatoso com fragmentos necrosados e células gigantes multinucleadas, sem neoplasia.
Perante a suspeita de tuberculose gástrica, realizou prova de Mantoux foi reativa (18 mm) e IGRA (Interferon Gamma Release Assay) positivo (1,04 IU/ml). Para exclusão de envolvimento pulmonar procedeu-se à realização de broncofibroscopia que não revelou alterações, tendo a pesquisa de bacilos álcool-ácido resistentes (BAAR) e a Protein Chain Reaction (PCR) para M. tuberculosis sido negativas em biopsia carinal.
No seguimento da investigação foi submetida a laparotomia exploradora com excisão de gânglio justa-cárdico, cujo exame extemporâneo revelou alterações compatíveis com linfadenite granulomatosa necrosante com numerosas células gigantes multinucleadas de tipo Langhans, sem tecido neoplásico (fig. 3). O Ziehl-Nielsen e Löwestein-Jensen foram negativos, mas a PCR para M. tuberculosis foi positiva, estabelecendo-se o diagnóstico de tuberculose ganglionar.
Perante a ausência de documentação de neoplasia e a presença de granulomas necrosados com células gigantes nas biópsias gástricas, assumiu-se o diagnóstico de tuberculose gástrica. Inicialmente foi instituída terapêutica antibacilar quadrupla (isoniazida, rifampicina, pirazinamida e etambutol) tendo a doente vindo a desenvolver um quadro de hepatite tóxica à isoniazida e/ou pirazinamida. Cumpriu tratamento antibacilar com rifampicina, etambutol e levofloxacina durante 9 meses, assistindo-se a ganho ponderal, descida da velocidade de sedimentação (55mm/1ªh), regressão das adenopatias mediastínicas e abdominais em TC toraco-abdomino-pélvica e a reavaliação endoscópica apenas com gastrite crónica ligeira sem presença de granulomas.
Discussão:
A TB gastrointestinal envolve mais frequentemente a região ileo-cecal, sendo a TB gástrica rara (menos de 1% das apresentações de TB gastrointestinal) e geralmente associada a envolvimento pulmonar ou imunosupressão8. A raridade deve-se provavelmente às propriedades bactericidas do suco gástrico, à escassez de tecido linfóide nas paredes do estômago e ao rápido esvaziamento gástrico8. As principais vias de infecção são a agressão directa da mucosa gástrica, a disseminação hematogénica ou a extensão loco-regional7.
A tuberculose gástrica atinge mais frequentemente o antro manifestando-se, na maioria dos casos, como massa na região do antro a condicionar obstrução ao esvaziamento gástrico9,10. Para além do envolvimento do antro, estão ainda descritos casos de atingimento duodenal e da região gastroesofágica9. A apresentação clínica é geralmente caracterizada por vómitos e dor abdominal, podendo ainda manifestar-se com perda ponderal, febre ou hemorragia gastrintestinal8.
Relativamente ao diagnóstico, a TC e ressonância magnética nuclear (RMN) abdominais são importantes, na medida em que podem mostrar imagens de gânglios linfáticos regionais com centros hipodensos, que com calcificações são muito sugestivas de TB. Embora o exame cultural seja o gold-standart para o diagnóstico, quando a suspeita clínica é elevada, a PCR para M. tuberculosis dos tecidos biopsados permite o diagnóstico rápido com especificidade de 100% e sensibilidade de 27-75%10.
Provavelmente devido à dificuldade diagnóstica os doentes são muitas vezes submetidos a cirurgia, como no caso clínico apresentado, e o diagnóstico de tuberculose gástrica só se estabelece posteriormente8.
No presente caso clínico, os achados obtidos na biopsia gástrica apesar de serem negativos para BAAR, eram muito sugestivos de TB. A positividade da PCR para o Mycobacterium tuberculosis no gânglio perigástrico estabeleceu inequivocamente o diagnóstico de linfadenite tuberculosa.
Apesar da taxa de incidência global de tuberculose e da mortalidade associada terem vindo a diminuir, é fundamental tê-la em conta na prática clínica. Os vários locais potencialmente afectados e a diversidade das manifestações clínicas possíveis fazem da TB uma patologia complexa e desafiante.
Figura I
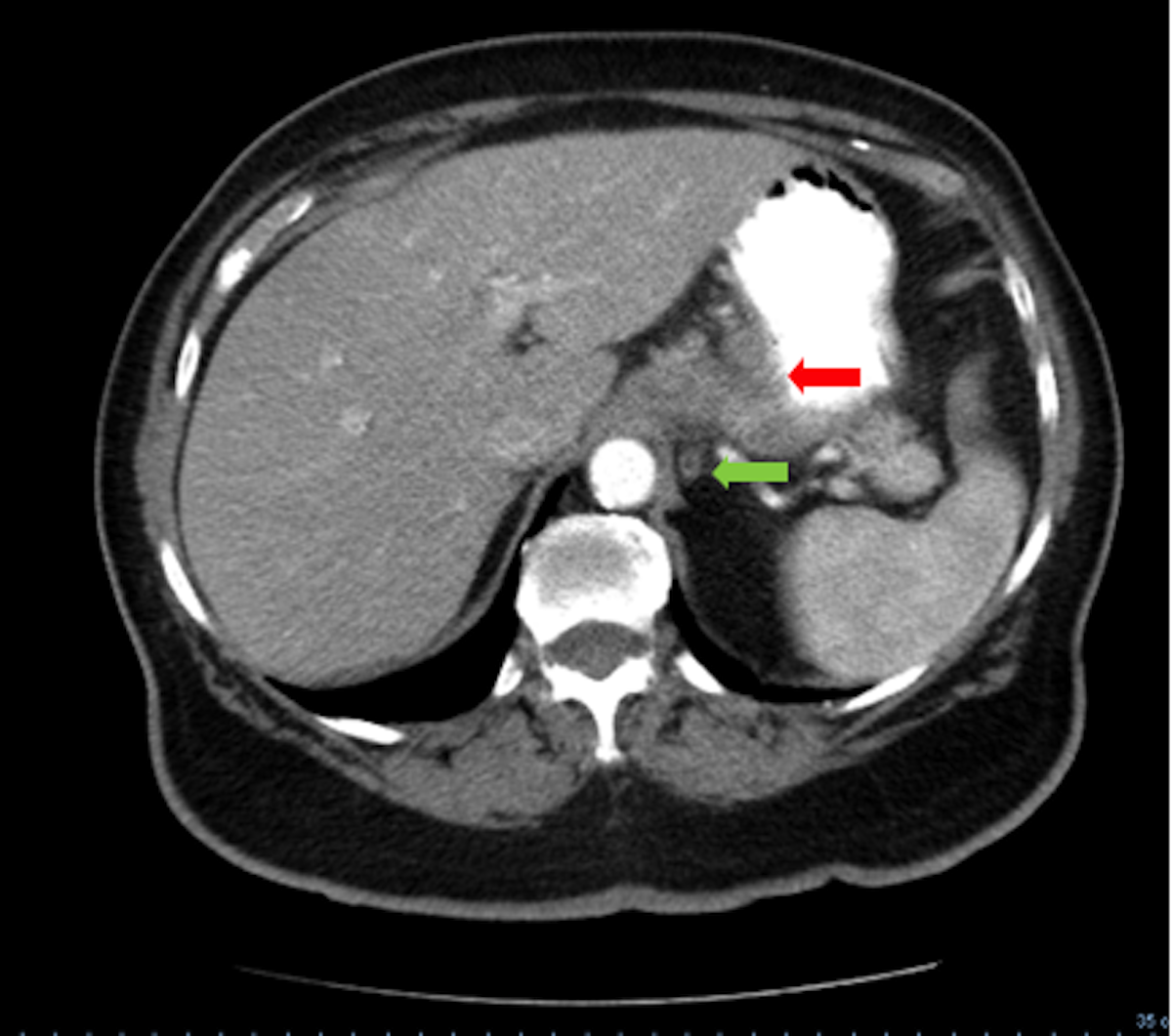
Espessamento parietal irregular do corpo gástrico (seta vermelha) e adenopatia com foco necrótico (seta verde)
Figura II
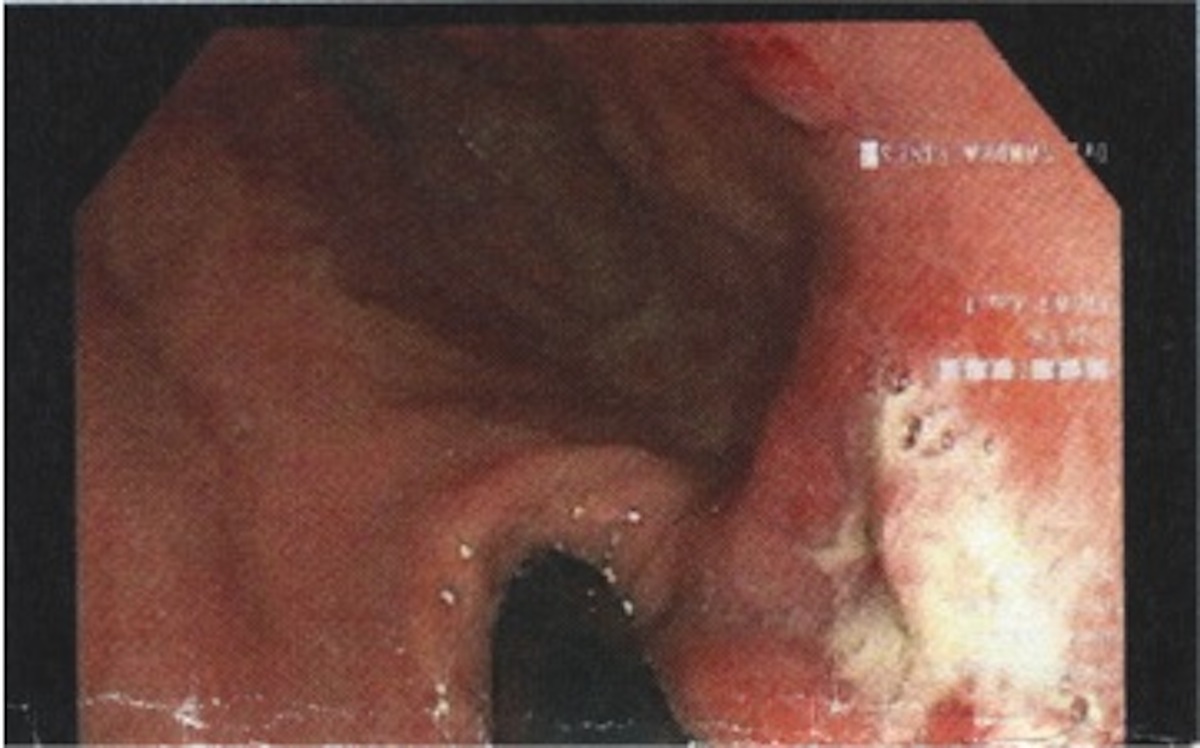
Imagem de endoscopia digestiva alta com lesão proliferativa e ulcerada subcárdica
Figura III
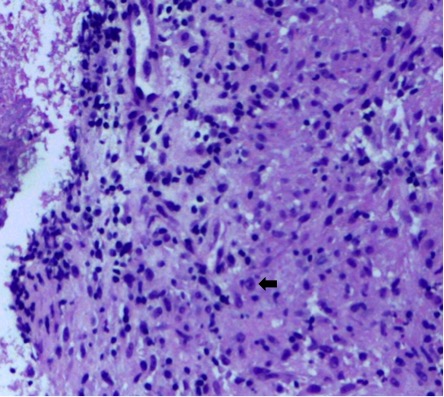
Coloração hematoxilina-eosina (200x) – fragmento com arquitectura de gânglio linfático com esboço de granulomas com células gigantes multinucleadas (seta preta)
BIBLIOGRAFIA
1. Global Tuberculosis Report 2015; World Health Organization – http://www.who.int/tb/publications/global_report/en/
2. Centers for Disease Control and Prevention (CDC). Tuberculosis (TB). Data and Statistics. Available at http://www.cdc.gov/tb/ statistics/default.htm.
3. Farer LS, Lowell AM, Meador MP. Extrapulmonary tuberculosis in the United States. Am J Epidemiol 1979; 109: 205-17
4. Rieder HL, Snider DE Jr, Cauthen GM. Extrapulmonary tuberculosis in the United States. Am Rev Respir Dis 1990;141:347-51
5. Rao YG, Pande GK, Sahni P, Chattopadhyay TK. Gastroduodenal tuberculosis management guidelines, based on a large experience and a review of the literature. Canadian Journal of Surgery. 2004;47(5):364–368
6. American Thoracic Society: CDC; Council of the Infectious Disease Society of America. Diagnostic standards and classification of tuberculosis in adults and children. Am J Respir Crit Care Med 2000;161:1376-95
7. Abrams JS, Holden WD. Tuberculosis of gastrointestinal tract. Archives of Surgery. 1964;89:282–293
8. Ecka RS1, Wani ZA, Sharma M. Gastric tuberculosis with outlet obstruction: a case report presenting with a mass lesion. Case Rep Med. 2013;2013:169051
9. Amarapurkar DN, Patel ND, Amarapurkar AD. Primary gastric tuberculosis—report of 5 cases.BMC Gastroenterology. 2003;3
10. Moghadam AG, Alborzi A, Pouladfar G, Ahmad M. Primary gastric tuberculosis mimicking gastric cancer: a case report.The Journal of Infection in Developing Countries. 2013;7(4):355–357




