Introdução
O sarcoma de Kaposi (SK) foi descrito em 1882 por Moritz Kaposi1. Em 1994, foram identificadas biópsias de DNA de um vírus da família Herpesviridae– human herpesvirus 8(HHV-8).2
O HHV-8 é responsável pelo SK, pelo linfoma primário de cavidades e pela doença de Castlemann multicêntrica. É desconhecida a sua patogénese.3,4,5 É um vírus de transmissão sexual, mais frequente em homens que têm sexo com homens (HSH). São também possíveis outras formas de transmissão, como a vertical.3
Estão descritos quatro subtipos de SK:
- · Clássico - É mais frequente em homens idosos, oriundos da Europa de Leste e do Mediterrâneo. É caracterizado por múltiplos nódulos e placas indolores, nas mãos e pés, com progressão para outras zonas dos membros, em anos ou décadas. Em 10% há envolvimento do tubo digestivo e das mucosas. Está descrita a associação de linfomas.3,6 Geralmente não causa diminuição da sobrevida, pois o diagnóstico ocorre maioritariamente em população idosa. Pode ter apresentação aguda e agressiva.7
- · Endémico - Presente na África equatorial afetando crianças e adultos. Há países onde corresponde a 50% dos tumores. A apresentação é semelhante ao clássico, mas é mais agressivo e tem frequentemente envolvimento sistémico (disseminação linfática e óssea).3,6
- · Associado ao vírus da imunodeficiência humana/síndrome da imunodeficiência adquirida (VIH/SIDA) - O SK é considerado uma neoplasia definidora de SIDA, tal como o linfoma não Hodgkin e o carcinoma cervical invasivo.8 A incidência destas neoplasias é bastante maior na população VIH do que na população em geral, mas com a instituição da terapêutica antirretroviral, verificou-se diminuição significativa do número de casos.8 Atualmente são mais frequentes as neoplasias não definidoras de SIDA (hepática, pulmonar, canal anal e linfoma de Hodgkin). O SK permanece a neoplasia definidora de SIDA mais frequente.3,4,9,10 Afeta todos os grupos de risco, sobretudo os HSH. As lesões ocorrem nas extremidades inferiores, face e genitais. O envolvimento sistémico é frequente.9
- · Iatrogénico - Ocorre sobretudo em doentes submetidos a transplante de órgãos sólidos e a imunossupressão em alta dose. O tempo médio entre o transplante e o diagnóstico é de 29 a 31 meses. É agressivo e em 50% dos doentes há envolvimento ganglionar, de mucosas e de órgãos viscerais. Pode ocorrer sem envolvimento cutâneo. Pode ser consequência de reativação do HHV-8 ou tratar-se de primoinfeção por exposição a órgão transplantado infetado.3,6 Apesar de classicamente associado a terapêutica imunossupressora após transplante de órgãos, estão documentados casos decorrentes do tratamento de múltiplas outras doenças, com corticoterapia, tais como: púrpura trombocitopénica idiopática, arterite de células gigantes, síndrome de Sjögren, pênfigo vulgar, penfigóide bolhoso, dermatomiosite, lupus eritematoso sistémico, cirrose biliar primária, artrite reumatóide e doenças linfoproliferativas.11 Assim, é necessária elevada suspeição em doentes a cumprir terapêutica imunossupressora.12,13
Caso clínico
Os autores expõem o caso de um doente de 82 anos, sexo masculino, raça branca. Trata-se de um doente natural da ilha da Madeira, a residir em Lisboa desde longa data.
O doente tinha como antecedentes pessoais: arterite de células gigantes (ACG) diagnosticada em 2005 e controlada com corticoterapia; hipertensão arterial sistémica essencial; hipertrofia benigna da próstata e hábitos tabágicos passados, de cerca de 70 unidades maço/ano.
Encontrava-se medicado com prednisolona 5mg, valsartan + hidroclorotiazida 160 + 12,5 mg, amlodipina 10 mg e tansulosina 0,4 mg.
O doente mantinha seguimento em consulta de medicina interna desde o diagnóstico de ACG. Referia quadro, com cerca de dois anos de evolução, de edema (godet +) ao nível dos membros inferiores e pápulas violáceas infracentimétricas, localizadas no membro inferior esquerdo (Fig. 1).
Foi referenciado a consulta de dermatologia, sendo submetido a biópsia cutânea das lesões. O resultado da biópsia foi sarcoma de Kaposi (SK), pelo que foi pedida serologia de VIH que foi negativa, sendo ainda excluída imunodeficiência primária (estudo das subpopulações linfocitárias, doseamento das imunoglobulinas e do complemento sem alterações). Por se tratar de um doente caucasiano e VIH negativo, admitiu-se o diagnóstico de SK clássico. O estudo foi completado com a realização da serologia do HHV-8, que foi positiva.
O doente iniciou radioterapia, cumprindo três sessões na dose total de 15 Gy, com boa tolerância. No entanto, verificou-se progressão da doença, com aparecimento de novas lesões no membro inferior direito. Foi realizada biópsia cutânea das novas lesões, confirmando SK.
Após progressão da doença, iniciou quimioterapia com doxorrubicina lipossómica e cumpriu novamente sessões de radioterapia, com a dose total de 30 Gy. Verificou-se melhoria progressiva das lesões. Atualmente, mantém seguimento em consulta de oncologia médica, tendo realizado até à data 8 ciclos de quimioterapia. Realizou TC toraco-abdomino-pélvica que excluiu envolvimento sistémico.
Em março de 2015, foi detetada linfocitose absoluta (6.610 linfócitos x10^12/L), em exames de rotina. Foi realizada imunofenotipagem do sangue periférico, que foi compatível com leucemia linfocítica crónica (estadio 0 de Rai/A de Binet). Foi referenciado a consulta de hematologia, mas dada a idade e a natureza indolente da doença optou-se apenas pela monitorização da mesma.
Discussão
O SK é uma neoplasia causada pelo virús HHV-8. O diagnóstico é sugerido pelo aparecimento de lesões cutâneas (violáceas, castanhas ou avermelhadas) suspeitas de SK. É confirmado por biópsia. É também possível realizar a serologia de HHV-8. Deve ser realizado o rastreio de envolvimento sistémico.2,9
No caso acima, é descrita a marcha diagnóstica de um doente com antecedentes pessoais de ACG, com quadro de pápulas violáceas ao nível dos membros inferiores. A biópsia das lesões revelou SK, sendo a infeção por HHV-8 confirmada por serologia. Face a tratar-se de um doente caucasiano e VIH negativo, assumiu-se o diagnóstico de SK clássico.
Contudo, por se tratar de um doente sob corticoterapia desde 2005, e embora os casos de SK iatrogénico sejam mais frequentes em doentes com imunodepressão mais marcada (casos descritos maioritariamente em doentes submetidos a transplante),6 existem casos descritos de SK iatrogénico em doentes com arterite de células gigantes e outras doenças reumatológicas, submetidos a corticoterapia. Assim, podemos equacionar este diagnóstico.2,3,14,15
Um estudo retrospetivo, recentemente publicado, mostra que em 143 doentes com SK iatrogénico apenas 33 doentes eram transplantados. Os restantes 110 doentes, estavam sob imunossupressão no contexto de patologias autoimunes, 93% encontrava-se sob corticoterapia.16 Uma revisão pela plataforma Pubmed identifica-nos seis artigos de sarcoma de Kaposi associado a arterite de células gigantes, em doentes submetidos a corticoterapia. Na literatura, verifica-se também a associação de sarcoma de Kaposi com outras doenças reumatológicas.14,16 O mecanismo pelo qual estes doentes desenvolvem SK não é totalmente claro. Contudo, alguns estudos sugerem que os tecidos de SK apresentam um número elevado de recetores para os glucocorticóides17 e que a replicação do vírus HHV-8 poderá ser ativada pela corticoterapia.18
A favor deste diagnóstico, temos o facto de o doente cumprir corticoterapia desde longa data. Na literatura, a dose de corticoterapia, bem como a fase da doença em que surgem as lesões de SK, é variável. O tempo médio de desenvolvimento das lesões é de 60 meses em doentes que cumprem corticoterapia, sem a associação de outros imunossupressores. A dose de corticoterapia também é variável, estando descritos casos na literatura de doentes em tratamento de doenças reumatológicas a cumprir entre 5 e 100 mg de prednisolona. Os doentes descritos na literatura apresentam idade média de 61,9 anos, com desvio padrão de 17 anos (29 a 92 anos), o que engloba a idade do doente descrito neste caso clínico.16
Na literatura, os doentes com SK iatrogénico desenvolvem mais frequentemente lesões generalizadas, enquanto que o doente descrito no caso clínico apresenta lesões limitadas aos membros inferiores. Também não apresenta, até à data, evidência de envolvimento sistémico, o que é o mais frequente no SK iatrogénico. Habitualmente, tem um curso mais agressivo do que a forma clássica.3,6 Contudo, está também descrito que as formas de imunossupressão mais graves apresentam uma evolução mais agressiva, mas que, nos casos de imunossupressão menos marcada (corticoterapia em baixa dose), os sintomas são semelhantes aos de SK clássico.2
O tratamento do SK tem várias abordagens: excisão das lesões, crioterapia, radioterapia, quimioterapia ou terapêutica combinada.3 No caso do SK iatrogénico, a diminuição da dose, a suspensão ou a alteração da terapêutica imunossupressora podem ser úteis, na regressão das lesões.2,3,13 Neste caso, tal não foi possível por se verificar exacerbação de ACG, após diminuição da dose de prednisolona.
Está descrito que os doentes que desenvolvem a variante clássica do SK têm uma probabilidade de cerca de 30% de virem a desenvolver uma segunda neoplasia, sendo o linfoma não Hodgkin o mais habitual.19 O doente acabou por desenvolver leucemia linfocítica crónica estadio 0 de RAI/ A de Binet. A evolução indolente da doença levou à decisão de vigilância apenas, protelando-se o seu tratamento.
Conclusão
Os autores apresentam um caso de SK num doente de raça branca, imunocompetente e com antecedentes pessoais de ACG, que se encontra sob corticoterapia. Trata-se de um doente cujo diagnóstico estabelecido foi SK clássico, uma identidade rara na prática clínica. Contudo, face a encontrar-se medicado com corticoterapia, na dose de 5mg/dia, e existirem casos na literatura de SK em doentes com patologias autoimunes, não se pode excluir a hipótese de SK iatrogénico.
O SK é um tumor associado ao HHV-8 e deve ser considerado em todos os doentes com lesões suspeitas sob terapêutica imunossupressora, independentemente do fármaco utilizado.
Este caso ilustra uma doença frequente nos doentes de raça negra e sobretudo em doentes VIH positivo,sendo rara nas suas outras variantes e representando por isso um desafio diagnóstico.
Figura I
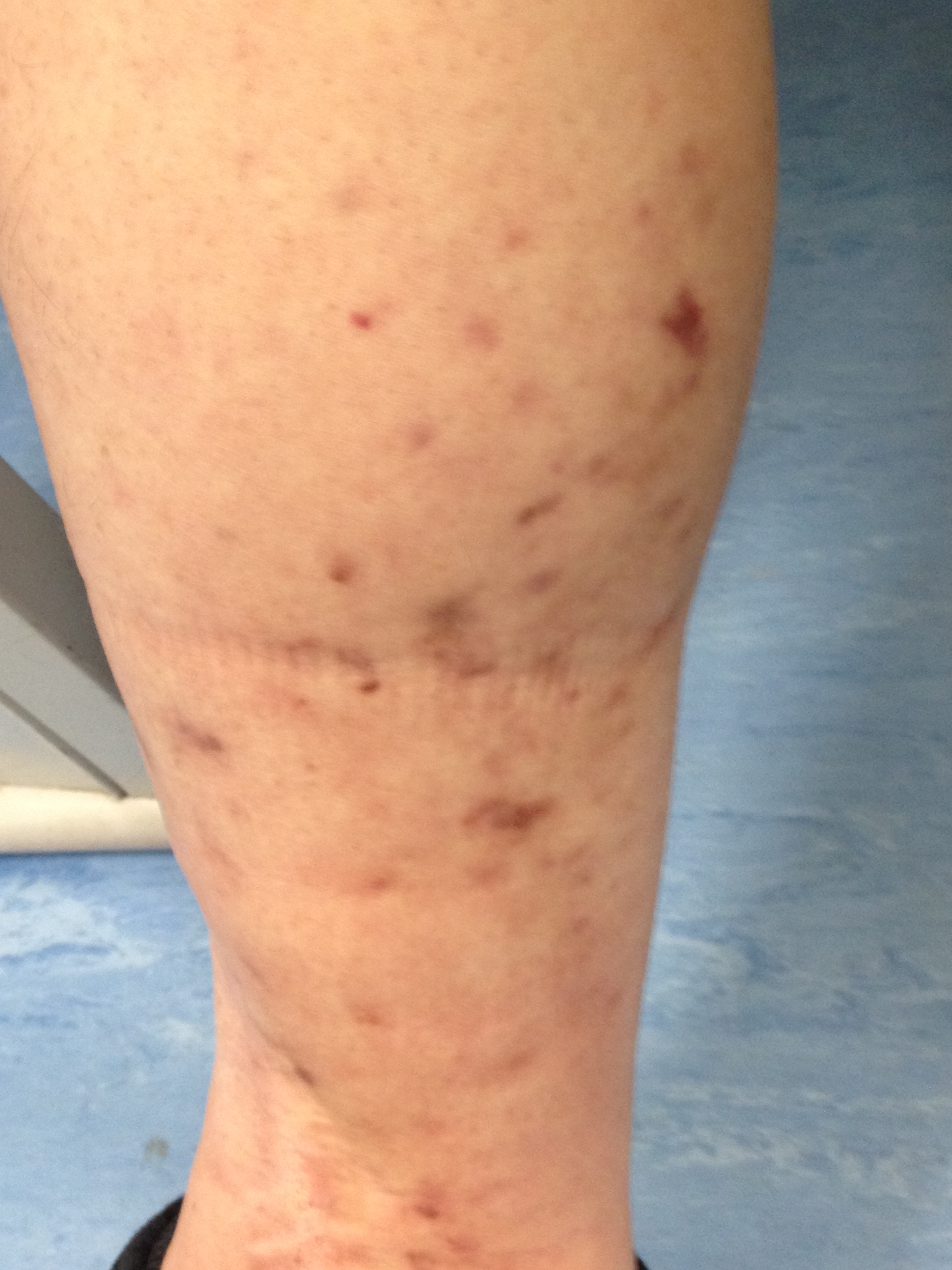
Lesões violáceas
BIBLIOGRAFIA
1. Kaposi, Moriz. Idiopathic multiple pigmented sarcoma of the skin.CA: A Cancer Journal for Clinicians, 1982, 32.6: 342-347
2.González-Sixto, B; Conde, A; et al. Kaposi Sarcoma Asssociated with Systemic Corticosteroid Therapy, Case Report, Actas Dermosifiliogr, 2007; 98:553-5.
3.Antman, K; Chang,Y. Medical Progress, Kaposis Sarcoma; Review Article, NEJM, 2000, volume 342, number 14, 1027-1038.
4.Dagna, L; Broccolo, F et al. A Relapsing Inflammatory Syndrome and Active Human Herpesvirus 8 Infection, Brief Report, NEJM, 2005, 353:2, 156-163.
5.Ganem,D. KSHV and the pathogenesis of Kaposi sarcoma: listening to human biology and medicine. The Journal of Clinical Investigation, 2010, 120:4, 939-949.
6. Casper,C; Disease associations of human herpesvirus 8 infection, www.uptodate.com, acesso em Junho 2017
7. Krown, S.; Singh J, Classic Kaposi sarcoma: Clinical features, staging, diagnosis, and treatment, www.uptodate.com, acesso em Junho 2017
8. Salvado, R., et al. Neoplasias em contexto da infecção por VIH: uma nova realidade?. RPDI-Revista Portuguesa de Doenças Infecciosas10.1 (2014)
9.Mesri,E; Cesarman, E; Boshoff, C. Kaposis Sarcoma and its associated herpesvirus, Nature Reviews|Cancer, 2010, volume 10, 707-719.
10. Groopman, J, AIDS-related Kaposi sarcoma: Clinical manifestations and diagnosis, www.uptodate.com, acesso em Junho 2017
11.LAZZARINI, Rosana, et al. Iatrogenic Kaposi´s sarcoma caused by corticosteroids.Anais brasileiros de dermatologia, 2016, 91.6: 867-869.
12.Ulger, S; Kizilarslanoglu, M; et al. Kaposis sarcoma in a geriatric patient following low-dose steroid therapy for polymyalgia rheumatica, Article in Press, European Geriatric Medicine, 2014, 533.
13.Choi KH, Byun JH, Lee JY, Cho BK, Park HJ. Kaposi Sarcoma after Corticosteroid Therapy for Idiopathic Thrombocytopenic Purpura. Ann Dermatol. 2009;21:297–299.
14. Trattner A, Hodak E, David M, Sandbank M. The Appearance of Kaposi Sarcoma during Corticosteroid Therapy. Cancer. 1993;72:1779–1783
15. Silverberg, Michael J., et al. Cumulative Incidence of Cancer Among Persons With HIV in North AmericaA Cohort StudyCumulative Incidence of Cancer Among Persons With HIV in North America.Annals of internal medicine163.7 (2015): 507-518.
16. BRAMBILLA, L.; TOURLAKI, A.; GENOVESE, G. Iatrogenic Kaposi´s Sarcoma: a Retrospective Cohort Study in an Italian Tertiary Care Centre.Clinical Oncology, 2017
17. Guo W-X, Antakly T, et al. Expression and cytokine regulation of glucocorticoid receptors in Kaposis Sarcoma. Am J Pathol 1996, 148, 1999-2008
18. Hundnall SD, Rady PL et al. Hydrocortisone activation of human herpes vírus-8 viral DNA replication and gene expression in vitro. Transplantation 1999, 67, 648-52
19. Escalon MP and Hagemeister FB. AIDS-Related Malignancies. Kantarjian HM, Wolff Ra, and Koller CA. MD Anderson Manual of Medical Oncology. McGraw-Hill; 2006. 903-910.

