Introdução
A doença de anticorpos anti-membrana basal glomerular (DAAMBG), carateriza-se pela associação de glomerulonefrite e hemorragia pulmonar, na qual anticorpos circulantes são dirigidos contra um antigénio intrínseco à membrana basal glomerular/alveolar1,2. Têm por alvo uma subunidade do domínio não colagenoso da cadeia alfa 3 do colagénio tipo IV1-3, que, após a sua ligação aos epítopos, ativam a cascata do complemento1,3 resultando em lesão tecidular. É uma doença rara com incidência de 0.1 a 1 caso por milhão por ano1-5. Atinge principalmente a terceira e sétima décadas1,3,5 com predomínio do género masculino em idades precoces1,2.
Embora exista forte evidência da importância da predisposição genética1,2,3,5, fatores adicionais serão necessários para a expressão da doença1. A literatura recente sugere que um insulto inicial à vasculatura pulmonar é responsável pela exposição dos capilares alveolares aos anticorpos anti-membrana basal glomerular (anti-MBG), entre os quais o tabagismo1,3,5,6, infeções respiratórias1,2 e inalação de cocaína1,6.
Caso clínico
Homem de 25 anos, caucasiano, trabalhador em hotelaria, fumador e com consumo prévio esporádico de tetrahidrocanabinóides, sem outros antecedentes patológicos ou medicação habitual. Recorreu ao serviço de urgência por tosse, hemoptises e dispneia com dois dias de evolução. Havia tido episódio semelhante, autolimitado, dois meses antes, medicado empiricamente com antibioterapia. Negava quaisquer sintomas na revisão por aparelhos e sistemas. Ao exame objetivo encontrava-se hemodinamicamente estável e destacavam-se crepitações bilaterais dispersas na auscultação pulmonar. Apresentava gasimetria arterial sem alterações, anemia hipocrómica e microcítica, leucocitose com neutrofilia e elevação da proteína C reativa (PCR); radiografia de tórax com infiltrados pulmonares dispersos e bilaterais predominantemente à direita (figura 1).
Nas primeiras horas de admissão na enfermaria, já sob antibioterapia por presumível infeção respiratória, apresentou agravamento clínico, com necessidade de admissão no Serviço de Medicina Intensiva Polivalente: intensificação das hemoptises com disfunção respiratória grave, compromisso severo das trocas gasosas (ratio PaO2/FiO2 mínimo 103), necessidade de ventilação mecânica invasiva, curarização e recurso a parâmetros ventilatórios agressivos e técnicas de recrutamento alveolar. Associadamente desenvolveu disfunção cardiovascular com necessidade de suporte vasopressor com noradrenalina na dose máxima de 0.2 ug/Kg/min e disfunção hematológica, com necessidade de suporte transfusional com 3 unidades de concentrado eritrocitário.
Da investigação etiológica (tabela 1) destacava-se elevação da velocidade de sedimentação eritrocitária (VS) e ausência de atingimento renal. A tomografia computorizada (TC) do tórax mostrou densificação pulmonar em vidro despolido, difusa e bilateral (figura 2). A broncofibroscopia mostrou hemorragia abundante na árvore brônquica; o lavado broncoalveolar revelou fundo mucoide, hemático e predomínio de macrófagos. Do estudo imunológico destacavam-se anticorpos anti-MBG positivos (43 U/mL), detetados a partir de imunoensaio fluoroenzimático (fluorescent enzyme immunoassay (FEIA)). Apesar de não ter atingimento renal, pela especificidade dos autoanticorpos, assumiu-se o diagnóstico de DAAMBG. Dada a gravidade da situação iniciou terapêutica tripla: plasmaferese, duas sessões iniciais com reposição integral com plasma, 4 sessões com reposição com 50% de plasma / 50% de albumina e 3 sessões com reposição com 25% de plasma / 75% de albumina (6 sessões diárias seguidas de 3 sessões em dias alternados); corticoterapia na forma de pulsos (metilpredisolona 1 g/dia durante 3 dias) seguido de administração diária de 1 mg/kg/dia de prednisolona, e ciclofosfamida em regime de administração diária (2 mg/Kg/dia). Cumpriu profilaxia para a pneumonia por Pneumocystis jiroveci. Evoluiu favoravelmente de forma rápida e sustentada após início da terapêutica, permitindo suspensão do suporte vasopressor um dia depois; trocas gasosas com ratio melhorado a permitir a progressão no desmame ventilatório, tendo suspenso suporte 7 dias após ter iniciado a terapêutica; em simultâneo constatada redução do título de anticorpos anti-MBG. Como intercorrências desenvolveu traqueobronquite nosocomial por Pseudomonas aeruginosa, tendo cumprido com sucesso ciclo de antibioterapia, e embolia pulmonar de baixo risco pelo que iniciou hipocoagulação sem intercorrências. Ao 16º dia foi transferido para internamento em enfermaria. Verificou-se recuperação clínica e radiológica, tendo alta hospitalar ao 30º dia de internamento, medicado com imunossupressão (corticosteroides e ciclofosfamida), profilaxias associadas (Pneumocystis jiroveci e osteoporose induzida pelos corticosteroides), e hipocoagulação que cumpriu por 6 meses. Como medidas não farmacológicas foi aconselhada a cessação dos hábitos tabágicos bem como a evicção de outros tóxicos. Foi recomendada vacinação contra a gripe e anti-pneumocócica iniciando o esquema com a vacina polissacárida conjugada de 13 valências.
No seguimento em consulta externa cumpriu 6 meses de ciclofosfamida, tendo iniciado posteriormente azatioprina que cumpriu durante 11 meses; a dose de corticosteroides foi reduzida gradualmente assim que atingida a remissão da doença. A remissão, clínica e laboratorial, foi atingida após três meses de terapêutica imunossupressora, persistindo após a suspensão da mesma, destacando-se a normalização do hemograma e VS, função renal e sedimento urinário inalterados, anticorpos anti-MBG negativos e normalização da TC torácica. Manteve seguimento em consulta regular a cada 4 meses.
DiscussãoO caso apresentado descreve uma forma invulgar de DAAMBG com atingimento pulmonar grave isolado. O curso clínico é variável mas menos de 10% têm doença limitada aos pulmões1,2,3,6; entre 60 a 80% dos doentes apresentam manifestações de doença pulmonar e renal1, esta tipicamente na forma de insuficiência renal aguda ou glomerulonefrite rapidamente progressiva2; 20-40% têm doença renal isolada. Os sintomas podem ter início insidioso ou progredir rapidamente, tornando-se uma condição clínica grave em poucos dias1. Neste caso, o doente já havia tido episódio autolimitado de hemoptises dois meses antes, o que poderia filiar-se em manifestações incipientes de uma doença que se veio posteriormente a apresentar de forma grave e rapidamente progressiva. Neste caso clínico, entre os possíveis fatores de risco para a expressão da doença encontram-se o tabagismo e o uso de tetrahidrocanabinóides (a relação com a DAAMBG está descrita6).
São achados comuns a elevação da VS e da PCR2, ambos presentes neste caso. Tal como manifesto pelo doente, no atingimento pulmonar da DAAMBG a hemoptise é o sintoma de apresentação acompanhada por tosse ou dispneia1. As manifestações clínicas bem como as alterações radiológicas, permitiram afirmar tratar-se de hemorragia pulmonar, à semelhança dos critérios utilizados na maioria dos estudos prévios6; o mesmo foi suportado pelos achados na broncofibroscopia e lavado broncoalveolar. A hemorragia pulmonar maciça e insuficiência respiratória são condições potencialmente fatais1. A gestão do doente em cuidados intensivos com a disfunção multiorgânica associada e o seu suporte agressivo demonstram a gravidade da situação e a mortalidade expectável associada. No caso clínico apresentado a deteção dos anticorpos anti-MBG foi fundamental, permitindo assumir o diagnóstico (evitando a biópsia pulmonar ou renal1,3) e instituir terapêutica dirigida. A plasmaferese demonstrou ser benéfica no tratamento da DAAMBG pela remoção de anticorpos1 e está recomendada nomeadamente em doentes que se apresentam com hemorragia pulmonar1,2, como neste caso. A intensidade e duração da plasmaferese não são claras mas sessões diárias ou em dias alternados são normalmente realizadas1,2, estratégia que foi adotada; deve manter-se durante 2-3 semanas ou até que o curso clínico do doente tenha melhorado e não sejam detetados anticorpos anti-MBG1,2. A terapia imunossupressora é necessária para inibir a produção de anticorpos1; tal como levada a cabo, inclui corticosteróides na forma de pulsos e/ou dose oral diária1,2; a ciclofosfamida pode ser administrada de forma intermitente por via intravenosa a cada 3 ou 4 semanas ou, alternativamente, como dose oral diária2. A duração da imunossupressão na DAAMBG não está definida; a ciclofosfamida poderá ser realizada por 2-9 meses de acordo com a evolução1, e a azatioprina pode ser opção em alternativa a ciclofosfamida no sentido de reduzir os efeitos adversos da última1, estratégia implementada neste caso. Da mesma forma a dose de corticosteroides deve ser reduzida gradualmente assim que atingida a remissão da doença2, situação que se verificou neste caso até a sua suspensão.
A terapêutica com plasmaferese, corticosteróides e outros agentes imunossupressores tem melhorado significativamente o prognóstico da DAAMBG, tendo em conta que se tratava de uma doença quase invariavelmente fatal1. O caso clínico demonstra a evolução favorável e rápida concordante com o início da terapêutica, confirmada clinicamente com a resolução progressiva das várias disfunções e analiticamente com a redução do título de anticorpos anti-MBG, dado relevante nesta patologia em que o título de autoanticorpos pode correlacionar-se com a gravidade da doença1,2 e tem valor prognóstico3. A taxa de sobrevivência aos 5 anos é superior a 80%1.
Trata-se de um caso de DAAMBG com uma forma rara e grave de apresentação, com necessidade de admissão em unidade de cuidados intensivos e uma elevada taxa de mortalidade associada. Com o diagnóstico, suporte orgânico e terapêutica tripla precoces é possível mudar o prognóstico expectável da doença.
Quadro I
Estudo analítico e exames microbiológicos.
| Análise | Resultado / Unidade | Valor de referência |
| | | |
| Hemoglobina | 10.4 g/dL | 13.5 - 17.5 |
| Leucócitos | 13.0 x 10^9/L | 4.0 - 11.0 |
| Plaquetas | 393 x 10^9/L | 150 - 450 |
| Velocidade de sedimentação | 29 mm | 0 - 12 |
| Proteína C Reativa | 35.8 mg/L | < 5.0 |
| Tempo de Protrombina / INR | 11.3 (Normal 11.2) / 1.0 | |
| Tempo de Tromboplastina Parcial Ativada | 32.8 (Normal 31.0) | |
| Sódio | 134 mmol/L | 136 - 145 |
| Potássio | 4.3 mmol/L | 3.5 - 5.1 |
| Glicose | 84 mg/dL | 70 - 105 |
| Ureia | 49 mg/dL | 19 - 44 |
| Creatinina | 0.8 mg/dL | 0.7 - 1.3 |
| Aspartato aminotransferase | 19 U/L | 5 - 34 |
| Alanina aminotransferase | 15 U/L | 0 - 55 |
| Gama glutamiltransferase | 17 U/L | 12 - 64 |
| Fosfatase alcalina | 44 U/L | 40 - 150 |
| Proteínas totais | 5.5 g/dL | 6.4 - 8.3 |
| Albumina | 3.6 g/dL | 3.5 - 5.0 |
| IgA, IgG, IgM e IgE | Normais | |
| Ferro | 18 µg/dL | 65 - 175 |
| Capacidade de fixação do ferro | 336 µg/dL | 250 - 425 |
| Ferritina | 194 ng/mL | 21.81 - 274.66 |
| Taxa de saturação da transferrina | 5.4 % | 20.0 - 50.0 |
| Vitamina B12 | 275 pg/mL | 189 - 883 |
| Ácido fólico | 2.2 ng/mL | 3.0 - 20.0 |
| Creatinina cinase | 39 U/L | 30 - 200 |
| Mioglobina | 14.7 ng/mL | < 140.0 |
| Urina tipo II EB pH Densidade Leucócitos Nitritos Proteínas Glicose Corpos cetónicos Urobilinogénio Bilirrubina Eritrócitos ESU Células epiteliais escamosas Células tubulares renais Leucócitos Eritrócitos | 6.00 1.006 Negativo Negativo Negativo Normal Negativo Normal Negativo Negativo [0-2]/campo (A=100 X) [0-2]/campo (A=100 X) [2-5]/campo (A=400 X) [0-2]/campo (A=100 X) | 4.80 - 7.40 1.003 - 1.030 |
| Serologias do vírus da hepatite B (antigénio HBs, anticorpos anti-HBs e anti-HBc) | Negativo | |
| Anticorpo anti vírus da hepatite C | Negativo | |
| Anticorpo anti vírus da imunodeficiência humana | Negativo | |
| Pesquisa de Legionella pnemophila na urina (serogrupo 1) | Negativo | |
| Anticorpos anti citomegalovírus (IgM e IgG) | IgM negativo / IgG positivo | |
| Anticorpos anti Mycoplasma pneumonia (IgM e IgG) | Negativo | |
| Hemoculturas (aeróbios e anaeróbios) | Negativo | |
| Exame bacteriológico do lavado broncoalveolar | Negativo | |
| Exame micobacteriológico do lavado broncoalveolar | Negativo | |
| Pesquisa de anticoagulante lúpico | Negativo | |
| Anticorpos anti cardiolipina (IgM e IgG) | Negativo | |
| Anticorpos anti β2-glicoproteína (IgM e IgG) | Negativo | |
| Anticorpos antinucleares | Negativo | |
| Anticorpos anti ds-DNA | Negativo | |
| Anticorpos anti citoplasma de neutrófilo | Negativo | |
| Anticorpos anti membrana basal glomerular | Positivo (43 U/mL) | Negativo: < 0.7 Positivo: > 1.0 |
| Anticorpos anti citrulina | Negativo | |
| Anticorpos anti Sm | Negativo | |
| Anticorpos anti SCL70 (anti-topoisomerase) | Negativo | |
| Anticorpos anti Jo-1 | Negativo | |
EB, Exame Bioquímico; ESU, Exame do Sedimento Urinário; Ig, Imunoglobulina; INR, international normalized ratio.
Figura I
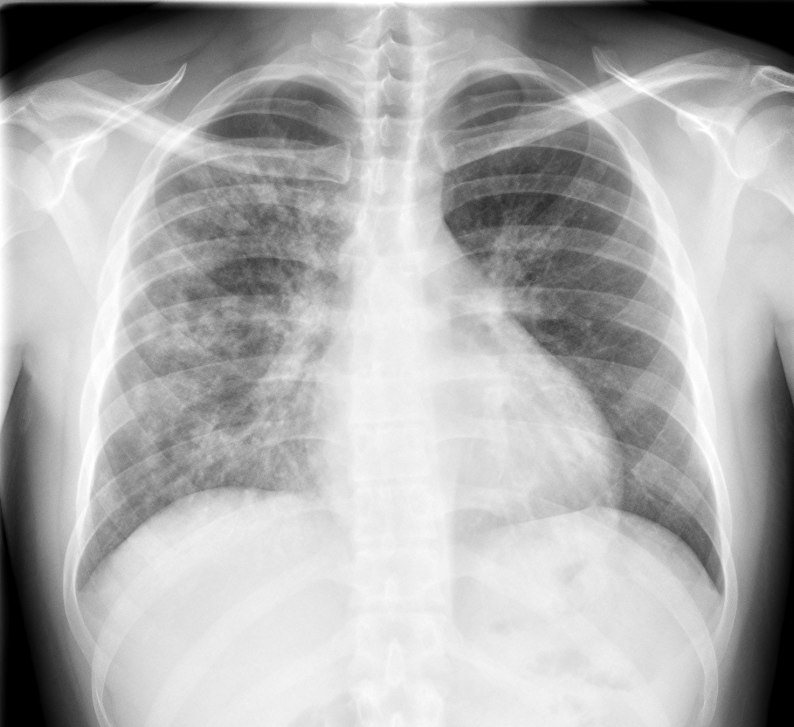
Radiografia do tórax.
Figura II
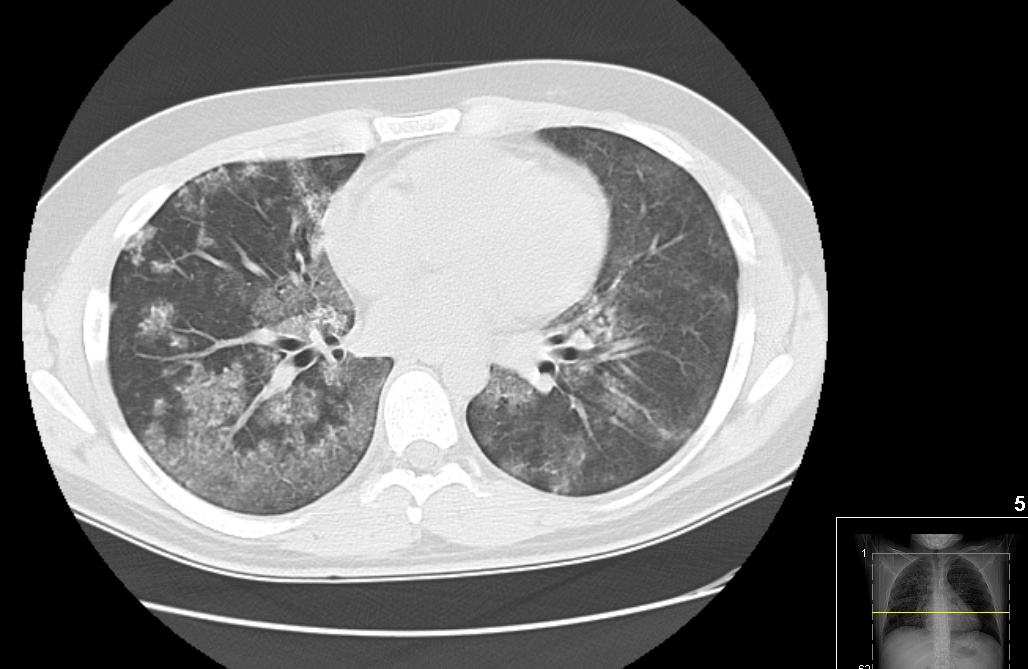
Tomografia computorizada do tórax.
BIBLIOGRAFIA
1. Greco A, Rizzo MI, De Virgilio A, Gallo A, Fusconi M, Pagliuca G, et al. Goodpasture´s syndrome: A clinical update, Autoimmun Rev 2015;14(3):246-253.
2. Lahmer T, Heemann U. Anti-glomerular basement membrane antibody disease: A rare autoimmune disorder affecting the kidney and the lung, Autoimmun Rev 2012;12(2):169-173.
3. Hellmark T, Segelmark M. Diagnosis and classification of Goodpastures disease (anti-GBM). J. Autoimmun. 2014;48-49:108-112.
4. Bolton WK. Goodpasture’s syndrome. Kidney Int 1996;50(5):1753-1766.
5. Gibelin A, Maldini C, Mahr A. Epidemiology and Etiology of Wegener Granulomatosis, Microscopic Polyangiitis, Churg-Strauss Syndrome and Goodpasture Syndrome: Vasculitides with Frequent Lung Involvement. Semin Respir Crit Care Med. 2011;32:264-273.
6. Lazor R, Bigay-Game L, Cottin V, Cadranel J, Decaux O, Fellrath JM, et al. Alveolar Hemorrhage in Anti-Basement Membrane Antibody Disease A Series of 28 Cases. Medicine 2007;86:181-193.



