Introdução
A síndrome de lise tumoral (SLT) é uma emergência oncológica. Associada, na maioria dos casos, a neoplasias hematológicas de alto índice proliferativo - nomeadamente leucemia linfoblástica aguda e linfomas não-Hodgkin de alto grau - tem vindo a ser descrita com mais frequência, inclusivamente em contexto de neoplasias sólidas.1,2 Este aumento da incidência reportada traduz provavelmente o aumento do reconhecimento desta condição e a utilização de fármacos citotóxicos novos, mais eficazes e em esquemas combinados. 1,3
A lise das células neoplásicas ocorre em resposta à terapêutica citotóxica e, raramente, de forma espontânea 2,3-5. Do processo de lise decorre libertação rápida e maciça do conteúdo celular para a corrente sanguínea – incluindo potássio, fosfato, ácidos nucleicos e mediadores inflamatórios. A degradação dos ácidos nucleicos leva à formação de xantinas e de ácido úrico - produto final desta via metabólica, hidrossolúvel e com excreção renal. Da incapacidade dos mecanismos de excreção renal em lidar com a excessiva carga metabólica, decorrem as alterações metabólicas e eletrolíticas características – hiperuricemia, hipercalemia, hiperfosfatemia e hipocalcemia secundária – que se manifestam clinicamente com lesão renal aguda (LRA), disritmias e alterações neurológicas várias, incluindo crises convulsivas. A activação de vias de sinalização com libertação de citocinas inflamatórias pela lise celular condiciona uma resposta inflamatória sistémica maciça, que pode evoluir com disfunção multiorgânica. 1, 2, 6, 7
A disrupção dos mecanismos homeostáticos é agravada na presença de lesão renal, com consequente perpetuação das alterações metabólicas. São vários os mecanismos que contribuem para a LRA neste contexto. A obstrução intra-renal a nível tubular - por cristalização de ácido úrico, xantinas e fosfato de cálcio - é o mais significativo. Outros contributos para LRA incluem: nefrotoxicidade do ácido úrico (que condiciona lesão por mecanismos independentes da formação de cristais, incluindo vasoconstrição renal, diminuição da taxa de filtração glomerular e inflamação local), hipovolemia, resposta inflamatória sistémica e fármacos nefrotóxicos frequentemente necessários pela situação clínica basal. 1, 7, 8
A hipocalcemia desenvolve-se secundariamente à precipitação de cristais de fosfato de cálcio, a nível intratubular ou noutros tecidos. De referir que nos casos de SLT espontânea, pode não ocorrer hiperfosfatemia – o que se deve à proliferação das células neoplásicas, com alto índice mitótico, que rapidamente reutilizam o fosfato libertado pela lise celular 1, 7.
Na definição de SLT, proposta por Cairo e Bishop em 2004, esta pode ser classificada em laboratorial - identificação de duas ou mais alterações metabólicas no período de tempo compreendido entre três dias antes ou sete dias após o início da quimioterapia – ou clínica 2. Esta definição tem várias limitações: está implícito o início de quimioterapia, não tendo em conta as situações de SLT espontânea; utiliza um valor de creatinina sérica superior a 1.5 vezes o normal como critério diagnóstico de LRA; não refere a necessidade de instalação simultânea das alterações metabólicas 2,9. A própria distinção entre síndrome laboratorial e clínica tem interesse epidemiológico, mas não se reflecte em termos de actuação terapêutica 2,7,9. Na era dos novos agentes hipouricemiantes, as recomendações são cada vez mais para o tratamento agressivo das alterações laboratoriais, de forma a evitar o desenvolvimento de manifestações clínicas ameaçadoras de vida 1,7,9,10. Apesar das limitações inerentes, esta é actualmente a classificação mais utilizada.
Caso Clínico
Apresentamos o caso de um homem de 66 anos, com hipertensão arterial essencial, diabetes mellitus de tipo II e dislipidemia bem controladas e cardiopatia isquémica, revascularizada e com boa função sistólica biventricular. Estava medicado com ácido acetilsalicílico (AAS), bloqueador-beta, inibidor da enzima de conversão da angiotensina (IECA) e estatina.
Recorreu ao hospital por quadro de astenia, anorexia, desconforto epigástrico e aumento do perímetro abdominal com 15 dias de evolução. Negava sintomas B, perdas hemáticas ou outra sintomatologia de relevo. Na tomografia computorizada (TC) toraco-abdominal (figura 1) eram visíveis múltiplas adenopatias retroperitoneais e mediastínicas, fígado heterogéneo com vários nódulos sólidos pericentimétricos sugestivos de metástases, ascite e realce peritoneal sugestivo de carcinomatose. A TC não evidenciou esplenomegalia, hidronefrose ou alterações do parênquima renal. O doente foi internado para estudo do quadro.
O estudo efectuado na admissão documentou hiperuricemia (15.4 mg/dl), desidrogenase láctica (DHL) elevada (1010 U/L), com função renal (creatinina plasmática de 1mg/dl, taxa de filtração glomerular de 72 ml/min), fósforo, cálcio e potássio dentro dos limites da normalidade. As serologias VIH, VHC e VHB foram negativas. Foi realizada paracentese diagnóstica, com exame citológico do líquido peritoneal sem células neoplásicas. Os exames endoscópicos não evidenciaram alterações. O exame histológico do produto da biópsia de um dos nódulos hepáticos permitiu estabelecer o diagnóstico preliminar de linfoma de alto grau.
Ao 11º dia de internamento constatou-se lesão renal aguda oligúrica com rápido agravamento (creatinina plasmática aumentou de 2.6 para 5.9mg/dl em <24h). Foram excluídos contributos pré-renal e nefrotóxico. O exame sumário de urina mostrava pH ácido e cristais.
Foram constatadas alterações analíticas sugestivas de SLT: DHL aumentada (1386U/L), hiperuricemia (38mg/dl) e hiperfosfatemia (14.5mg/dl) graves, hipercaliemia (5.3mEq/L) e hipocalcemia (cálcio corrigido 8.1 mg/dl). Associadamente foi documentada acidose metabólica com lactatos 2.8 mmol/L e HCO3- 18 mmol/L, sem acidemia. A exclusão de hidronefrose e obstrução, com ecografia e TC, sugere como mecanismo de lesão renal a precipitação intratubular de cristais de ácido úrico e fosfato de cálcio. Foi admitido o diagnóstico de SLT espontânea.
O doente foi admitido na Unidade de Cuidados Intermédios Polivalente e iniciou fluidoterapia agressiva, rasburicase (0.2 mg/kg) e sevelamer. Por má tolerância à fluidoterapia, com desenvolvimento de estase, e evolução para anúria, sem resposta a bólus de diurético de ansa, iniciou hemodiálise. Apresentou melhoria clínica, dos desequilíbrios eletrolíticos e parâmetros de lise, com franca diminuição dos níveis de ácido úrico (4.8 mg/dl, 12 horas após a toma de rasburicase). Fez no total três sessões de hemodiálise com melhoria progressiva da função renal.
Com base no resultado definitivo da biópsia de um dos nódulos hepáticos e biópsia de medula óssea foi estabelecido o diagnóstico definitivo de linfoma não-Hodgkin de células B, tipo Burkitt (figura 2), estadio IV-B IPI-4. O doente iniciou citorredução com prednisolona e ciclofosfamida e foi transferido para outra instituição, dedicada a doentes com neoplasia deste foro. Completou tratamento com 6 ciclos do esquema R-CHOP e alta dose de metotrexato para profilaxia do atingimento do sistema nervoso central. Após 6 meses de seguimento apresentava remissão completa, sem recidiva da SLT.
Discussão
Este caso traduz a necessidade de identificação precoce dos doentes em risco de lise tumoral, a possibilidade do desenvolvimento espontâneo desta síndrome e a importância do tratamento atempado com rasburicase. É importante considerar a SLT como parte do diagnóstico diferencial da LRA em doentes com neoplasia e perceber que esta pode ser a primeira manifestação da mesma 8.
A profilaxia é fulcral 6,7,9,11. Identificar os doentes em risco de SLT, estratificar este risco e instituir terapêutica profilática adequada é uma questão central e que tem sido objecto de investigação. Existem várias classificações de risco, que têm em conta factores como o tamanho da massa tumoral (sendo particularmente importante a presença de invasão medular e metastização difusa), o índice mitótico do tumor e o potencial de lise (nomeadamente a sensibilidade à quimioterapia) 1, 6, 11, 12.
Outros factores de risco incluem a nefropatia prévia, hipovolemia - frequente nos doentes neoplásicos, por efeito secundário da quimioterapia e diminuição de ingestão hídrica, - utilização concomitante de nefrotóxicos e pH urinário ácido 1, 6, 11, 12. Alguns autores colocam a hipótese de que a toma de AAS aumente a susceptibilidade para SLT, uma vez que este fármaco inibe a secreção tubular de ácido úrico 1. No caso apresentado coexistiam vários dos factores de risco conhecidos para SLT: neoplasia de alto índice mitótico, invasão orgânica com metastização hepática e medular, utilização prévia de contraste e AAS e pH urinário ácido.
A classificação de risco proposta por Cairo e Coifier em 2010 desenvolve-se em três fases sequenciais: avalia os níveis basais de ácido úrico, fosfato e potássio; tem em conta os factores decorrentes do tipo e massa tumoral já referidos e integra ainda o risco decorrente da idade e nefropatia prévia. Com base nestes critérios classifica os doentes em três níveis de risco (baixo, intermédio e alto), com implicação imediata no tipo de profilaxia a instituir 6.
A estratégia de prevenção passa por hiperhidratação profilática e agentes hipouricemiantes - rasburicase nos casos de alto risco e alopurinol nos restantes 1, 10-11. A importância do adequado fornecimento hídrico é absolutamente fundamental e influencia não só a probabilidade de desenvolvimento da SLT como a sua gravidade 6 ,7, 14-15.
O alopurinol, um inibidor da xantina oxídase, inibe a degradação de xantina em ácido úrico. Consequentemente, condiciona a elevação da concentração sérica e urinária de xantina, metabolito pouco solúvel e com potencial para cristalizar a nível dos túbulos renais e contribuir para a LRA. Por outro lado, apesar de impedir a formação de novas moléculas de ácido úrico, não resolve a hiperuricemia estabelecida. Tendo em conta estes mecanismos, tem um papel na profilaxia da SLT, mas não é eficaz na presença da SLT estabelecido 10,14-15.
A melhor abordagem da SLT estabelecida passa por fluidoterapia agressiva e diminuição dos níveis de ácido úrico. A rasburicase, uma oxídase do urato recombinante, leva à degradação do ácido úrico em alantoína - metabolito 10 vezes mais solúvel do que o ácido úrico. Na comparação direta com o alopurinol, a rasburicase mostrou-se notoriamente mais eficaz, quer ao nível da prevenção quer no tratamento da SLT estabelecido16.
Aprovado pela Agência Europeia do Medicamento em 2001, tornou-se o fármaco de primeira linha na profilaxia das situações de alto risco e no tratamento dos casos de SLT estabelecida 1,10.
Um dos produtos finais de degradação de ácido úrico pela rasburicase é o peróxido de hidrogénio. Por este motivo, a sua utilização está contraindicada em indivíduos com défice de desidrogenase da glicose-6-fosfato, pelo risco de anemia hemolítica e metemoglobinemia fatal17.
Concomitantemente, perante LRA em agravamento e alterações hidroeletrolíticas graves e refratárias à terapêutica médica pode ser necessária a instituição de técnica de substituição renal (TSR).
É fundamental a vigilância dos níveis de cálcio, pelo risco de hipocalcemia secundária. A correção da hipocalcemia não sintomática não é recomendada, pelo risco associado à deposição tecidular de fosfato de cálcio após administração de cálcio 1,7, 14.
Apesar da ausência de estudos que comprovem o benefício dos quelantes do fósforo, estes são tipicamente utilizados. Não há, actualmente, indicação para alcalinização urinária - apesar do aumento da solubilidade do ácido úrico em meio com pH alcalino, este simultaneamente favorece a precipitação de cristais de fosfato de cálcio e contribui para o agravamento da hipocalcemia secundária 1, 7, 14.
O potencial de agravamento rápido destes doentes e a necessidade de vigilância apertada (incluindo das alterações disrítmicas) aconselham nível de monitorização em unidade diferenciada para tal, como aconteceu no caso apresentado.
Relativamente ao prognóstico dos doentes com SLT, há que ter em conta várias considerações. A SLT é mais frequente em neoplasias mais agressivas - alto índice proliferativo, carga tumoral elevada e metastização difusa. Por outro lado, o desenvolvimento da SLT após o início da quimioterapia reflecte a sensibilidade da neoplasia à terapêutica instituída. Não existem ensaios randomizados que avaliem a mortalidade como outcome primário. No contexto da SLT, o desenvolvimento de LRA está claramente identificado como factor de mau prognóstico 18.
O reconhecimento precoce e tratamento agressivo podem levar à recuperação completa da função renal, inclusivamente nos casos mais graves e com necessidade de TSR, tal como demonstrado no caso descrito 1, 14, 18.
A rápida resolução da SLT com recurso a rasburicase possibilita manter a estratégia terapêutica, não ficando esta condicionada pela existência de distúrbios iónicos ou disfunção renal persistentes, como acontecia quando os doentes eram tratados com recurso a alopurinol. Este caso ilustra ainda as actuais possibilidades terapêuticas perante neoplasias avançadas e o bom prognóstico de uma situação que, aparentemente, pareceria irremediável.
------------------------------
Agradecimentos: ao Dr. Carlos Sottomayor, pela colaboração no caso.
Figura I
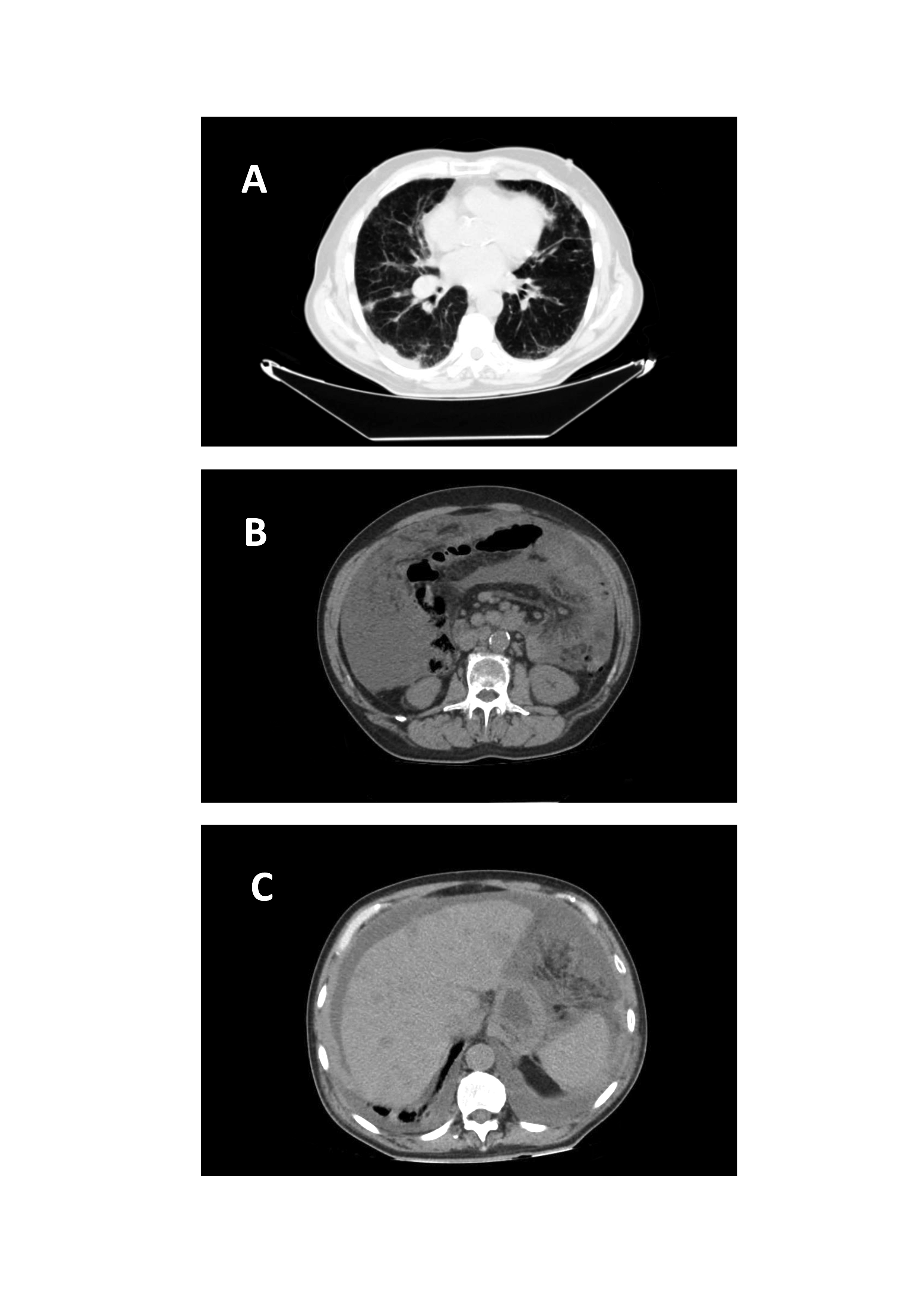
Tomografia computorizada toraco-abdominal à admissão com evidência de múltiplas adenopatias mediastínicas (A) e retroperitoneais (B), ascite e fígado com textura heterogénea e várias formações nodulares sólidas sugestivas de metastização (C).
Figura II
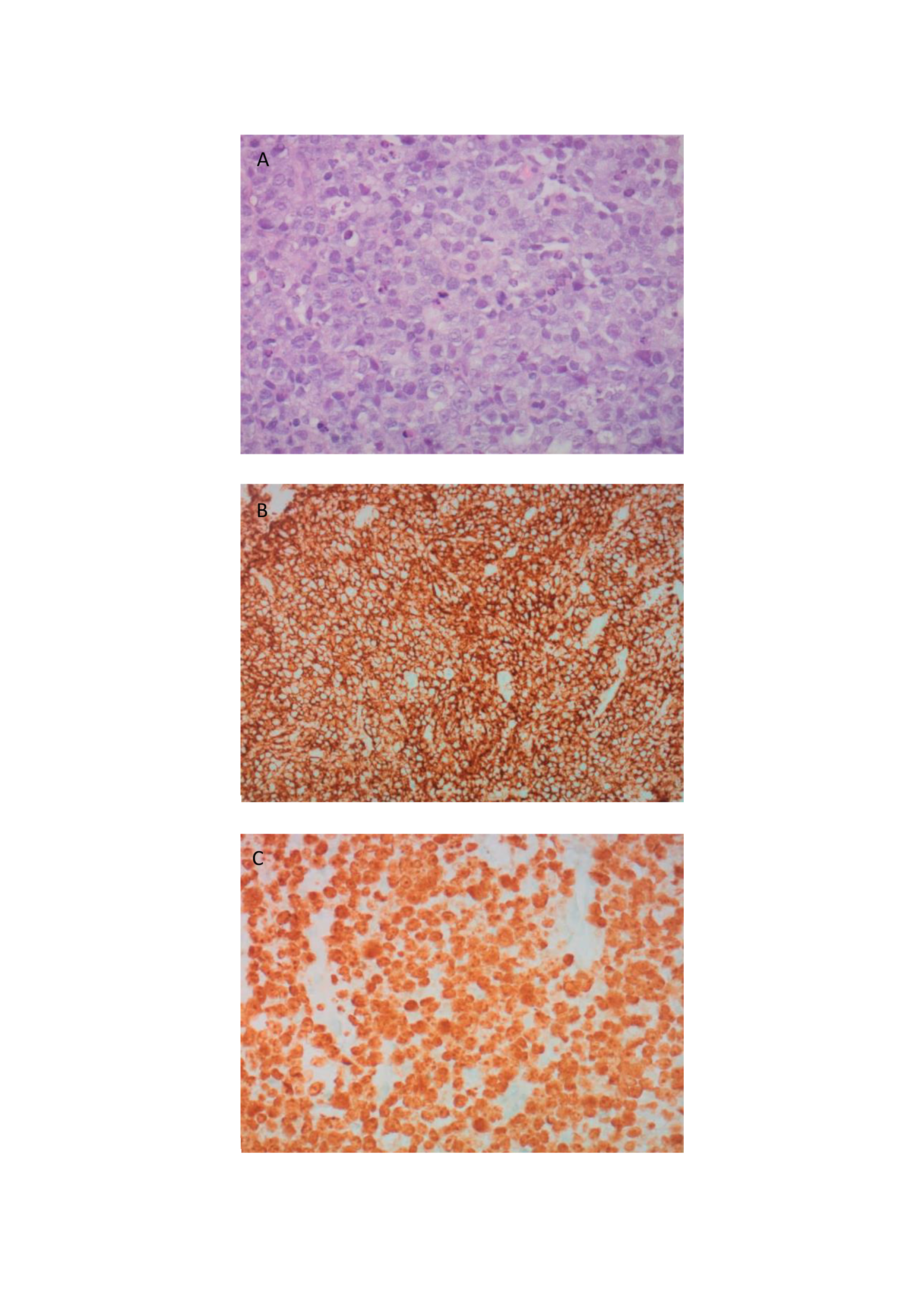
Estudo histológico e imunohistoquímico da biópsia de um dos nódulos hepáticos: A Hematoxilina-eosina; B Imunohistoquímica positiva para CD20; C Imunohistoquímica positiva para Ki67, evidenciando índice proliferativo de 100%.
BIBLIOGRAFIA
Bibliografia
1- Howard S, Jones D, Pui CH. The tumour lysis syndrome. N Engl J Med 2011; 364: 1844-54.
2- Cairo MS, Bishop M. Tumour lysis syndrome: new therapeutic strategies and classification. Br J Haematol 2004; 127:3-11.
3-Riccio B, Mato A, Olson E, Berns JS, Luger S. Spontaneous tumour lysis in acute myeloid leukaemia – two cases and a review of the literature. Cancer Biol Ther 2006. 5 (12): 1614-17.
4- Kekre N, Djordjevic B, Touchie C. Spontaneous tumour lysis syndrome. CMAJ 2012; 184 (8) 913-916.
5-Shenoy C. Acute spontaneous tumour lysis syndrome in a patient with squamous cell carcinoma of the lung. Q J Med 2009; 102: 71-73.
6- Cairo MS, Coiffier B, Reiter A, Younes A et al. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: an expert TLS panel consensus. Br J Haematol, 2010. May;149(4):578-86.
7- Wilson FP, Berns JS. Tumour Lysis Syndrome: New challenges and recent advances. Advances in chronic kidney disease. 2014; 21 (1): 18-26.
8- Lameire N, Vanholder R, Biesen W, Benoit D. Acute kidney injury in critically ill cancer patients: an update. Critical Care 2016; 20:209.
9- Namendys-Silva S, Arredondo-Armenta J, Plata-Menchaca E, Guevara-Garcia H et al. Tumour lysis syndrome in the emergency department: challenges and solutions. Open Access Emerg Med 2015; Aug 20; 7:39-44.
10 - Jones G, Will A, Jackson G, Webb N and Rule S. Guidelines for the management of tumour lysis syndrome in adults and children with haematological malignancies on behalf of the British Committee for Standards in Haematology. British Journal of Haematology, 2015, 169, 661–671.
11- Cairo MS, Coiffier B. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome in adults and children with malignant disease. Br J Haematol 2010; 149:578-86.
12- Montesinos P, Lorenzo I, Martin G et al. Tumour lysis syndrome in patients with acute myeloid leukaemia: identification of risk factors and development of a predictive model. Hematol. 2008. 93 (1): 67-74.
13- Darmon M, Malak S, Guichard I, Schemmer B. Acute tumour lysis: a comprehensive review. Revista Bras Ter Intensiva 2008; 20(3):278-285.
14- Zuckerman T, Ganzel C, Tallman MS, Rowe J. How I treat hematologic emergencies in adults with acute leukaemia. Blood. 2012; 120 (10) 1993-2002.
15- Holdsworth MT, Nguyen P. Role of allopurinol and rasburicase in tumour lysis syndrome. Am J Health Syst Pharm 2003; 60:2213-22.
16 - Goldman SC, Holcenberg JS, Finklestein JZ, et al. A randomized comparison betweenrasburicase and allopurinol in children with lymphoma or leukemia at high risk for tumor lysis. Blood 2001;97: 2998-3003.
17 - Browning LA, Kruse JA. Hemolysis and methemoglobinemia secondary to rasburicase administration. Ann Pharmacother. 2005; 39(11):1932-1935.
18- Darmon M, Guichard I, Vincent F, Schlemmer B, Azoulay E. Prognostic significance of acute renal injury in acute tumor lysis syndrome. Leuk Lymphoma. 2010; 51 (2): 221-227.



