Introdução:
Desde a medicina hipocrática, no século V antes de Cristo, que existem descrições de dedos em baqueta de tambor – hipocratismo digital ou dedos hipocráticos -, tendo sido um dos primeiros sinais clínicos descritos1. Este sinal define-se pela presença de alterações apenas dos tecidos moles e unhas dos dedos das mãos e pés.2
A osteoartropatia hipertrófica (OH) caracteriza-se pela proliferação anormal da pele das extremidades distais e pela proliferação periostal dos ossos longos.1 A tríade característica desta síndrome é o hipocratismo digital, a reacção periostal dos ossos longos das extremidades e alterações semelhantes a artrite, simétricas nas articulações e tecidos periarticulares.1,3,4,5,6 Pode ser primária ou secundária (95% dos casos)3, associando-se esta a doenças pulmonares (infecciosas, tumorais ou estruturais), pleurais (empiema ou tumores primários da pleura), mediastínicas (como Linfoma de Hodgkin), cardíacas cianóticas e gastrointestinais (cirrose biliar primária, abcessos hepáticos, colite ulcerosa, enterite regional e polipose cólica).1,2,4,7 A forma primária, de transmissão hereditária, autossómica dominante com penetrância incompleta,denomina-se paquidermoperiostose ou síndrome de Touraine-Solente-Golé. Foi descrita pela primeira vez em 1935 e é pouco frequente (apenas 5% dos casos de OH), apresenta predomínio pelo sexo masculino numa relação 9:1 e na sua forma completa caracteriza-se por paquidermia (espessamento dos tecidos moles), periostose (acomete mais frequentemente o rádio, cúbito e tíbia) e dedos das mãos e pés em baqueta de tambor. Por ser mais rara que a forma secundária, o seu diagnóstico é de exclusão.8,9
Chama-se osteoartropatia hipertrófica pulmonar (OHP) à forma que ocorre na presença de doença pulmonar1 e é por esse motivo que, historicamente, os doentes com diagnóstico de tuberculose pulmonar realizavam radiografias das extremidades.2
A OHP ocorre em 0.2-17% dos casos de carcinoma do pulmão, dependendo das séries, mas nos estudos que incluem maior número de doentes, a incidência tem sido inferior a 1%3.
Os mecanismos da doença não estão totalmente esclarecidos, mas foram propostos dois modelos: hipótese neurogénica e hipótese bioquímica. Na primeira, os órgãos inervados pelo nervo vago e que sejam acometidos pela doença, induzem uma resposta reflexa que provoca vasodilatação com aumento do afluxo sanguíneo às extremidades. Na hipótese bioquímica, a mais aceite actualmente, a causa mais provável prende-se com libertação de citocinas e factores de crescimento como PDGF (platelet-derived growth factor), prostaglandina E2 e VEGF (vascular endotelial growth factor) pelas células acometidas. Como muitos destes factores são induzidos pela hipóxia, poder-se-á explicar o aparecimento desta síndrome nas doenças pulmonares e cardíacas hipoxemiantes e neoplasias.1,3,5,7
Caso Clínico:
Homem, 57 anos, ex-fumador (55 unidades maço/ano), status pós gastrectomia total (adenocarcinoma tipo intestinal) em 2013 e nódulo do pulmão em vigilância desde a mesma altura. Observado no Serviço de Urgência por dor e edema pretibial direitos, com telerradiografia da perna a revelar espessamento cortical e reacção periostal da tíbia (Imagem 1). Referenciado à consulta de Medicina Interna. Aí, apresentava extensão bilateral e simétrica da dor, edema dos joelhos, cotovelos, punhos e dedos (Imagem 2). A investigação analítica excluiu causa infeciosa (incluindo tuberculose) e auto-imune; a tomografia computorizada (TC) da perna direita mostrou espessamento cortical e reacção periostal reactiva (Imagem 3) e a TC de tórax, lesão espiculada sugestiva de neoplasia (Imagem 4). Realizou broncofibroscopia que foi inconclusiva e biópsia aspirativa transtorácica (BATT) com exame anatomo-patológico a revelar a presença de adenocarcinoma do pulmão. Foi assumida osteoartropatia hipertrófica secundária a adenocarcinoma do pulmão. Durante os dois meses de seguimento assistiu-se a agravamento clínico e imagiológico rapidamente progressivos. Não havendo indicação para terapêutica curativa e com dificuldade na gestão da sintomatologia em ambulatório (queixas álgicas intensas e dispneia) que lhe conferia um ECOG Performance Status10 grau 5 (quando o inicial era 1), foi internado para controlo álgico, conforto e dignidade no fim de vida. Faleceu ao 23º dia de internamento.
Discussão:
Apresentamos um caso de OHP em contexto de adenocarcinoma do pulmão, onde a abordagem inicial incluiu estudo de poliartralgias generalizadas, num doente de 57 anos, história prévia de adenocarcinoma gástrico submetido a tratamento cirúrgico, carga tabágica não desprezível e nódulo do pulmão em vigilância. Foi realizado estudo complementar para excluir doença auto-imune, infecciosa (incluindo infecções virais e tuberculose pulmonar ou óssea) e doença neoplásica. Embora o nódulo do pulmão estivesse presente há pelo menos 2 anos, parecia ter havido um discreto aumento dimensional no exame radiológico mais recente e, atendendo aos antecedentes pessoais do doente, a presença de neoplasia pareceu-nos mais provável, efectuando assim estudo imagiológico complementar com TC de tórax sugestivo a presença de neoformação pulmonar. Nesta altura, ponderámos as hipóteses de se tratar de metastização pulmonar de adenocarcinoma gástrico previamente excisado ou de neoplasia primária do pulmão. Durante o processo de investigação, o facto de ter existido aumento da massa pulmonar comparativamente ao exame anterior, veio a dar mais consistência à hipótese de se tratar de um tumor primário do pulmão. O diagnóstico foi confirmado histologicamente após realização de BATT, com o exame anatomopatológico a evidenciar adenocarcinoma do pulmão.
A OHP, também conhecida como síndrome de Pierre Marie-Bamberger, foi primeiro descrita por Bamberger em 18897 e refere-se aos casos em que, na presença de patologia pulmonar subjacente, existem alterações radiológicas típicas e evidentes dos ossos e tecidos moles.2 Em aproximadamente 90% dos casos, associa-se a neoplasia intra-torácica e, dentro destas, 80% correspondem a neoplasia maligna do pulmão.3,5
Num estudo realizado por Ito e colaboradores em 20103, estão descritas as características clínicas dos doentes com neoplasia do pulmão com OHP, de onde se destaca que esta associação é mais frequente em homens com idade média de 63 anos, com história actual ou pregressa de tabagismo e com tumores em estadios avançados. Dentro das características histológicas do tumor, percebeu-se que o adenocarcinoma foi a neoplasia mais comumente associada (53% dos casos), seguida do carcinoma de células escamosas (21% dos casos).3
Num estudo publicado mais tarde por Qian e Qin7, em 2014, voltou a confirmar-se a forte associação com adenocarcinoma (48% dos casos). No caso concreto do adenocarcinoma do pulmão, embora seja a associação mais frequente, apenas 0.75% dos doentes com esta neoplasia desenvolvem OHP. Estes resultados foram concordantes com outras séries publicadas previamente.3,7
O diagnóstico de OHP baseia-se em sintomas e sinais clínicos e alterações imagiológicas típicas.2,3,5 Os doentes podem apresentar-se com qualquer um dos aspectos característicos desta patologia, sendo rara a presença da tríade já referida.1,3,6 No nosso caso clínico, no entanto, estavam presentes os três achados, associados ainda a dor intensa tipo queimadura no local dos ossos e articulações afectadas (mãos e pernas) que, tal como descrito na literatura, foi de muito difícil controlo.
As queixas álgicas, quando surgem relacionadas com OH, devem fazer suspeitar da presença de causa pulmonar subjacente – OHP.1,2
Não existem testes serológicos para o diagnóstico desta entidade, pelo que a anamnese, exame objectivo e exames complementares de diagnóstico de imagem têm um papel fundamental no diagnóstico.1
A telerradiografia das extremidades é, geralmente, o primeiro exame de imagem realizado e pode ter alterações mesmo em doentes assintomáticos. Os achados nos membros superiores incluem deformações bulbosas das extremidades, alteração da curvatura das unhas e edema do tecido mole. A periostose é o achado típico da OH e pode ser sólida, linear, densa ou em camadas. Aparece nos ossos longos, sendo os mais frequentemente afectados a tíbia (caso do nosso doente), o perónio, o rádio, o cúbito e as falanges dos dedos.1,2
O prognóstico da OH depende da patologia subjacente e, uma vez que em até 90% dos casos decorre de doença neoplásica avançada, a mortalidade é elevada.1
O tratamento de escolha é dirigido à doença de base e, no caso concreto da OHP, inclui cirurgia para ressecção do tumor ou quimio-radioterapia quando a primeira não está indicada. Excisando ou reduzindo as dimensões do tumor, há comprovada melhoria da sintomatologia e dos achados radiológicos.1,3,7 Uma vez que, na maioria das vezes, a cirurgia não é elegível, tem havido alguns estudos que têm demonstrado benefício na administração de hormona adrenocorticotrófica como adjuvante. A ablação por radiofrequência e o tratamento com inibidores do receptor da tirosina cinase também têm apontado bons resultados.7 Baseado no modelo da hipótese neurogénica, a vagotomia pode ser útil para alívio sintomático, até tratamento da causa subjacente, quando possível.1
No caso que apresentámos, pela progressão galopante da doença, encontrando-se o doente com ECOG Performance Status grau 5 e não tendo indicação cirúrgica ou para início de quimio-radioterapia, optou-se por internamento para medidas paliativas.
Este caso ilucida bem como tantos séculos após a descrição hipocrática dos ‘dedos em baqueta de tambor’, a OH continua a ser uma entidade importante e que é preciso reconhecer, dado a sua associação com doenças malignas, especialmente com a neoplasia do pulmão.1
Figura I
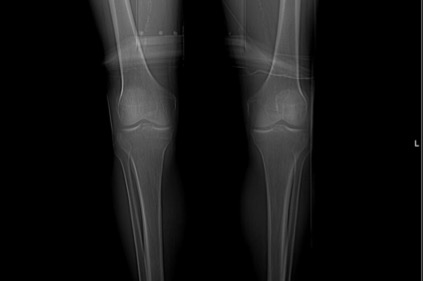
Telerradiografia das pernas: reacção periostal da tíbia, mais evidente à direita.
Figura II
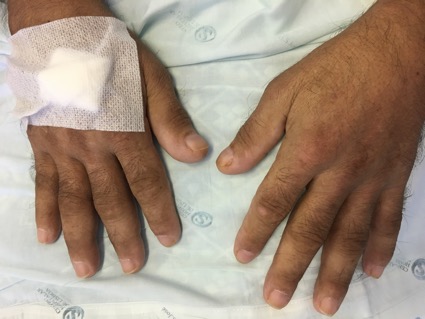
Mãos em baqueta de tambor.
Figura III
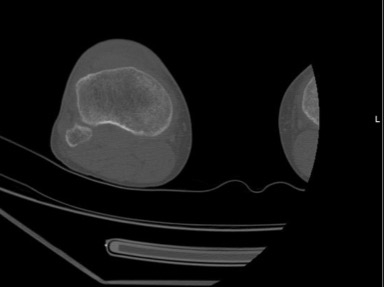
ografia computorizada da perna direita: espessamento cortical cortical da região mediana da tíbia.
Figura IV
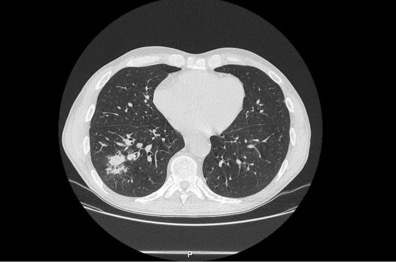
Tomografia computorizada de tórax: área de condensação parenquimatosa, homogénea, de limites irregulares espiculados no segmento apical inferior do pulmão direito.
BIBLIOGRAFIA
1. Yap, F.; Skalski, M.; Patel, D.; Schein, A.; Tomasin, A.; Masih, S.; Matcuk, G. Hypertrophic Osteoartropathy: Clinical and Imaging Features. RadioGraphics 2017; 37(1): 153-195
2. Skorneck, A.; Ginsburg, L. Pulmonary Hypertrophic Osteoartropathy (Periostitis) – Its Absence in Pulmonary Tuberculosis. N Engl J Med 1958; 258: 1079-1082
3. Ito, T.; Goto, K.; Yoh, K.; Niho, S.; Ohmatsu, H.; Kubota K.; Nagai, K., et al. Hypertrophic Pulmonary Osteoratropathy as a Paraneoplastic Manifestation of Lung Cancer. Journal of Thoracic Oncology. 2010; 5: 976-980
4. Moreira, L.; Melo, A.; Pinto, A.; Monteiro, N.; Marchiori, E. Osteoartropatia Hipertrófica Associada a Tuberculose Pulmonar – Relato de Caso. Radiol Bras 2002; 35(1): 55-58
5. Miller, R.; Illing, R.; Whealan, J. Lung carcinoma with hypertrophic osteoartropathy in a teenager. Rare tumors. 2011; 3(1): e8
6. Cengiz, A.; Eren, E.; Polatli, M.; Yurekli, Y. Hypertrophic pulmonary osteoartropathy on bone scintigraphy and 18F-fluorodeoxyglucose positron emission tomography/computed tomography in a patient with lung adenocarcinoma. Indian J Nucl Med. 2015; 30(3): 251-253
7. Qian, X.; Qin, J. Hypertrophic pulmonary osteoartropathy with primary lung cancer. Oncology Letters 2014; 7: 2079-2082
8. Santos-Durán, J.C.; Yuste-Chaves, M.; Martínez-González, O.; Pablo, M. T.; Sánchez-Estella, J. Paquidermoperiostosis (síndrome de Touraine-Soulente-Golé). Descripción de un caso. Actas Dermosifiliogr. 2007; 98: 116-20.
9. Siegenthaler, W. Differential Diagnosis in Internal Medicine – From Sympton to Diagnosis. 19ª edição, Alemanha: Thieme, 2007, pg. 400.
10. Oken, M.; Creech, R.; Tomey, D.; Horton, J.; Davis, T.; McFadden, E.; Carbone, P. Toxicity and Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-655





