Introdução
A doença intestinal inflamatória apresenta múltiplas manifestações extra-intestinais, entre elas a doença hepática, presente em 5% dos doentes, e a que se associa uma mortalidade 4 vezes superior, pela sua potencial progressão para hipertensão portal, cirrose e insuficiência hepática.1 A hepatite auto-imune e a colangite esclerosante primária (CEP) são as manifestações mais frequentemente associadas a Colite Ulcerosa (CU), não estando no entanto a sua atividade correlacionada. 2
A Hepatite auto-imune é uma doença inflamatória hepática crónica caracterizada pela presença de auto-anticorpos circulantes, hipergamaglobulinemia e evidência histológica de hepatite de interface 3, 4 no entanto nenhuma destas características é patognomónica, pelo que o seu diagnóstico implica a exclusão de outras etiologias.
A CEP é uma patologia crónica e progressiva, sendo mais frequente em doentes com pancolite. Caracteriza-se por inflamação, fibrose e consequente estreitamento do calibre dos dutos médios e grandes na árvore biliar intra e/ou extra-hepática 5, 6, estando presentes em 80% dos doentes anticorpos anti-citoplasma do neutrófilo (ANCA). 7 O seu diagnóstico implica documentação imagiológica de estenoses e dilatações multifocais das vias biliares intra e/ou extra-hepáticas, por colangio-RMN (CRM) ou colangiopancreatografia retrógrada endoscópica, ambas com semelhante acuidade diagnóstica 2, sendo a última preferível quando a suspeita de colangiocarcinoma se coloca, uma vez que possibilita a realização de biópsia e intervenção terapêutica quando necessária. Histologicamente a CEP caracteriza-se pela obliteração fibrosa dos pequenos ductos por tecido conjuntivo disposto de forma concêntrica, apresentando padrão em “casca de cebola”, no entanto estes achados estão ausentes em mais de 2/3 dos casos pela sua distribuição heterogénea no fígado.2 Uma variante com melhor prognóstico – a CEP de pequenos ductos (CEPPD) – apresenta achados clínicos, laboratoriais e histológicos, compatíveis com CEP, mas com normal imagem da via biliar.6 Estudos de follow-up destes doentes demonstram que aproximadamente 25% evoluem para CEP de ductos maiores. 8
Segundo as guidelines europeias de Hepatite auto-imune, os scores de diagnóstico existentes atualmente (score do Grupo Internacional de Hepatite Auto-Imune (GIHAI) e score simplificado) devem apenas servir para ajudar no diagnóstico 4, no entanto todos os algoritmos diagnósticos enfatizam o componente inflamatório da HAI e a ausência de manifestações colestáticas proeminentes. 9 De facto a presença desta última obriga a uma caracterização e gestão individual, uma vez que apresentam resposta variável à terapêutica.
Em doentes com HAI, a elevação acentuada de FA ou GGT, a positividade de anticorpos anti-mitocondriais (AMA), a presença histológica de lesão ou perda de ductos biliares, a doença inflamatória concomitante ou a má resposta a corticoterapia devem levantar a suspeita de síndrome de overlap. 9 Os 3 tipos atualmente definidos associam a HAI a colangite biliar primária (CBP), CEP ou a síndrome colestática mal definida, esta última associada a CEPPD ou a CBP AMA negativa.
O Síndrome de overlap HAI/CEPPD baseia-se na combinação de características bioquímicas, serológicas e histológicas de HAI, associados a achados histológicos de CEP, na ausência de alterações colangiográficas. 10
Caso Clínico:
Doente do sexo masculino, 30 anos, sem antecedentes médicos de relevo ou medicação habitual. Apresentava consumo alcoólico esporádico (24g/semana). Negava consumo de drogas ilícitas ou fármacos recentemente. Epidemiologicamente, sem viagens recentes, mas com consumo de água de poço não analisada. Plano nacional de vacinação atualizado, incluindo vacinação anti-VHB e anti-VHA.
Foi observado no serviço de urgência (SU) em Fevereiro de 2014, por quadro de astenia, associado a perda ponderal (cerca de 6Kg em 1 mês), sem anorexia. Associadamente apresentava episódios recorrentes de hematoquézias, tenesmo e dor abdominal, com cerca de 1 mês de evolução. Referia ainda prurido nos membros inferiores, negava colúria ou acolia fecal.
Apesar de previamente assintomático, apresentava um ano antes, estudo analítico (realizado por rotina), com alteração das enzimas hepáticas (AST 60U/L e GGT 117U/L). Aconselhado a reduzir a ingestão alcoólica, não tendo sido realizado estudo complementar. No nosso SU apresentava-se corado, anictérico e sem sinais de encefalopatia. À palpação abdominal hepatomegalia indolor. Sem adenomegalias palpáveis. Sem outras alterações de relevo. Do estudo analítico hemograma sem alterações, mas citocolestase exuberante (Tabela 1). Estudo da coagulação normal e ausência de hipoalbuminemia. A ecografia abdominal apresentava heterogeneidade do parênquima hepático, compatível com hepatopatia crónica, assim como via biliar primária (VBP) de calibre normal, mas com ligeiro espessamento parietal e algumas áreas de discreta dilatação. Foi internado no Serviço de Medicina Interna para estudo de quadro de hepatite, com padrão colestático predominante.
Do estudo complementar salienta-se serologias víricas negativas (antigénio e anticorpo-HIV1 e 2, anticorpo-HCV, antigénio HBs e anticorpo-HBc negativos, anticorpo-HBs positivo); velocidade de sedimentação (VS) de 55mm/1ªh. Estudo da cinética do ferro, doseamento do cobre, de ceruloplasmina e de alfa 1 anti-tripsina normais. Do estudo imunológico a salientar ANCA PR3 e MPO positivos, assim como imunoglobulina G aumentada (IgG 1590 mg/dL). Anticorpos anti-mitocondriais, anti-Ds DNA, anticorpos anti-nucleraes (ANA), anti-microssomal de fígado e rim tipo 1 (anti-LKM1), anti-músculo liso, anticorpo anti-citosol hepático 1 (anti-LC1), anti-antigénio hepático solúvel /fígado-pâncreas (anti-SLA/LP) negativos. Pela história de hematoquézias realizou colonoscopia que revelou mucosa com microerosões dispersas (Fig. 1), com biópsias do cólon ascendente, transverso, descendente e reto, compatíveis com colite ativa, mais intensa no segmento ascendente. Pela conhecida associação de colite ulcerosa e CEP realizou colangio-ressonância, que revelou VBP regular e de normal calibre, não existindo sinais sugestivos de CEP. No entanto, dado o padrão de colestase tão marcado (Tabela 1) e podendo tratar-se de uma CEPPD, foi pedida biópsia hepática que mostrou fibrose portal moderada e formação de raras pontes porto-portais; nos espaços porta observa-se infiltrado inflamatório de densidade variável, de que participam linfócitos, alguns plasmócitos e
eosinófilos; na transição epitélio-mesenquimatosa observam-se lesões necro-inflamatórias multifocais (compatíveis com hepatite de interface ligeira) (Fig. 2), mas sem lesões fibro-obliterativas dos ductos biliares, o que no entanto, não exclui lesão de pequenos ductos.
Face ao diagnóstico confirmado de colite ulcerosa, associado a padrão colestático exuberante, tendo sido excluídas outras causas que o justifiquem, e ainda com estudo auto-imune compatível com CEPPD e biópsia hepática sugestiva de HAI, foi assumido síndrome de overlap HAI/CEPPD, já relatado em alguns doentes com doença inflamatória intestinal.
Iniciou corticoterapia (40mg/dia de prednisolona), associada a ácido ursodesoxicólico (AUDC) 500mg bid (13mg/kg/dia) e messalazina 1gr (granulado oral e supositório), com franca melhoria sintomática, e analiticamente com padrão de citocolestase em decrescendo, assim como diminuição da VS e da IgG1 (Tabela 2). Em ambulatório foi reduzida gradualmente a dose de prednisolona até 10mg/dia, mantendo AUDC na mesma dose, apresentando-se até à data assintomático e com melhoria analítica dos marcadores de citocolestase hepática. Mantem vigilância endoscópica e imagiológica hepática pelo risco acrescido de neoplasia do cólon e das vias biliares.
Discussão
A conhecida associação da doença inflamatória intestinal com doenças hepáticas imuno mediadas 6, muitas vezes assintomáticas mas com impacto prognóstico na sobrevida dos doentes, faz com que seja mandatória a sua pesquisa ativa, uma vez que, na maior parte dos casos, a suspeita advém de alterações laboratoriais. Apesar da biópsia hepática não ser essencial para o diagnóstico, ela pode ser útil em situações de suspeita de síndrome de overlap.11
O doente apresentado tinha colite ulcerosa e hepatite colestática exuberante. Foram excluídas inicialmente a obstrução mecânica e a etiologia vírica, e realizada CRMN pela suspeita de CEP. No entanto, uma vez que a CRMN não apresentava alterações compatíveis com este diagnóstico, e face à exuberante colestase, achamos ser mandatório realizar biópsia hepática para diagnóstico CEPPD.
Esta decisão diagnóstica foi ainda reforçada pela necessidade de exclusão de síndrome de overlap, uma vez que o doente apresentava características imunológicas (hipergamaglobulinemia e ANCA positivos) típicas da HAI. Nestes casos a biópsia hepática é essencial para melhor definição terapêutica, nomeadamente pela maior probabilidade de resposta a corticoterapia e/ou azatioprina. 6
Neste caso, a presença de hepatite de interface na biópsia hepática, em associação com a positividade dos ANCA e hipergamaglobulinemia, o padrão de colestase exuberante com CRMN normal e a associação com colite ulcerosa, levaram-nos a concluir tratar-se de um caso de síndrome de overlap HAI/CEPPD, apesar da ausência de alterações histológicas compatíveis com CEPPD, que se sabe no entanto poderem estar ausentes numa fase inicial da doença (o padrão histológico característico – casca de cebola – é apenas observado em 25% das biópsias hepáticas)11 ou não representado na amostra analisada.
A decisão de tratar ou não um doente com HAI baseia-se essencialmente nos sintomas, no valor de enzimas hepáticas e de gama globulina, na histologia e nos possíveis efeitos secundários dos fármacos. A abordagem terapêutica inicial diverge entre as várias sociedades – corticoterapia vs corticoterapia e azatioprima. 4, 12 Face a isso, apresentando o doente valores de transaminases superiores a 10 vezes os valores de referência, sintomas exuberantes de astenia e emagrecimento, e ainda fibrose portal moderada na histologia hepática, foi decidido iniciar curso de corticóide em monoterapia.
Quanto ao tratamento de CEP, atualmente não existe nenhum que comprovadamente altere o curso natural da doença. Existem vários estudos sobre o uso de AUDC, no entanto os seus resultados são contraditórios, sendo as guidelines mais recentemente publicadas omissas sobre a indicação para a sua utilização.13 Em alguns estudos o seu uso em doses elevadas (até 28mg/kg/dia) parece reduzir as alterações bioquímicas e a inflamação hepática, apesar de não ter demonstrado impacto na sobrevida ou redução da necessidade de transplante hepático.14, 15
O tratamento ideal do síndrome de overlap não foi comprovado em ensaios clínicos, sendo por isso empírico e individualizado, baseando-se no tratamento definido para a patologia predominante (inflamatória vs colestática), assim como na resposta à terapêutica inicial. Em doentes com apresentação inflamatória exuberante e colestática, como é o caso do nosso doente, o início de terapêutica dupla (corticoide e AUDC) e, eventualmente, a associação com azatioprina é uma alternativa 16, uma vez que o uso de corticoides isoladamente raramente cursa com uma resposta completa e a terapêutica com AUDC (13-15mg/kg/dia) isolada resulta numa melhoria parca.
Esta foi a terapêutica instituída neste caso, tendo o doente apresentado franca melhoria clínica e analítica, com redução franca do valor das enzimas hepáticas, da velocidade de sedimentação e da IgG1.
Conclusão
O caso apresentado demonstra-nos a complexidade dos doentes com doença inflamatória intestinal e doença hepática associada, havendo atualmente a dúvida de se tratar de diferentes espectros da mesma entidade. Remete-nos também para o desafio terapêutico, dada a pouca informação baseada na evidência existente, quer no tratamento, quer no seguimento destes doentes. A equipa multidisciplinar teve neste caso um papel fulcral para uma melhor abordagem do doente.
Agradecimentos
Um especial agradecimento à Dra. Joanne Lopes e à Dra. Laura Pontes Fajardo, do serviço de Anatomia Patológica do Hospital de São João, por gentilmente cederem as imagens da biópsia hepática.Quadro I
Evolução analítica.
| Abril/2013 | Janeiro/2014 | Fevereiro/2014 | Internamento | |
| AST U/L | - | 145 | 487 | 187 |
| ALT U/L | 60 | 351 | 763 | 384 |
| GGT U/L | 117 | 815 | 1134 | 809 |
| FA U/L | - | 1287 | 2164 | 1815 |
| VS mm/1ºh | 10 | - | 75 | - |
Evolução analítica dos marcadores de citocolestase.
Quadro II
Evolução analítica.
| Internamento | 18/3/2014 | 16/4/2014 | |
| AST U/L | 187 | 43 | 57 |
| ALT U/L | 384 | 98 | 92 |
| GGT U/L | 809 | 315 | 287 |
| FA U/L | 1815 | 355 | 210 |
| VS mm/1ªh | 55 | 38 | - |
| IgG1 (mg/dL) | 1590 | - | 1460 |
| Dose de Prednisolona | 40mg/dia | 20mg/dia |
Evolução analítica após início do tratamento.
Figura I
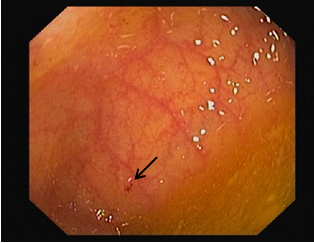
Figura 1: Microerosão no colon ascendente
Figura II
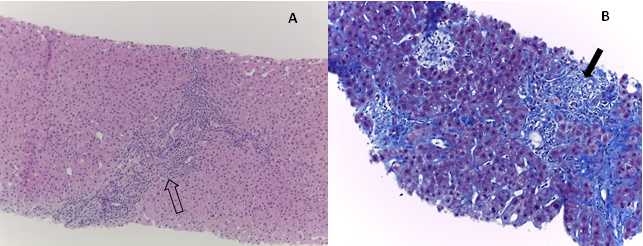
Figura 2: A- infiltrado inflamatório nos espaços porta (seta vazia); B - fibrose portal moderada (seta preenchida)
BIBLIOGRAFIA
1. Mendes FD, Levy C, Enders FB, Loftus EV, Angulo P, Lindor KD. Abnormal hepatic biochemistries in patients with inflammatory bowel disease. The American journal of gastroenterology. 2007 Feb;102(2):344-50. PubMed PMID: 17100965.
2. Restellini S, Chazouilleres O, Frossard JL. Hepatic manifestations of inflammatory bowel diseases. Liver international : official journal of the International Association for the Study of the Liver. 2017 Apr;37(4):475-89. PubMed PMID: 27712010.
3. Krawitt EL. Autoimmune hepatitis. The New England journal of medicine. 2006 Jan 05;354(1):54-66. PubMed PMID: 16394302.
4. European Association for the Study of the L. EASL Clinical Practice Guidelines: Autoimmune hepatitis. Journal of hepatology. 2015 Oct;63(4):971-1004. PubMed PMID: 26341719.
5. Angulo P, Lindor KD. Primary sclerosing cholangitis. Hepatology. 1999 Jul;30(1):325-32. PubMed PMID: 10385674.
6. Saich R, Chapman R. Primary sclerosing cholangitis, autoimmune hepatitis and overlap syndromes in inflammatory bowel disease. World journal of gastroenterology. 2008 Jan 21;14(3):331-7. PubMed PMID: 18200656. Pubmed Central PMCID: 2679122.
7. Lee YM, Kaplan MM. Primary sclerosing cholangitis. The New England journal of medicine. 1995 Apr 06;332(14):924-33. PubMed PMID: 7877651.
8. Singh S, Talwalkar JA. Primary sclerosing cholangitis: diagnosis, prognosis, and management. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2013 Aug;11(8):898-907. PubMed PMID: 23454027. Pubmed Central PMCID: 3692584.
9. Czaja AJ, Carpenter HA. Autoimmune Hepatitis Overlap Syndromes and Liver Pathology. Gastroenterology clinics of North America. 2017 Jun;46(2):345-64. PubMed PMID: 28506369.
10. Rust C, Beuers U. Overlap syndromes among autoimmune liver diseases. World journal of gastroenterology. 2008 Jun 07;14(21):3368-73. PubMed PMID: 18528934. Pubmed Central PMCID: 2716591.
11. Bjornsson E, Talwalkar J, Treeprasertsuk S, Neuhauser M, Lindor K. Patients with typical laboratory features of autoimmune hepatitis rarely need a liver biopsy for diagnosis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association. 2011 Jan;9(1):57-63. PubMed PMID: 20723617.
12. Manns MP, Czaja AJ, Gorham JD, Krawitt EL, Mieli-Vergani G, Vergani D, et al. Diagnosis and management of autoimmune hepatitis. Hepatology. 2010 Jun;51(6):2193-213. PubMed PMID: 20513004.
13. Lindor KD, Kowdley KV, Harrison ME, American College of G. ACG Clinical Guideline: Primary Sclerosing Cholangitis. The American journal of gastroenterology. 2015 May;110(5):646-59; quiz 60. PubMed PMID: 25869391.
14. Charatcharoenwitthaya P, Angulo P, Enders FB, Lindor KD. Impact of inflammatory bowel disease and ursodeoxycholic acid therapy on small-duct primary sclerosing cholangitis. Hepatology. 2008 Jan;47(1):133-42. PubMed PMID: 17992695.
15. Williamson KD, Chapman RW. Primary sclerosing cholangitis: a clinical update. British medical bulletin. 2015 Jun;114(1):53-64. PubMed PMID: 25981516.
16. Boberg KM, Chapman RW, Hirschfield GM, Lohse AW, Manns MP, Schrumpf E, et al. Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. Journal of hepatology. 2011 Feb;54(2):374-85. PubMed PMID: 21067838.

