Introdução: A miastenia gravis (MG) é uma doença neurológica autoimune, provocada por anticorpos anti receptores da acetilcolina (anti-AchR) localizados na membrana pós-sináptica da placa neuromuscular 1,2. A MG adquirida é uma doença rara, com uma incidência anual de 8 a 10 casos por milhão e uma prevalência de 150 a 250 casos por milhão3. Pode ocorrer em qualquer idade mas apresenta uma distribuição bimodal, com um pico de incidência precoce, mais frequente nas mulheres, entre a 2ª-3ª década de vida e um pico tardio, sobretudo nos homens, na 6ª-8ª década de vida 2. A MG é caracterizada por fadiga muscular flutuante, com agravamento ao longo do dia ou após o exercício físico4. Cerca de 50% dos doentes, têm como forma de apresentação, diplopia e/ou ptose palpebral, 15% sintomas bulbares (disartria, disfagia e dificuldade na mastigação) e menos de 5% têm exclusivamente fadiga muscular proximal, sendo rara a fadiga muscular distal 4. Embora seja uma entidade rara, pode ainda ocorrer disfunção autonómica nestes doentes, sob a forma de dismotilidade intestinal , justificada pela presença de receptores nicotínicos da acetilcolina no sistema nervoso entérico 5. O timo tem um papel fundamental na etiopatogenia da MG visto estar alterado em cerca de 75% dos doentes com MG e anticorpos anti-AchR. Cerca de 65% dos doentes têm hiperplasia folicular e 10% apresentam timoma 1,12,13.
Caso clínico: Mulher de 49 anos, sem antecedentes pessoais relevantes, recorre ao serviço de urgência por sensação de enfartamento, pirose e vómitos pós prandiais associado a alteração do trânsito intestinal, sem dejecções há três semanas mas com trânsito mantido para gases. Refere ainda perda ponderal de 10Kg no último mês, cansaço de agravamento progressivo e diplopia com agravamento ao longo do dia. Ao exame objectivo apresenta palidez cutânea, ptose palpebral bilateral, mais evidente no olho direito com limitação da adução do olho esquerdo, diplopia em todos os movimentos oculares e fatigabilidade nas provas de força muscular. Analiticamente sem alterações relevantes. Desta forma, foi internada para estudo etiológico.
No internamento manteve a mesma sintomatologia. Realizou exames complementares de diagnóstico, nomeadamente endoscopia digestiva alta que mostrou estase gástrica e tomografia computorizada tóraco-abdomino-pélvica que revelou lesão ocupando espaço de natureza sólida, lobulada, heterogeneamente captante de contraste, ocupando a gordura mediastínica anterior nos seus dois andares superiores (Fig. 1) e distensão cólica e abundante carga fecal. Por suspeita de miastenia gravis foi realizado estudo analítico (Tab. 1), destacando-se elevação dos anticorpos anti-receptores da acetilcolina e positividade do anticorpo anti-CV2.
Como medida terapêutica iniciou piridostigmina 60mg tid com melhoria progressiva da sintomatologia, nomeadamente regularização do trânsito intestinal e melhoria da ptose palpebral e diplopia.
Realizou estudo por estimulação repetitiva, com todos os parâmetros dentro da normalidade, no entanto a doente não suspendeu a piridostigmina, podendo tratar-se de um falso negativo.Para melhor caracterização da lesão no mediastino anterior, exclusão de invasão do pericárdio e de estruturas vasculares adjacentes realizou ressonância magnética torácica que excluiu estas hipóteses (Fig. 2 e 3).
Realizou timectomia sem intercorrências. O resultado anatopatológico mostra timoma tipo B3, no estadio pT2 N0 M1a, Masaoka Iva, por invasão do pericárdio. Células neoplásicas positivas para CkAE1/AE3, CD3 e CD5, e negativas para CD20 e CD117. Iniciou radioterapia adjuvante.
Um mês após cirurgia com melhoria da ptose palpebral e diplopia com provas de fatigabilidade muscular negativas.
Discussão:
O diagnóstico de MG faz-se pela presença de anticorpos anti-AchR, que estão presentes em aproximadamente 85% dos doentes com MG generalizada e exames electrodiagnósticos, nomeadamente estudo por estimulação repetitiva, tratando-se de um dos exames com mais sensibilidade para detecção de alterações na junção neuromuscular 14.
Sabe-se que os anticorpos anti-AchR levam à diminuição do número de receptores na placa neuromuscular, tanto pela sua ligação, como pelo aumento da degradação dos AchR e por lesão directa da membrana pós-sináptica provocada pela activação do complemento 1. Apesar deste mecanismo, a concentração dos anticorpos anti-AchR não se correlaciona com a gravidade da doença 6, no entanto, o mesmo não acontece com a consequente redução do número de receptores 1.
Os AchR são de dois tipos, os muscarínicos (mAchR) e os nicotínicos (nAchR). Os nAchR neuronais estão presentes no sistema nervoso simpático e parassimpático bem como no sistema nervoso entérico. Estes anticorpos são responsáveis por alterações na transmissão colinérgica, conduzindo a disfunção autonómica 7,8, que se manifestou, nesta doente, sob a forma de pseudo-obstrução intestinal. Quando existe, concomitantemente, evidência de timoma, a pseudo-obstrução intestinal é definida como manifestação paraneoplásica 9.
O timo tem um papel fundamental na etiopatogenia da MG visto estar alterado em cerca de 75% dos doentes com anticorpos anti-AchR. Cerca de 65% destes doentes têm hiperplasia folicular e 10% têm timoma 1,12,13. É no timo onde ocorre o reconhecimento dos antigénios, que são apresentados aos linfócitos T, que posteriormente estimulam os linfócitos B na produção de anticorpos13. Por este motivo, a timectomia tem um papel fundamental no tratamento destes doentes, geralmente com melhoria significativa da sintomatologia.
Neste caso, foi ainda identificado o anticorpo onconeural anti-CV2, que está associado a disfunção autonómica, sobretudo quadros de dismotilidade intestinal, com pseudo-obstrução em cerca de 31% dos doentes. Este anticorpo já foi identificado em doentes com timoma, sobretudo em jovens e que desenvolvem MG10,15.
Existem várias opções terapêuticas na MG, sendo o tratamento de primeira linha a piridostigmina, um antagonista da acetilcolinesterase, que atrasa a degradação da acetilcolina na junção neuromuscular. Em algumas situações este fármaco não é eficaz, existindo opções terapêuticas como os corticóides ou outras terapêuticas imunosupressoras, plasmaferese, imunoglobulina e a timectomia 11. Neste caso, por apresentar invasão do pericárdio, tem indicação para radioterapia adjuvante para evitar recidiva local.
Figura I
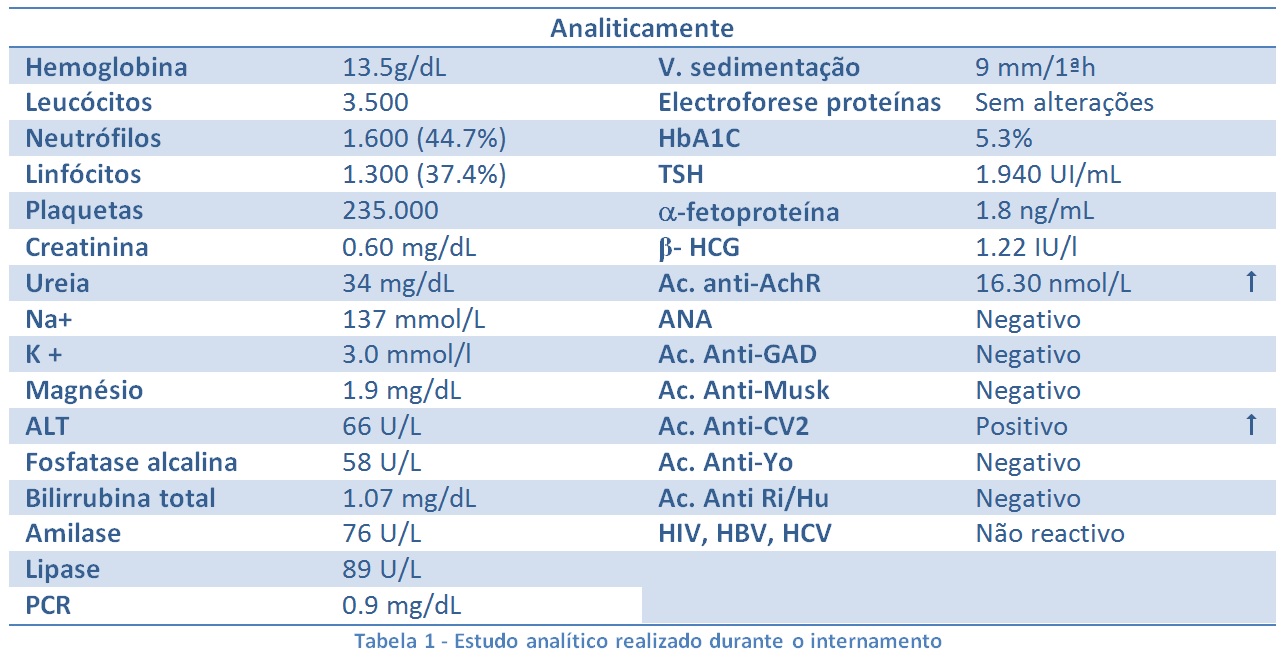
Tabela 1 - Estudo analítico realizado durante o internamento
Figura I
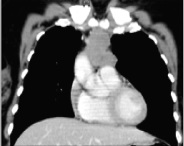
Lesão ocupando espaço no mediastino anterior
Figura II
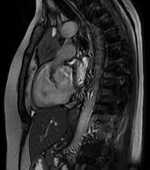
Lesão ocupando espaço aderente ao pericárdio
Figura III
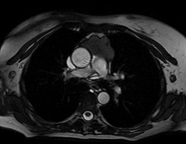
Lesão ocupando espaço com moldagem do tronco pulmonar
BIBLIOGRAFIA
1. Relvas, Rute; Gonçalves, Manuel; Viana, J.Pinto; Miastenia e síndromes miasténicos; Medicina interna; Vol.6; N.2, 1999.
2. Gwathmey, Kelly G.; Burns, Ted M; Myastenia gravis; Semin Neurol 2015; 35:327-339
3. Carr AS, Cardwell CR, Mc Carron PO, Mc Conville J. A systematic review of population based epidemiological studies in myasthenia gravis. BMC Neurol. 2010; 10:46
4. Shawn J Bird; Clinical manifestations of myasthenia gravis, uptodate, Jul 2017.
5. Rakocevic, Goran; Barohn, Richard; Mc Vey, April L.; et all; Myastenia Gravis, Tymoma and intestinal pseudo-obstruction; Journal of clinical neuromuscular disease, Volume 5; Number 2; December 2003.
6. Bird, Swawn; Pathogenesis of myastenia gravis; uptodate, Jul 2017.
7. Kashyap, Purna; Farrugia Gianrico; Enteric autoantibodies and gut motility disorders; Gastroenterol Clin North Am. 2008 June; 37 (2): 397-410
8. Anderson, N.E.; Hutchinson, D.O.; Nicholson, G.I; et all; Intestinal pseudo-obstruction, myastenia gravis and thymoma; Neurology 1996; 47:985-987
9. Shawn J Bird; Diagnosis of myasthenia gravis, uptodate, Jul 2017.
10. Honnorat, J; Cartalat-Carel, S; D Ricard; Camdessanche, J; Carpentier, A F; et all; Onco-neural antibodies and tumour type determine survival and neurological symptoms in paraneoplastic neurological syndromes with Hu or CV2/CRMP5 antibodies; J Neurol Neurosurg Psychiatry 2009 80: 412-416; October 17, 2008.
11. Shawn J Bird; Treatment of myasthenia gravis, Uptodate, Jul 2017.
12. Nils E. Gilhus; Myastenia Gravis; N England J Med 2016; 375;26.
13. Benjamin W. Hughes; Maria Luisa Moro De Casillas; Henry J. Kaminski; Pathophysiology of Myasthenia Gravis; Seminars in neurology, volume 24,number 1, 2004, 21-30.
14. Keijzers, Marlies; Nogales-Gadea, Gisela; Baets, Marc de; Clinical and scientific aspects of acetylcholine receptor myasthenia gravis; Current Opinion in Neurology, Vol 27, Number 5, October 2014
15. Honnorat, Jérôme; Antoine, Jean-Christophe; Paraneoplastic neurological syndromes; Orphanet Journal of Rare Diseases 2007, 2:22





