Introdução:
Os tumores do estroma gastrointestinal (GIST) têm origem nas células de Cajal, localizadas no mesênquima gastrointestinal. Imunohistoquimicamente são positivos para o marcador transmembranar da tirosina cinase c-KIT (CD117), o que os distingue dos restantes tumores mesenquimatosos1. Surgem habitualmente na 5ª década de vida, com igual incidência em ambos os géneros2, e correspondem à maioria dos tumores mesenquimatosos. Localizam-se com maior frequência no estômago (60-70%), intestino delgado (25-30%), esófago (<3%)2,3 sendo a localização extra-gastrointestinal rara (menos de 5%) 1. Estes tumores são designados por tumores do estroma gastrointestinal extra-intestinal (EGIST), surgindo principalmente no mesentério, retroperitoneu, bexiga, fígado e útero 1,2. A sua verdadeira incidência é desconhecida, tendo-se verificado um aumento de registos na literatura ao longo dos anos4. Alguns estudos referem que a incidência dos GIST se encontra entre 4 e 14,5 casos por milhão2,3 mas Joensuu H. estima que esta incidência seja cerca de dez vezes maior2 e Nagai T, Ueda K, Hakoda H, et al admitem que muitos GIST são tumores pequenos e assintomáticos, e por isso não diagnosticados3.
Com o presente caso os autores pretendem mostrar um EGIST com origem primária no fígado e metastização pulmonar.
Caso Clínico:
Doente do género masculino, 63 anos, que iniciou em agosto de 2007 dor no hipocôndrio direito e região periumbical. A ecografia abdominal mostrou um nódulo de 11,5 cm de maior diâmetro no lobo esquerdo do fígado, sólido, heterogéneo, condicionando distorção vascular, motivo pelo qual foi referenciado para consulta de Medicina Interna. Sem antecedentes de relevo ou medicação crónica. No exame clínico apresentava distensão abdominal e massa epigástrica palpável. A avaliação analítica mostrava LDH de 568 U/L (N: 240-480), sem outras alterações. A alfa-fetoproteína era normal. Os testes sorológicos para hepatite B, C e VIH foram negativos. Realizou tomografia computorizada (TC) abdominal com contraste que mostrou lesão hepática no lobo esquerdo com 11 cm de maior diâmetro, limites irregulares e estrutura heterogénea, com efeito de realce precoce irregular e sem realce tardio (figura I). Foi realizada biópsia eco-guiada, que histologicamente mostrou área de neoplasia com células fusocelulares e epitelióides, estroma de aspecto mixóide, com 3 mitoses/5 campos de grande aumento (CGS). Imunohistoquimicamente, negativo para marcadores CD117, queratina MNF116, CD34, desmina, actina de células lisas e proteina S100 concluindo poder tratar-se de um sarcoma hepático.
Realizou estadiamento com TC toraco-abdomino-pélvica e tomografia de emissão de positrões (PET) que não mostraram lesões secundárias. A PET mostrou lesão hepática com elevada captação de 18-fluorodeoxiglucose-fluroine (FDG-18) na região periférica e necrose central. Realizou ainda eco-endoscopia que mostrou mucosa gástrica espessada mas sem distorção, ligeiro eritema da mucosa, pouca distensibilidade do antro e corpo gástrico, provocada por massa hepática adjacente à parede gástrica. Foram efetuadas biópsias gástricas, sem alterações.
Tratando-se de um tumor ressecável (T4, Nx, M0), foi efetuada hepatectomia esquerda com linfadenectomia do hilo hepático. O resultado anatomopatológico da peça operatória revelou margens de 9 mm (figura II), positividade para CD117 e vimenta, sendo negativo para CD34, proteína 100, desmina e actina de músculo liso, e histologicamente compatível com GIST. A análise do risco, mostrou um GIST de alto risco por apresentar diâmetro superior a 10 cm, índice mitótico 5/10CGA, permeação neural e angioinvasão.
O doente foi mantido sob vigilância clínica e imagiológica. Dois anos após a cirurgia realizou TC toraco-abdomino-pélvica que mostrou massa pulmonar única no lobo inferior do pulmão esquerdo de 1,7cm e PET que mostrou lesão no lobo inferior do pulmão esquerdo com captação de FDG-18 (figura III). Analiticamente o antigénio carcino-embrionário, antigénio do carcinoma de células escamosas, enolase neurónio específica e fragmento da citoqueratina 19 CYFRA negativos. O caso foi discutido com a equipa de cirurgia torácica e, pelas pequenas dimensões desta lesão, manteve-se vigilância. Passados quatro anos verificou-se aumento das dimensões da lesão pulmonar (5,1cm de maior diâmetro - figura IV). Foi realizada biópsia transtorácica que revelou células com fenótipo epitelióide e plasmocitóide com núcleos de pleomorfismo moderado e figuras mitóticas ocasionais. Imunohistoquimicamente o tumor foi positivo para CD117 e vimentina e negativo para proteína S100 e CD34, o que era compatível com localização secundária de GIST. Foi iniciada terapêutica com imatinib 400mg uma vez por dia, tendo o doente sido submetido a toracotomia com excisão de lesão pulmonar. O estudo anatomopatológico da peça operatória revelou padrão fusocelular, matriz hialina e positividade para CD117 e vimentina. Dois anos mais tarde surgiu nova lesão pulmonar na mesma localização, de 2,1 cm, que foi biopsada revelando positividade para DOG-1 e negatividade para CD117, compatível com metastização de EGIST. O doente foi de novo submetido a toracotomia tendo o estudo histológico revelado tumor de células fusiformes com positividade para CD117, vimentina e DOG-1. A lesão mostrou margens de 7 mm.
Atualmente o doente encontra-se assintomático, não apresentou recidiva local (hepática ou pulmonar) nem novas metástases, tendo completado três anos de terapêutica com imatinib.
Discussão
A etiologia dos tumores hepáticos inclui lesões benignas (as mais frequentes hemangiomas, hiperplasia nodular focal, adenomas e nódulos regenerativos) e malignas (hepatocarcinoma, colangiocarcinoma ou metástases). O diagnóstico é, na maioria dos casos, sugerido pelas características imagiológicas e doenças concomitantes do doente. No entanto, as características histológicas são necessárias para o diagnóstico. Neste caso, o tumor hepático de grandes dimensões fazia suspeitar de hemangioma hepático gigante. Após discussão com imagiologista, optou-se pela realização de biópsia dada a presença de distorção vascular na ecografia e efeito de realce precoce sem realce tardio na TC com contraste, características não compatíveis com hemangioma.
As características imunohistoquímicas da biópsia foram sugestivas de sarcoma hepático indiferenciado 2. Os sarcomas hepáticos primários são raros. Destes, o angiossarcoma e leiomiossarcoma são os tipos histológicos mais frequentes, mas existem outros como hemangioepitelioma endotelial, GIST, lipossarcoma e sarcoma indiferenciado 5. A ausência de positividade para todos os marcadores imunohistoquímicos pesquisados não permitiu uma conclusão diagnóstica. A ressecabilidade da lesão levou à realização de hepatectomia que revelou o diagnóstico de EGIST hepático dada a positividade para CD117 e vimentina e negatividade para actina de músculo liso 2. O estudo genético foi positivo para CD117, habitualmente associado aos tumores do estroma gastrointestinais 3, mas negativo para a mutação PDGFRa.
O tumor foi classificado histologicamente como de alto risco o que, associado ao facto de ter sido realizada biópsia (que confere risco de rutura tumoral), indicava a forte probabilidade de recorrência e metastização 1,3,6. Apesar de se tratar de um EGIST de alto risco, à data não existia evidência que suportasse uso de terapêutica adjuvante em EGIST dado que a classificação era baseada em GIST´s do trato gastrointestinal 3. A localização extra-gastrointestinal como critério de alto risco com indicação para tratamento adjuvante surgiu apenas em 2008, um ano após o diagnóstico deste caso 6.
Com o aparecimento da lesão pulmonar metabolicamente ativa em PET, foram colocadas as hipóteses de tumor primário do pulmão, ou metástases, nomeadamente de EGIST. Os marcadores tumorais frequentemente associados a neoplasia primária do pulmão foram negativos. Assumindo-se como mais provável a metástase de EGIST e dados os antecedentes do doente, manteve-se vigilância até aumento da lesão, altura em que se realizou biópsia transtorácica que revelou positividade para DOG-1 e portanto compatível com EGIST metastático 7. A terapêutica com inibidor da tirosina cinase é preconizada para GIST e EGIST com metastização 3,8,9 pelo que o doente iniciou terapêutica com imatinib. Sob esta terapêutica, e provavelmente devido às pequenas margens de resseção cirúrgica, ocorreu recidiva local que levou a nova intervenção. Na segunda toracotomia a peça revelou margens seguras e o tumor não voltou a recidivar, tendo o doente terminado atualmente 3 anos de terapêutica.
Neste caso, a dimensão inicial da lesão (superior a 10 cm), associada à realização de biópsia tumoral constituíram fatores de mau prognóstico, o que se veio a verificar com o aparecimento da metastização pulmonar. Após a excisão da lesão secundária com margens cirúrgicas seguras e a manutenção da terapêutica com imatinib o doente apresentou boa evolução, o que, tal como referencia a literatura, é a favor de uma boa resposta do GIST ao inibidor com tirosina cinase 8.
Com este caso os autores pretendem mostrar que, apesar de raros, existe a possibilidade de aparecimento de GIST´s em locais extra-gastrointestinais, como tumores primários. Pretendem também descrever o segundo caso de metastização pulmonar de GIST hepático e afirmar a importância do seu diagnóstico precoce, tratamento adequado, seguimento regular e avaliação de qualquer lesão adicional. Da revisão da literatura, apenas estão publicados 23 casos de EGIST hepático , estando descrita metastização pulmonar em apenas um caso 10. Realçam ainda que, após 120 meses de seguimento, o doente se encontra sem progressão da doença, evolução essa largamente superior aos restantes GIST´s hepáticos descritos na literatura, em que a melhor evolução referenciada é de 66 meses 4,11. Apesar de se tratar de um tumor de alto risco, o facto de apresentar marcador CD117 poderá ter contribuído para a boa resposta ao tratamento instituído. Tratando-se de uma doença potencialmente curável, o correto diagnóstico de todas as lesões e instituição de terapêutica dirigida assumem uma importância fundamental.
Figura I
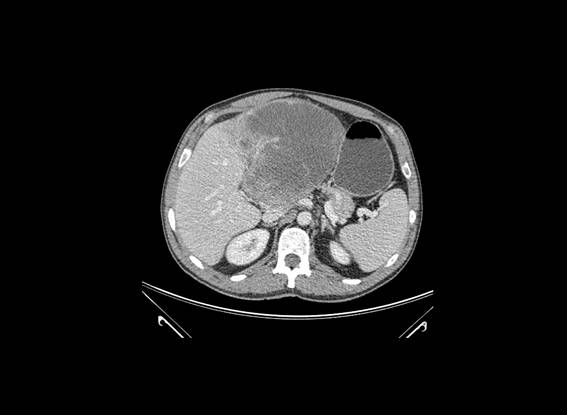
TAC abdominal a mostrar lesão volumosa no lobo esquerdo do fígado
Figura II
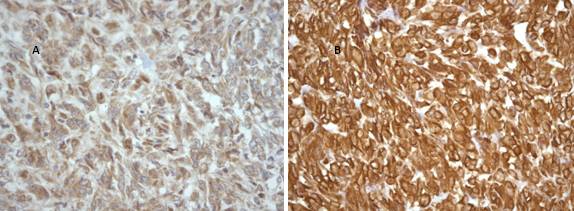
Histologia hepática. A: reação positiva para CD117 (amplificação original, x400). B: reação positiva para vimentina (amplificação original, x400).
Figura III
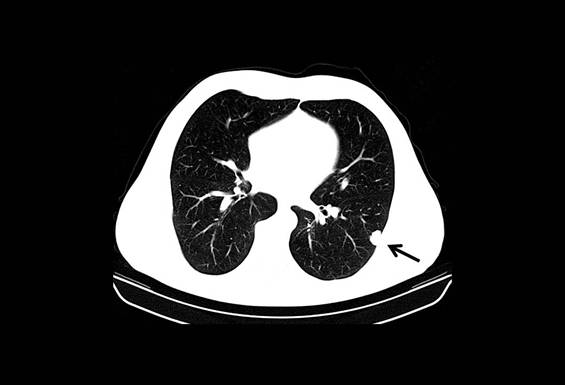
TAC torácica a mostrar massa de 1,7 cm no lobo inferior do pulmão esquerdo (seta).
Figura IV
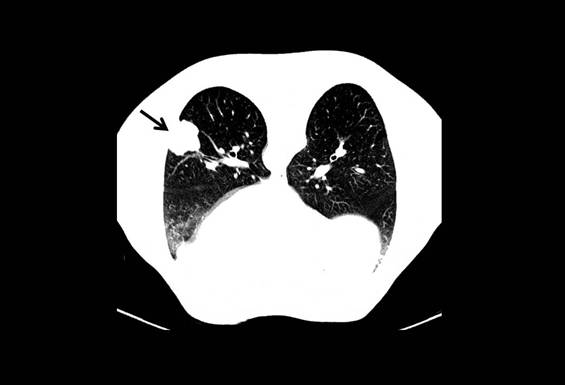
TAC torácica a mostrar massa de 5,1 cm no lobo inferior esquerdo do pulmão (seta), doente em decúbito ventral para realização de biópsia guiada por TAC.
BIBLIOGRAFIA
1. Luo XL, Liu D, Yang JJ, Zheng MW, Zhang J, Zhou XD. Primary gastrointestinal stromal tumor of the liver: a case report. World J Gastroenterol. 2009;15(29):3704-3707.
2. Miettinen M, Lasota J. Gastrointestinal stromal tumors (GISTs): definition, occurrence, pathology, differential diagnosis and molecular genetics. Pol J Pathol. 2003;54(1):3-24.
3. Joensuu H. Gastrointestinal stromal tumor (GIST). Ann Oncol. 2006;17 Suppl 10:x280-286.
4. Nagai T, Ueda K, Hakoda H, et al. Primary gastrointestinal stromal tumor of the liver: a case report and review of the literature. Surg Case Rep. 2016;2(1):87.
5. Putra J, Ornvold K. Undifferentiated embryonal sarcoma of the liver: a concise review. Arch Pathol Lab Med. 2015;139(2):269-273.
6. Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39(10):1411-1419.
7. Hwang DG, Qian X, Hornick JL. DOG1 antibody is a highly sensitive and specific marker for gastrointestinal stromal tumors in cytology cell blocks. Am J Clin Pathol. 2011;135(3):448-453.
8. Demetri GD, von Mehren M, Antonescu CR, et al. NCCN Task Force report: update on the management of patients with gastrointestinal stromal tumors. J Natl Compr Canc Netw. 2010;8 Suppl 2:S1-41; quiz S42-44.
9. Group EESNW. Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014;25 Suppl 3:iii21-26.
10. Liu Z, Tian Y, Liu S, et al. Clinicopathological feature and prognosis of primary hepatic gastrointestinal stromal tumor. Cancer Med. 2016;5(9):2268-2275.
11. Cheng X, Chen D, Chen W, Sheng Q. Primary gastrointestinal stromal tumor of the liver: A case report and review of the literature. Oncol Lett. 2016;12(4):2772-2776.





