Introdução
A ascite quilosa, caracterizada pela presença de linfa na cavidade peritoneal, é uma manifestação rara, com uma incidência descrita de 1 por 20000 admissões hospitalares1-3. Foi identificada e descrita pela primeira vez em 1691 por Morton após paracentese a uma criança com tuberculose1. Tem um amplo diagnóstico diferencial dominado, nos adultos, pelas neoplasias abdominais, cirrose hepática, infeções e após intervenção cirúrgica, e nas crianças pelas anormalidades linfáticas congénitas e trauma3. A presença de um elevado teor de nutrientes e imunogobulinas pode levar à desidratação, desnutrição, alterações electrolíticas e imunossupressão, sendo importante o seu diagnóstico e abordagem céleres3.
Caso Clínico
Homem de 76 anos, caucasiano, agricultor reformado. Recorreu ao serviço de urgência por obstipação e náuseas, associados a perda ponderal recente, não quantificada.
Tinha diagnóstico prévio de doença hepática crónica (DHC) associada a consumos etanólicos de 100 g/dia, suspensos há 4 anos. No último ano apresentava idas recorrentes ao serviço de urgência por ascite refratária com necessidade de paracenteses evacuadoras, ultimamente a cada três semanas. Sem episódios de peritonite bacteriana espontânea documentados.
Tinha ainda história de fibrilhação auricular permanente, hipertensão arterial essencial e hipertrofia benigna da próstata. Medicado com furosemida, espironolactona, metolazona, nebivolol, mononitrato de isossorbido, esomeprazol e hidroxizina. Sem alergias conhecidas ou dados epidemiológicos relevantes.
Na admissão estava vigil, sem sinais de encefalopatia, eupneico em ar ambiente, com tons cardíacos abafados e fervores crepitantes na base direita. Abdómen com semiologia de ascite volumosa sem tensão, com circulação venosa colateral, sem refluxo hepatojugular. Edema pré-tibial e maleolar. Destacavam-se ainda telangiectasias malares, eritema palmar, rarefação pilosa, atrofia muscular generalizada, perfil tensional normotensivo com pulso paradoxal, bem como a presença de distensão venosa jugular e sinal de Kussmaul positivo.
Laboratorialmente destacava-se anemia normocítica normocrómica (13.3g/dL – ref 13.5-17.5g/dL), elevação de velocidade de sedimentação (73mm/h – ref <30mm/h) e proteína-C-reativa (2.28mg/dL – ref <0.5mg/dL), hiponatrémia (110 mmol/L – ref 135-145mmol/L), hipoalbuminémia (2.2g/dL – 3,5-5,2g/dL), elevação de fosfatase alcalina (193U/L – ref 40-130U/L), gama-glutamiltransferase (191U/L – ref 15-85U/L) com bilirrubina total, transaminases, contagem plaquetária, tempos de coagulação e função renal normais.
Foi realizada paracentese diagnóstica que revelou um líquido ascítico leitoso (Fig. 1) compatível com ascite quilosa – (triglicéridos 669mg/dL), com gradiente de albumina sero-ascítico 0,9, leucócitos 190leuc/uL com predomínio de mononucleares (76%) com exames citológico, bacteriológico e micobacteriológico sem alterações.
Prosseguiu-se o estudo através de tomografia computadorizada que identificou uma ascite volumosa, fígado com contornos regulares e parênquima homogéneo, bem como extensa calcificação grosseira do pericárdio, compatível com exuberante processo de pericardite constritiva e derrame pleural bilateral (Fig. 2). A toracocentese revelou um líquido citrino, com características de transudado, negativo ao exame direto e micobacteriológico, com adenosina deaminase (ADA) e imunofenotipagem dentro da normalidade. As serologias para VIH, Hepatite B e C, a autoimunidade, cobre, ceruloplasmina, alfa-1-antitripsina, ADA sérica, eletroforese de proteínas, imunofixação e imunofenotipagem do sangue periférico não revelaram alterações. O teste tuberculínico foi anérgico.
O eletrocardiograma apresentava um ritmo de fibrilhação auricular com resposta ventricular controlada, com má progressão de onda R nas derivações anteriores.
O ecocardiograma transtorácico revelou boa função sistólica, ressalto septal, variação respiratória da onda E mitral e dilatação da veia cava inferior sem colapso inspiratório. O diagnóstico de pericardite constritiva foi confirmado após realização de cateterismo cardíaco que revelou equalização das pressões diastólicas.
Foi submetido a pericardiectomia cerca (Fig. 3). O exame anatomo-patológico revelou um pericárdio com fibrose e extensas áreas de calcificação, sem infiltrado inflamatório, granulomas, tecido neoplásico ou outras alterações de significado patológico. A evolução clínica foi favorável, com recuperação completa da autonomia nas atividades de vida diária, sem limitação funcional, recorrência da ascite ou sinais de insuficiência cardíaca.
Discussão
A ascite quilosa caracteriza-se macroscopicamente pelo aspeto leitoso do líquido ascítico, com concentração de triglicéridos acima de 110 mg/dL1. A sua fisiopatologia assenta sobretudo na disrupção do sistema linfático, com exsudação de linfa pelos linfáticos retroperitoneais ou intestinais1-3. A sua etiologia é diversa, classificando-se em traumática, quando relacionada com intervenções cirúrgicas ou traumatismos abdominais, e não traumática, por exemplo associada a neoplasias ou infeções1-3.
A associação entre pericardite constritiva e ascite quilosa é rara, com escassas dezenas de casos descritos na literatura4-13. O diagnóstico ocorre tardiamente após uma evolução de meses a anos de doença. A evolução é favorável após cirurgia, à semelhança do caso descrito.
Na pericardite constritiva, o pericárdio está espessado, fibrótico, menos distensível, traduzindo geralmente um processo inflamatório/imunológico crónico subjacente. Desta forma, surge uma restrição ao fluxo de sangue ao coração com compromisso do enchimento de todas as câmaras cardíacas14.
A ascite quilosa na pericardite constritiva pode decorrer dos seguintes mecanismos:
a) aumento da pressão venosa central, com elevação da filtração capilar e consequentemente aumento da produção de linfa3,7,8.
b) diminuição da drenagem linfática pelas pressões elevadas ao nível da veia subclávia, que associada ao aumento da produção de linfa leva à formação de colaterais linfáticos que não suportam o fluxo elevado, originando a transudação peritoneal daquele fluído,8.
No presente caso, não foi possível determinar a causa da pericardite constritiva, situação que ocorre em 42% dos casos15. Presume-se que em muitos doentes decorra de uma pericardite idiopática ou viral, paussintomática. A tuberculose é uma causa potencial, sobretudo nos países com elevada prevalência desta patologia, como Portugal.
Conclusão
A pericardite constritiva é uma causa rara de ascite quilosa, de diagnóstico difícil e demorado, sendo fundamental a suspeita clínica pelo potencial curativo do tratamento cirúrgico, com impacto na sobrevida e qualidade de vida dos doentes.
Figura I
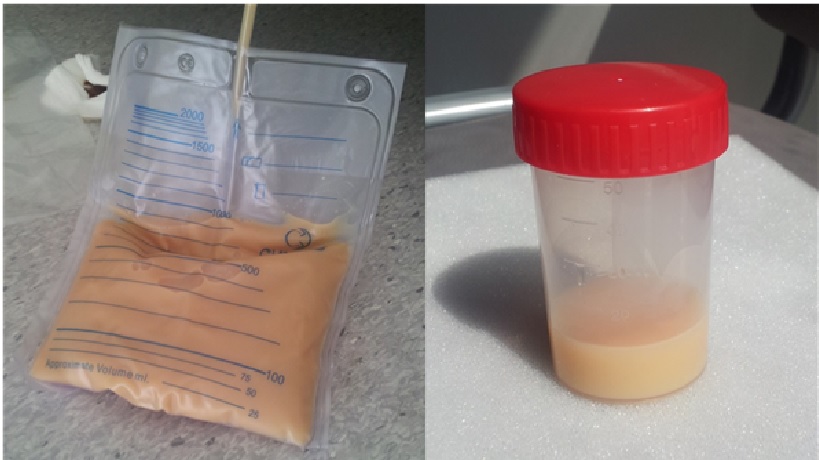
Líquido ascítico, compatível com ascite quilosa.
Figura II
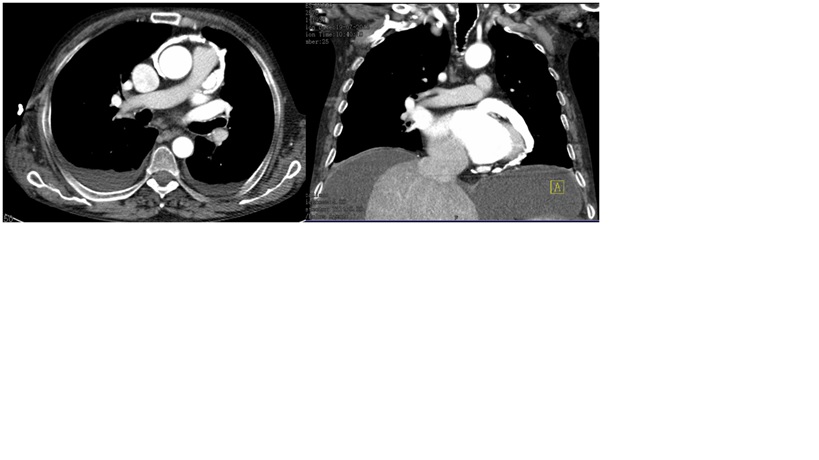
Tomografia computadorizada com extensa calcificação pericárdica.
Figura III
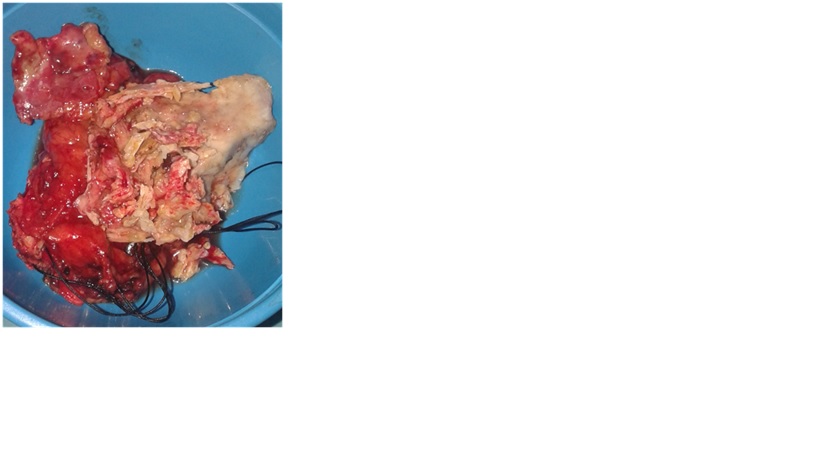
Pericárdio calcificado excisado em pericardiectomia
BIBLIOGRAFIA
1. Cárdenas A, Chopra S. Chylous ascites. Am J Gastroenterol. 2002;97(8):1896-900.
2. Al-Busafi SA, Ghali P, Deschênes M, Wong P. Chylous Ascites: Evaluation and Management. ISRN Hepatol. 2014;2014:240473.
3. Lizaola B, Bonder A, Trivedi HD, Tapper EB, Cardenas A. Review article: the diagnostic approach and current management of chylous ascites. Aliment Pharmacol Ther. 2017;46(9):816-824.
4 Marshall JB, Pola L. Chylous ascites secondary to constrictive pericarditis. A discussion of pathophysiologic mechanisms. Dig Dis Sci. 1982;27(1):84-7.
5. Savage MP, Munoz SJ, Herman WM, Kusiak VM. Chylous ascites caused by constrictive pericarditis. Am J Gastroenterol. 1987;82(10):1088-90.
6. Williams AT, Schneider RP. Chylous ascites should suggest constrictive pericarditis even in a patient with cirrhosis. J Clin Gastroenterol. 1990;12(5):581-4.
7. Güneri S, Nazli C, Kinay O, Kirimli O, Mermut C, Hazan E. Chylous ascites due to constrictive pericarditis. Int J Card Imaging. 2000;16(1):49-54.
8. England RW, Grathwohl KW, Powell GE. Constrictive pericarditis presenting as chylous ascites. J Clin Gastroenterol. 2002;35(1):104-5.
9. Motta G, Vianello F, Pietrogrande F. Chylothorax as the first manifestation of constrictive pericarditis. Am J Med. 2003;114(9):772-3.
10. Riza Altiparmak M, Avsar S, Yanik S. Chylous ascites and chylothorax due to constrictive pericarditis in a patient undergoing haemodialysis. Neth J Med. 2004;62(2):59-61.
11. Castañón-González JA, Amézquita-Landeros JA, Velasco-Ortega EC, Deseano-Estudillo JL, León-Gutiérrez MA. Constrictive pericarditis: the story of a constrained heart. Cir Cir. 2010;78(4):342-6.
12. Hernández Santos JC, Solano Ramírez A, Garzón García A, Pérez Villalva A. Ascitis quilosa secundaria a pericarditis constrictiva crónica idiopática. Reporte de un caso y revisión de la bibliografía. Medicina Interna de Mexico. 2011; 27(4):393-398.
13. Yu GC, Xu XD, Zhong FM, Chen G, Chen D. Chylous Ascites and Chylothorax Caused by Constrictive Pericarditis. Chin Med J (Engl). 2017;130(20):2508-2509.
14. Welch TD Constrictive pericarditis: diagnosis, management and clinical outcomes. Heart (Published Online First). 2017. doi: 10.1136/heartjnl-2017-311683.
15. Marta MJ, Oliveira A, Varela MG, Saavedra JA, Ravara L. Constrictive tuberculous pericarditis: case report and review of the literature. Rev Port Cardiol. 2003;22(3):391-405.

