INTRODUÇÃO
A proteinose alveolar pulmonar (PAP) é um distúrbio pulmonar raro (cerca de um caso por100’000 indivíduos) de etiologia desconhecida1. Caracteriza-se pelo preenchimento alveolar com material amorfo o que prejudica as trocas gasosas levando a hipoxemia. Este material é um surfatante rico em material proteináceo insolúvel e em lípidos e cora com ácido periódico-Schiff (PAS).1-3
A proteinose alveolar pulmonar pode ser congénita ou adquirida, desta última são reconhecidas duas formas: a primária (idiopática) e a secundária a infeções pulmonares, neoplasias hematológicas e inalação prolongada de poeiras minerais como sílica, óxido de titânio, alumínio, óxido de índio-estanho e inseticidas2,4. Está descrita uma maior incidência de PAP em pacientes com neoplasias malignas hematológicas e infeções por VIH sugerindo uma relação com a disfunção imunológica3,5. Parecem existir também alterações no mecanismo homeostático da produção de surfactante ou na sua depuração por macrófagos alveolares2,3. Estas alterações estão relacionadas com a produção de anticorpos anti-factor estimulante de colónias de macrófagos de granulócitos que levam a um compromisso da reciclagem do surfatante que se acumula no espaço alveolar6.
O curso clínico desta patologia é variável, desde a remissão espontânea no melhor dos casos, passando por todo o espectro da gravidade da doença, até à falência respiratória intratável3. Os doentes com PAP apresentam-se tipicamente com um início gradual dos sintomas como a tosse seca persistente, dispneia progressiva, fadiga e mal-estar, perda de peso, febre baixa e/ou hipersudorese noturna e dor pleurítica1,2. No entanto, até 30% são assintomáticos, mesmo já com alterações estabelecidas, por isso o diagnóstico surge muitas vezes no seguimento do estudo de achados ocasionais na radiografia do tórax.
Caso Clinico
Doente do sexo masculino, 58 anos de idade, com antecedentes pessoais de diabetes mellitus tipo 2 desde há 10 anos com mau controlo metabólico habitual e com lesões de órgão alvo estabelecidas (doença renal cronica estadio 2 e doença aterosclerótica coronária);hipertensão arterial essencial conhecida desde há 5 anos, obesidade (índice de massa corporal de 41Kg/m2),e com antecedentes cirúrgicos de osteossíntese com placa e parafusos no úmero direito realizada na sequência de acidente laboral há 10 anos. Estava habitualmente medicado com: atorvastatina 10mg id; lisinopril 10mg id; nevibolol 5mg id; gliclazida 60mg bid; metformina/sitagliptina 100/50mg bid; insulina determir 14U + 22U e lansoprazol 30mg. Da história profissional é de referir trabalho como pedreiro durante 2 anos em fábricas de extração de pedra. Tratava-se de um ex-fumador com consumos de cerca de 30UMA.
Recorreu ao serviço de urgência por febre e mal estar generalizado desde o dia anterior associados a dor, calor e rubor do braço e antebraço direitos. Referia ainda história de tosse seca de longa data mas negava dispneia. Do exame físico à admissão salienta-se temperatura auricular 38ºC, tensão arterial (TA) 160/90mmHg e frequência cardíaca (FC) 95bpm. À ascultação pulmonar apresentava sons respiratórios rudes bilateralmente, sem ruídos adventícios audíveis. Eram evidentes sinais inflamatórios (dor, calor, rubor e edema) em todo o MSD mas mais exuberantes no braço, sem exsudado ou flutuação no local da cicatriz cirurgica. Do estudo realizado no serviço de urgência refere-se - gasimetria (GSA) sem insuficiência respiratória (pH 7,47 pCO2 36mmHg e pO2 79mmHg); analiticamente com leucocitose, neutrofilia e elevação da Proteina C Reactiva (21mg/dL); radiografia do MSD sem sinais de osteomielite, não tendo sido realizado estudo imagiológico dos tecidos moles; radiografia do tórax com infiltrados parenquimatosos bilaterais com aspecto tipo “largada de balões” – nºao existiam exames anteriores para comparação (Fig. 1). Foi admitido no internamento por celulite do membro superior e alterações da radiografia torácica de etiologia não esclarecida.
Durante o internamento para o tratamento da celulite cumpriu antibioterapia empírica com ceftriaxone 2000mg id por via endovenosa durante 14 dias com boa evolução – manteve apirexia sustentada desde o 4º dia de antibiótico e posterior resolução completa dos sinais inflamatórios do membro superior e descida dos parâmetros inflamatórios. Não houve isolamento de agentes infecciosos nas hemoculturas. Manteve, no entanto, queixas de tosse seca.
No seguimento da investigação das alterações da radiografia do tórax à admissão realizou-se Tomografia computorizada (TC) toraco-abdomino-pelvica queapresentava gânglios infracentimetricos pré-traqueais, mediastínicos periaorticos com algumas calcificações, múltiplas opacidades em vidro despolido (de predomínio no pulmão cortical das regiões apicais), sem distorção broncovascular e com espessamento dos septos interlobares traduzindo provavelmente processo infeccioso (Figura 2); nas secreções brônquicas colhidas para microbiologia houve isolamento de neumocystis jirovecii confirmado por pesquisa de DNA positiva pelo que iniciou tratamento com sulfametoxazol-trimetropim durante 14 dias (doente VIH egativo). No final do ciclo de antibioterapia realizou broncofibroscopia óptica que não mostrou alterações da árvore brônquica e colheu LBA sem alterações bioquímicas ou microbiológicas e com pesquisa de Pneumocystis jirovecii negativa. O doente teve alta clinicamente assintomático mas mantendo as alterações radiológicas.
Realizou electivamente provas de função respiratória que foram normais incluindo DLCO e biópsia pulmonar transtorácica que revelou tratar-se de uma proteinose alveolar pulmonar sendo este diagnóstico corroborado pela coloração de PAS do LBA positiva -presença de grânulos típicos cor magenta (Figura 3).
O doente manteve seguimento em consulta de Pneumologia. No seguimento de dois anos o doente tem estado clinicamente assintomático, mas com gradual agravamento imagiológico com a TC a mostrar áreas de padrão “crazy-paving” dispersas mas mais evidentes nos lobos superiores e segmento apical dos lobos inferiores (Figura 4). Repetiu por esta razão LBA que confirmou o diagnóstico. O caso foi apresentado ao centro de referência no Centro Hospitalar e Universitário de Coimbra, tendo sido decidido que enquanto não houver agravamento clínico nem alteração das provas funcionais e/ou hipoxemia na GSA não há indicação para lavagem alveolar. Mantém consultas trimestrais com avaliação regulat de GSA e provas funcionais e TC semestrais.
No período de seguimento o doente teve um internamento prolongado por espondilodiscite C4-C5 e D12-L1 com abcesso paravertebral anterior, com extensão intracanalar epidural por Staphylococcus aureus meticilino sensível.
DISCUSSÃO
Como já referido anteriormente a proteinose alveolar é uma entidade muito rara. A suspeita diagnóstica tem de ser elevada para encaminhar a marcha diagnóstica das alterações da radiografia do tórax no sentido deste diagnóstico. O que está descrito como aspecto habitual são infiltrados pulmonares bilaterais localizados na zona central e inferior, simulando por vezes o padrão “asas de morcego”, ainda que menos comum o padrão nodular difuso sem poupar quase nenhuma área como o do caso apresentado está também descrito. 9,10 No que diz respeito à TC as alterações mais comuns são as apresentadas neste caso, o padrão de vidro despolido com distribuição homogénea e a sobreposição com espessamento dos septos interlobulares levando ao aparecimento do designado padrão “crazy-paving”, no entanto, estas alterações embora comuns são transversais a outras entidades como a pneumonite de hipersensibilidade e a bronquiolite obliterante com pneumonia em organização.11 Assim ainda que pouco específicas as alterações dos exames de imagem são na maior parte das vezes o ponto de partida para a suspeição diagnóstica de PAP.
O diagnóstico de PAP é confirmado pelo exame histológico da biópsia transbrônquica com coloração positiva com PAS ou no caso da PAP autoimune com base no conjunto de 3 dados: TC com os achados típicos já referidos, LBA com PAS positivo e a presença de anticorpos anti GM-CSF no sangue periférico.2-4 Neste caso apesar de o LBA já ser indicativo do diagnóstico de PAP, foi realizada a biópsia para confirmação e exclusão de outros possíveis diagnósticos. Tratando-se de uma PAP secundária, dada a história de exposição profissional e a idade de apresentação, não foram doseados os anticorpos anti GM-CSF, e a possibilidade de associação com doença hematológica (também comum na PAP secundária)2,5 foi excluída uma vez que o doente não apresentava queixas hematológicas ou sintomas constitucionais e o leucograma e hemograma após resolução da infecção aguda foram persistentemente normais.
Sendo a PAP secundária uma doença com diminuição da função dos macrófagos e neutrófilos os doentes apresentam um risco acrescido de infecções por microorganismos oportunistas como a Nocardia, micobactérias, pneumocystis ou fungos2,3. Na fase pré-diagnóstico é importante distinguir se estamos perante um diagnóstico diferencial (a infecção por pneumocystis jiroveci também pode apresentar LBA com coloração PAS positiva) e/ou sobreinfecção13,14 como é o caso. Dado este risco os doentes devem ser anualmente vacinados contra influenza e contra o pneumococcus se doentes com mais de 65 anos4. O episódio de espondilodiscite grave do doente leva-nos a reflectir sobre a investigação da febre sem foco nos doentes com PAP que deve ser ampla e considerar sempre infecções menos comuns.
O tratamento da PAP secundária transversalmente aceite são as lavagens pulmonares com soro fisiológico por via endobrônquica e tem como indicações PaO2<65mmHg ou gradiente alvéolo-arterial de O2 ≥ 40mmHg ou dispneia severa e hipoxemia em repouso ou no exercício,3,4 daqui a necessidade do acompanhamento clínico e das provas funcionais respiratórias no seguimento do doente.
Em conclusão, o internamento na Medicina Interna, ainda que tenha como objectivo principal a resolução da doença aguda (neste caso a celulite do membro superior), é também uma oportunidade de identificação, sistematização e orientação dos problemas do doente. A história clinica completa nomeadamente a história de exposição quando falamos de doenças respiratórias revestem-se de especial importância. Os diagnósticos de patologias incomuns ainda que não devam ser o centro da investigação diagnóstica não podem ser esquecidos.
Figura I
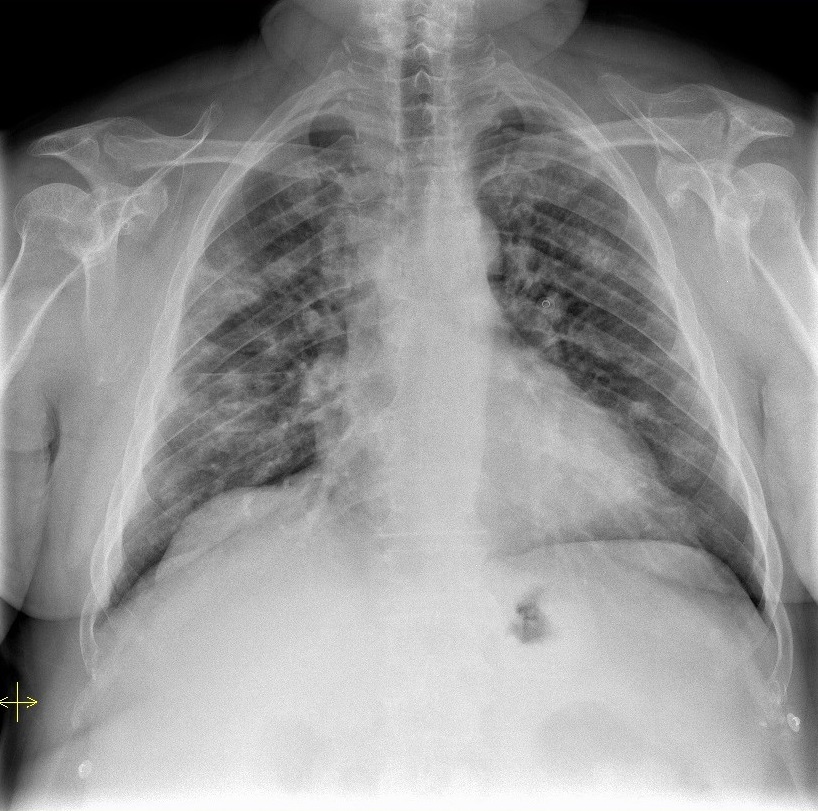
Radiografia do tórax com infiltrados parenquimatosos bilaterais com aspecto tipo “largada de balões”.
Figura II
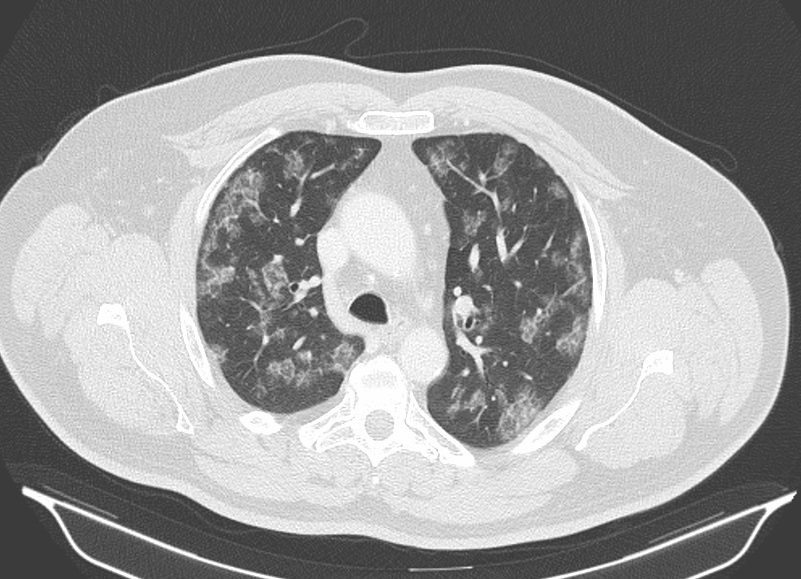
Tomografia computorizada (TC) torácica mostrando gânglios mediastínicos infracentimetricos e múltiplas opacidades em vidro despolido.
Figura III
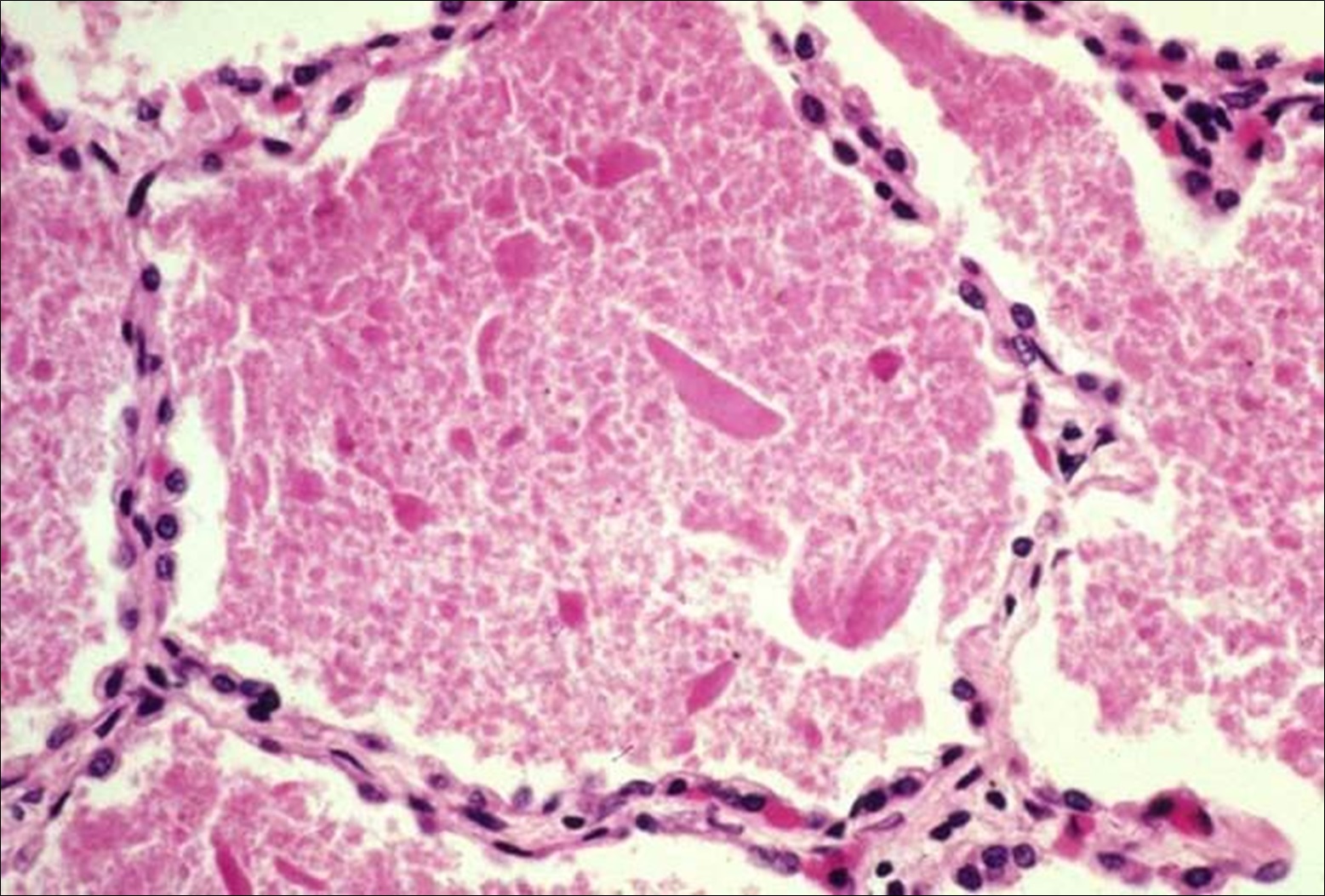
Coloração de PAS do líquido bronco-alveolar positiva - com presença de grânulos típicos cor magenta.
Figura IV
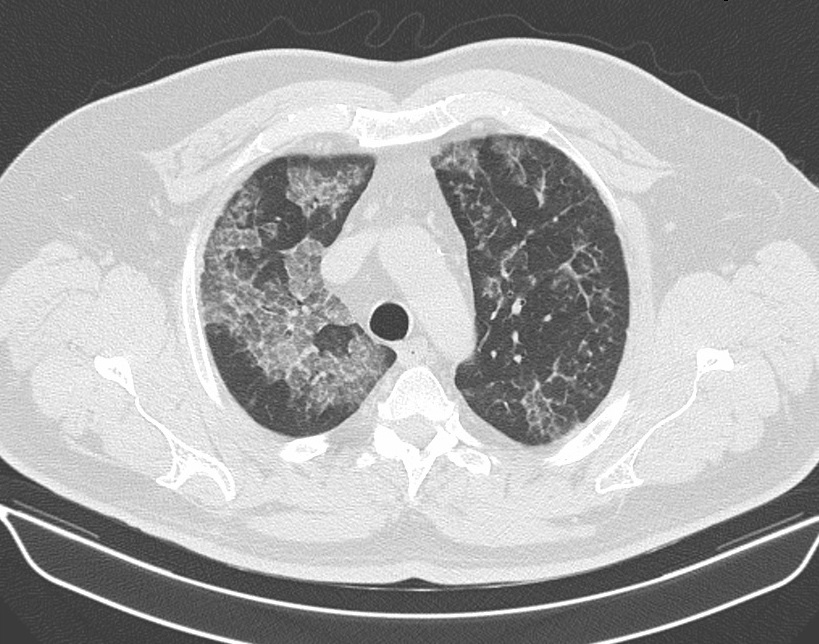
Tomografia computorizada (TC) torácica, onde se observam áreas de padrão “crazy-paving” dispersas mas mais evidentes nos lobos superiores e segmento apical dos lobos inferiores.
BIBLIOGRAFIA
1- Suzuki T, Trapnell BC. Pulmonary Alveolar Proteinosis Syndrome
Clinics in Chest Medicine, Volume 37, Issue 3, Pages 431-440
2- Huizar I, Kavuru MS. Alveolar proteinosis syndrome: pathogenesis, diagnosis, and management. Curr Opin Pulm Med. 2009 Sep;15(5):491-8.
3- R. Borie, C. Danel, M-P. Debray, Pulmonary alveolar proteinosis. European Respiratory Review 2011 20: 98-107
4- Suzuki T, Sakagami T, Young LR, et al. Hereditary pulmonary alveolar proteinosis: pathogenesis, presentation, diagnosis, and therapy. Am J Respir Crit Care Med. 2010 82(10):1292-304.
5- Xue Y, Han Y, Li T, Chen S, Zhang J, Pan J, et al. Pulmonary alveolar proteinosis as a terminal complication in a case of myelodysplastic syndrome with idic(20q-). Acta Haematol. 2010. 123(1):55-8
6- Carey B, Trapnell BC. The molecular basis of pulmonary alveolar proteinosis. Clin Immunol. 2010 135(2):223-35.
7 - Yaqub Sabeen, Harkins Michelle S..A 39 year old female with progressive dyspnea, dry cough and hypoxia: a case report.Southwest J. Pulm. Crit. Care. 2011; 3:130–140.
8- Wali SO, Samman YS, Altaf F, et al.Primary pulmonary alveolar proteinosis: a case report and a review of the literature.2000 Ann. Saudi Med.20:3–4.
9 - Frazier AA, Franks TJ, Cooke EO et-al. From the archives of the AFIP: pulmonary alveolar proteinosis. Radiographics. 2008. 28 (3): 883-99.
10 - Thomson JC, Kishima M, Gomes MU, et al. 2006.Pulmonary alveolar proteinosis: four cases.J. Bras. Pneumol32(3):261–266.
11 - Holbert JM, Costello P, Li W et-al. CT features of pulmonary alveolar proteinosis. AJR Am J Roentgenol. 2001;176 (5): 1287-94.
12 - Beccaria M., Luisetti M., Rodi G., et al. .Long‐term durable benefit after whole lung lavage in pulmonary alveolar proteinosis.Eur. Respir. J.2004;23:526–531
13 - Kotov PV1, Shidham VB. Alveolar proteinosis in a patient recovering from Pneumocystis carinii infection: a case report with a review of literature. Cytojournal. 2006 Oct 12;3:22
14 - Ker JM Pulmonary alveolar proteinosis—a case report and review.2004 SA J. Radiol.45–46.





