INTRODUÇÃO
A carcinomatose leptomeníngea (CL) consiste na infiltração difusa de células tumorais nas leptomeninges e espaço subaracnoideu.
Atualmente observa-se uma incidência crescente desta entidade em consonância com o aumento da sobrevida dos doentes neoplásicos, pela melhoria dos regimes terapêuticos e de suporte, assim como uma maior consciencialização da comunidade médica e progresso dos exames de neuroimagem necessários ao diagnóstico1. No entanto, dada a sensibilidade limitada dos métodos de diagnóstico, acredita-se que permanece subdiagnosticada2.
É uma complicação rara, identificada em aproximadamente 5% dos doentes com neoplasia, sendo a neoplasia da mama, pulmão, melanoma e gastrointestinais as neoplasias sólidas mais frequentemente associadas2,3,4.
Associada invariavelmente a elevada morbi-mortalidade e geralmente considerada uma situação clínica terminal, é fator de mau prognóstico independentemente do tipo, estadio e/ou controlo da doença primária1,5,7. A sobrevida média nos doentes não tratados é de 4-6 semanas, podendo aumentar para 2-4 meses nos doentes submetidos a tratamento8.
Os autores apresentam dois casos de CL associados a neoplasias sólidas, sendo salientadas a necessidade de elevada suspeição clínica, persecução diagnóstica e hipóteses terapêuticas.
CASO CLÍNICO 1
Mulher, 72 anos, reformada, previamente autónoma. Não fumadora, sem história familiar conhecida de neoplasia. Antecedentes de HTA, dislipidemia, adenocarcinoma do endométrio moderadamente diferenciado, tratado com histerectomia, salpingectomia bilateral total e radioterapia (2004) e adenocarcinoma pulmonar, diagnosticado em janeiro/2012, estadio T2bN2M1 (metastização óssea e hepática), tendo realizado quimioterapia de primeira linha (carboplatina e pemetrexed) de fevereiro a maio/2012 e pamidronato dissódico mensal. Na TAC toraco-abdominal de controlo (junho/2012) com redução de neoplasia espiculada no lobo superior do pulmão direito e dos fenómenos de linfangite carcinomatosa, regressão de derrame pleural e do aspeto osteocondensante das metástases ósseas difusas. Encaminhada ao Serviço de Urgência (SU) em julho/2012 por recusa alimentar, desorientação, agitação psicomotora, ataxia e dor óssea difusa, com cinco dias de evolução. Na admissão encontrava-se prostrada, apirética e normotensa. Status performance Karnofsky (SPK) 40%. Ao exame físico sem défices focais objetivados. O estudo analítico e a TAC crânio encefálica (CE) sem alterações relevantes. Excluída hipercalcemia. No internamento constatados sinais meníngeos. Ressonância magnética (RM) CE não efetuada por agitação. Realizada punção lombar (PL) cujo estudo revelou hipoglicorráquia e hiperproteinorráquia (tabela 1), tendo iniciado empiricamente ceftriaxone em dose meníngea. Posteriormente o estudo bacteriológico e pesquisa de antigénios capsulares foram negativos; o estudo citológico foi positivo para malignidade, compatível com carcinomatose meníngea secundária a neoplasia pulmonar (Fig.1). Houve evolução desfavorável, foram instituídos cuidados de conforto, vindo a falecer ao 15º dia de internamento.
CASO CLÍNICO 2
Mulher, 49 anos, previamente autónoma, com antecedentes de neoplasia da mama (carcinoma ductal invasor, triplo negativo) diagnosticada em 2014, submetida a tumorectomia, radioterapia e quimioterapia. Posteriormente, em 2016, constatada metastização cerebral, com exérese de lesão occipital esquerda única. Sem recidiva de doença de acordo com RM CE realizada em agosto/2017. Em outubro/2017, por dor lombar, realizou RM coluna e TAC toraco-abdomino-pélvico que excluíram lesões metastáticas. Em novembro/2017 com ptose palpebral direita e parésia facial periférica. Repetiu TAC e RM CE, sem evidência de lesões metastáticas. Em janeiro/2018 inicia vómitos persistentes, desorientação e confusão, sendo encaminhada ao SU. Na admissão apresentava-se febril (38,5ºC), com discurso impercetível, rigidez da nuca e midríase fixa à direita; SPK 40%. Realizada PL com pleocitose linfocítica, hipoglicorráquia, hiperproteinorráquia (Tabela 1). Internada sob antibioterapia empírica, aciclovir e dexametasona. Repetiu RM CE, sendo relatados focos de realce justacorticais em ambos os vales silvianos, com hipótese de trajetos vasculares ou pequenas lesões secundárias (Fig.2). A clínica evoluiu com disfagia, parésia facial bilateral, tetraparésia flácida, arreflexia dos membros inferiores, constatando-se polirradiculonevrite com atingimento de nervos cranianos (III, V, VII), documentada em eletromiografia. Os exames microbiológicos foram negativos. Manteve-se sempre forte suspeita de metastização meníngea sendo realizadas PL subsequentes (com exame citológico). Apenas na terceira PL foi confirmada malignidade, compatível com envolvimento por carcinoma de origem mamária (Fig.3). Verificou-se também evolução clínica desfavorável, foram instituídos cuidados de conforto e a doente faleceu no 22º dia de internamento.
DISCUSSÃO
A apresentação clínica da CL é, geralmente, aguda/subaguda surgindo em dias ou semanas. Caracteristicamente os sinais/sintomas neurológicos são multifocais, dada a disseminação de células tumorais no espaço subaracnoideu com possibilidade de afetar múltiplas áreas do neuroeixo. Assim, mesmo que o doente apresente apenas um único sintoma neurológico, uma avaliação cuidadosa revela frequentemente locais adicionais de disfunção6. A clínica pode ser atribuível a hipertensão intracraniana, irritação meníngea e disfunção cerebral/neuropatia8. No caso 1 fica patente a evolução aguda, com alteração do estado de consciência/encefalopatia atribuível a disfunção cerebral difusa (sem sinais imagiológicos sugestivos de hidrocefalia). Em contrapartida, no segundo caso, a evolução foi insidiosa com apresentação inicial sugestiva de envolvimento do VII par craniano e evolução posterior para polineuropatia craniana e envolvimento medular.
Em ambos os casos o diagnóstico foi estabelecido pelo exame citológico do líquido cefalorraquídeo (LCR), sendo este o gold standard diagnóstico apesar da baixa sensibilidade documentada. De acordo com a literatura, a primeira PL identifica células neoplásicas em apenas 50-60% dos casos, com a repetição do procedimento a elevar as hipóteses de diagnóstico para 80% e PL adicionais a aumentar em 2-5% por punção9. Assim, a PL deve ser repetida sempre que a citologia inicial for negativa e houver elevado grau de suspeita clínica, como no segundo caso. Os falsos negativos podem ainda ser minimizados através da extração de 10mL de LCR, processamento imediato da amostra e obtenção de líquor a partir de um local com doença leptomeníngea conhecida6,7,10,11. Se citologia não diagnóstica, o estudo do LCR pode ser sugestivo com os achados clássicos a consistir na presença de hiperproteinorráquia, hipoglicorráquia e ligeira pleocitose linfocítica8, em consonância com o estudo de ambos os doentes. Estas características nem sempre estão presentes, mas uma análise de LCR inteiramente normal é incomum.
Apesar dos cuidados adotados na realização de PL e colheita de LCR, a citologia pode ser persistentemente negativa. Nestes casos, o diagnóstico pode ser afirmado em contexto clínico apropriado suportado por estudo imagiológico adequado2,11 e, eventualmente, efetuar o doseamento de marcadores tumorais no LCR10.
A RM CE, com sensibilidade diagnóstica descrita entre 53-79% e especificidade de 77-100%8,9, deve ser realizada preferencialmente antes da PL e pode ser útil no diagnóstico, ao colocar em evidência realce linear ou nodular das leptomeninges, nervos cranianos, raízes nervosas espinhais ou da cauda equina9,11,12. Os resultados da RM CE e da análise do LCR são complementares e o uso de ambos aumenta a precisão do diagnóstico, devendo a PL ser protelada na presença de lesões ocupantes de espaço ou sinais sugestivos de hidrocefalia, pelo risco de herniação11,12.
Estão identificados vários fatores de risco para CL como a ressecção cirúrgica de metástases cerebrais da fossa posterior e manipulação cirúrgica do sistema ventricular 2,3,13. Acresce a estes fatores, o tipo de neoplasia, o subtipo histológico e, quando aplicável, padrão molecular. Os casos apresentados representam as duas neoplasias sólidas mais frequentemente associadas à CL: neoplasia da mama (12-35%) e pulmão (10-26%)3. No caso da neoplasia da mama, o subtipo histológico associado a maior risco de CL é o lobular invasivo2,3,4, diferente do determinado no caso apresentado – carcinoma ductal invasivo – relatado como o mais prevalente noutras séries3,14. Quanto ao padrão molecular, tal como o identificado, aquele mais frequentemente reportado é o triplo negativo (ausência de recetores para estrogénio, progesterona e proteína HER2)2,3,4. Nas neoplasias pulmonares, os carcinomas não pequenas células predominam como marcador de risco, sendo o subtipo histológico mais prevalente o adenocarcinoma, conforme o caso apresentado.
Outro fator de risco relatado é a presença de metastização cerebral, tal como descrito no caso 2, sendo a CL identificada em 21-82% destes casos9.
O tratamento da CL visa preservar as funções neurológicas e a qualidade de vida. Pode consistir na cirurgia, radioterapia, quimioterapia sistémica/intratecal ou mesmo na combinação destas opções terapêuticas6.
Apesar do tratamento, tradicionalmente, ser considerado paliativo, deve ser direcionado pelo prognóstico. A terapêutica combinada deve ser proporcionada a doentes que reúnam fatores de prognóstico favorável: SPK ≥ 60%, ausência de défices neurológicos extensos, doença sistémica mínima ou possibilidade de tratamento sistémico15. Os cuidados de suporte (radioterapia, corticoterapia e derivação ventrículo-peritoneal) e de conforto devem ser proporcionados a todos os doentes6.
Os doentes apresentados reúnem fatores de mau prognóstico (SPK de 40%, disseminação sistémica da doença neoplásica e encefalopatia/défices neurológicos extensos), com baixo potencial de resposta e taxa de sobrevida pelo que a instituição de cuidados de conforto se considera adequada.
CONCLUSÃO
A CL representa um desafio clínico pela dificuldade diagnóstica e ausência de um tratamento ótimo. Perante um doente com neoplasia avançada, o leque de diagnósticos diferenciais é menos abrangente, pela maior probabilidade de CL. No entanto, é crucial o diagnóstico assertivo com localização da doença às leptomeninges, excluindo patologia infeciosa em doentes febris e/ou imunocomprometidos. Fica patente a importância da repetição do estudo citológico do LCR perante elevada suspeita diagnóstica, dada a elevada prevalência de falsos negativos.
Após confirmação diagnóstica, é crucial proceder à seleção adequada dos pacientes com maior probabilidade de beneficiar de um tratamento.
A carcinomatose leptomeníngea é incurável e está associada a mau prognóstico com taxas de sobrevida baixas, como descrito nos casos apresentados. O tratamento visa a melhoria ou estabilização neurológica, aumento da esperança média de vida e/ou paliação.
Quadro I
Estudo bioquimico do líquido cefalorraquídeo.
| Caso clínico 1 | Punção Lombar | Caso clínico 2 | 1ª Punção Lombar | 2ª Punção Lombar | 3ª Punção Lombar |
| LCR | LCR | ||||
| Cor e aspeto | Incolor e límpido | Cor e aspeto | Incolor e límpido | Incolor e límpido | Incolor e límpido |
| Células (total) | 1708 mm3 | Células (total) | 43 mm3 | 22 mm3 | 3 mm3 |
| Leucócitos | 8 mm3 | Leucócitos | 30 mm3 | 12 mm3 | 3 mm3 |
| -- | -- | Neutrófilos | 20 % | 36 % | -- |
| -- | -- | Linfócitos | 80 % | 56 % | -- |
| Eritrócitos | 1700 mm3 | Eritrócitos | 13 mm3 | 10 mm3 | 0 mm3 |
| Glicose | 15 mg/dL | Glicose | 20 mg/dL | 16 mg/dL | 24 mg/dL |
| Proteínas | 76,2 mg/dL | Proteínas | 161,2 mg/dL | 147,9 mg/dL | 180,6 mg/dL |
| -- | -- | Desidrogenase láctica | -- | 103 UI/L | 123 UI/L |
| -- | -- | ADA | 2,7 UI/L | -- | -- |
LCR ( líquido cefalorraquídeo).
Figura I
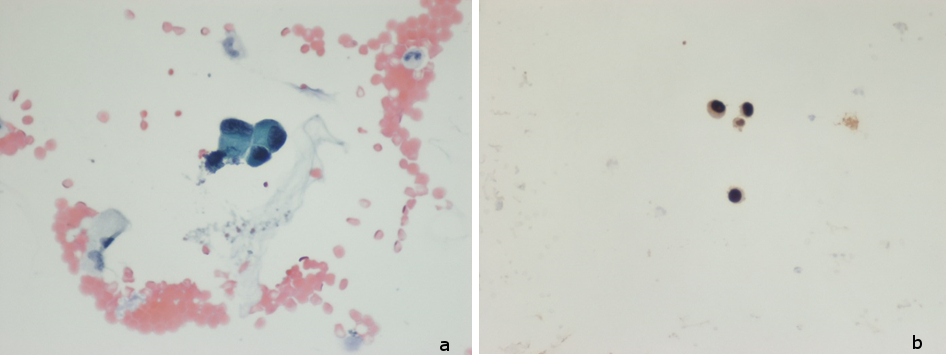
Lâminas coradas pelo método de Papanicolau. Células grandes, isoladas ou formando minúsculos agregados, com núcleos grandes, hipercromáticos e deslocados à periferia e citoplasma amplo (a). Estudo imunocitoquímico: celularidade com expressão epitelial TTF-1+ (b) compatível com carcinomatose meníngea secundária a neoplasia pulmonar.
Figura II
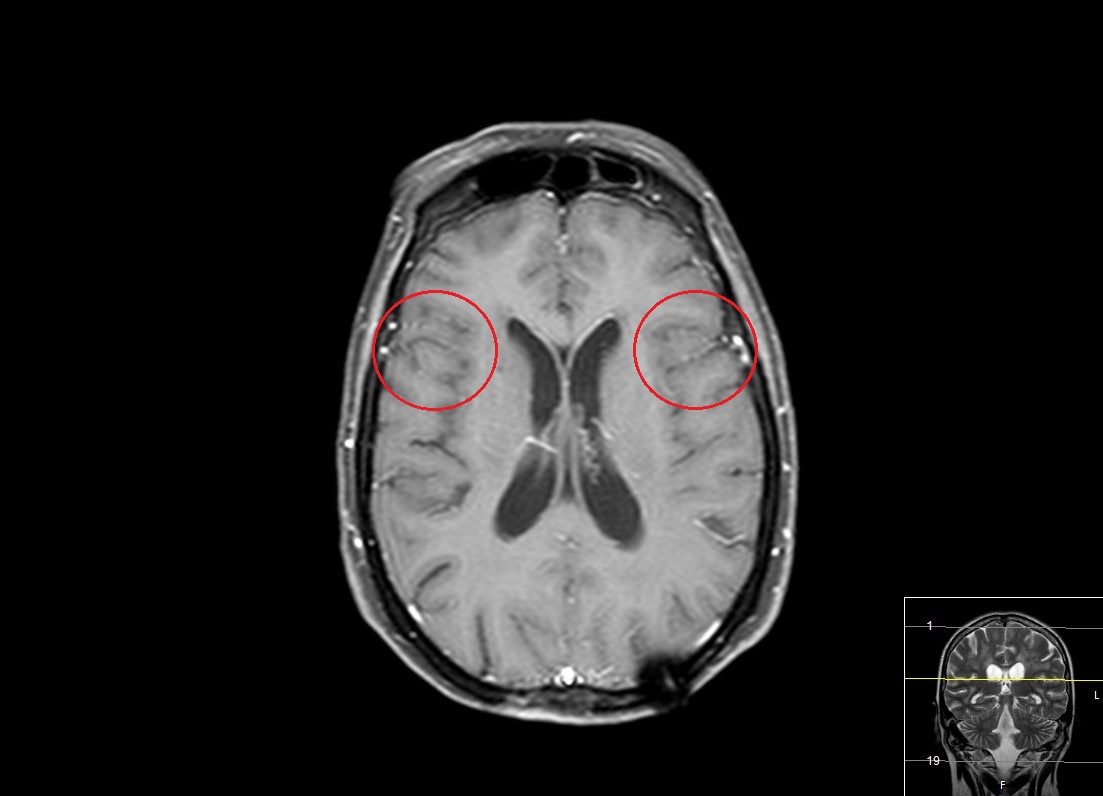
RM CE (após admnistração de contraste): focos de realce justacorticais, em ambos os vales silvianos (assinalados por círculos vermelhos), que embora possam tratar-se apenas de trajetos vasculares, não se exclui a hipótese alternativa de pequenas lesões secundárias.
Figura III
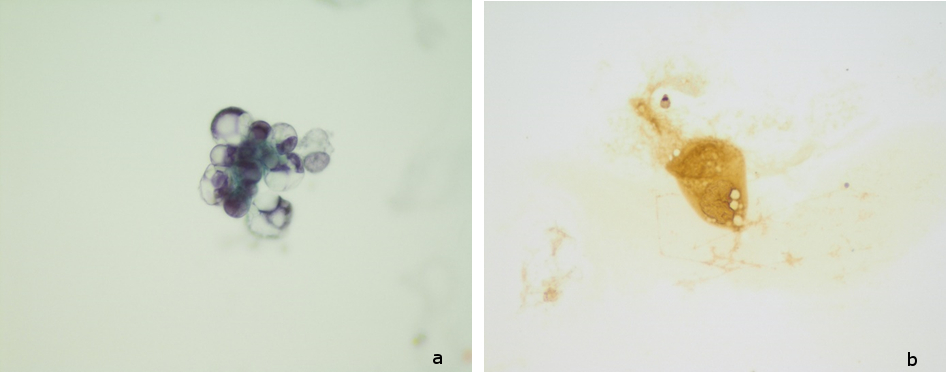
Lâminas coradas pelo método de Papanicolau. Escassas células grandes, isoladas ou formando minúsculos agregados, com núcleos grandes, hipercromáticos e deslocados à periferia e citoplasma amplo e vacuolizado (a). No estudo imunocitoquímico observou-se expressão em algumas das células descritas para pancitoqueratinas AE1/AE3 (b), compatível com envolvimento por carcinoma de origem mamária.
BIBLIOGRAFIA
1. Brower JV, Saha S, Rosenberg SA, Hullett CR, Ian Robins H. Management of leptomeningeal metastases: prognostic factors and associated outcomes. J Clin Neurosci. (2016) 27:130–7. 10.1016/j.jocn.2015.11.012
2. Le Rhun E, Galanis E (2016) Leptomeningeal metastases of solid cancer. Curr Opin Neurol 29:797–805
3. Le Rhun E, Taillibert S, Chamberlain MC. Carcinomatous meningitis: leptomeningeal metastases in solid tumors. Surg Neurol Int 2013; 4:S265–S288.
4. Alnajar H, Rosen L, Javidiparsijani S, Al-Ghamdi Y, Gattuso P, Prognostic Markers and Histologic Subtypes in Patients with Meningeal Carcinomatosis in Breast Cancer. Acta Cytologica 2017;61:140-144
5. Kaplan JG, DeSouza TG, Farkash A et al. Leptomeningeal metastases: comparison of clinical features and laboratory data of solid tumours, lymphomas, and leukemias. J Neurooncol 1990; 9: 225–229. 43.
6. Chamberlain, Marc C. Neoplastic meningitis. The Neurologist: July 2006 – vol12, issue 4; 179-187
7. Wasserstrom WR, Glass JP, Posner JB. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer 1982; 49:759.
8. Wang N, Bertalan MS, Brastianos PK: Leptomeningeal metastasis from systemic cancer: review and update on management. Cancer 124: 21- 35, 2018
9. Nayar, Gautam et al. “Leptomeningeal Disease: Current Diagnostic and Therapeutic Strategies.” Oncotarget 8.42 (2017): 73312-73328. PMC. Web. 17 Sept. 2018.
10. Chamberlain MC. Cytologically negative carcinomatous meningitis: usefulness of CSF biochemical markers. Neurology 1998; 50:1173.
11. Straathof CS, de Bruin HG, Dippel DW, Vecht CJ. The diagnostic accuracy of magnetic resonance imaging and cerebrospinal fluid cytology in leptomeningeal metastasis. J Neurol 1999; 246:810.
12. Clarke JL, Perez HR, Jacks LM, et al. Leptomeningeal metastases in the MRI era. Neurology 2010; 74:1449
13. Johnson MD, Avkshtol V, Baschnagel AM, et al. Surgical Resection of Brain Metastases and the Risk of Leptomeningeal Recurrence in Patients Treated with Stereotactic Radiosurgery. Int J Radiat Oncol Biol Phys 2016; 94:537.
14. Mittica G, Senetta R, Richiardi L, et al. Meningeal carcinomatosis underdiagnosis and overestimation: incidence in a large consecutive and unselected population of breast cancer patients. BMC Cancer. 2015; 15:1021. doi:10.1186/s12885-015-2042-y.
15. National Comprehensive Cancer Network (NCCN): Clinical Practice Guidelines in Oncology (NCCN Guidelines) – Central Nervous System Cancers. Version I.2015. NCCN.org. 2015.

