Introdução
Cerca de 5-10% das mulheres durante a gravidez ou no pós-parto imediato podem desenvolver trombocitopénia1. Esta pode estar incluída num conjunto de microangiopatias trombóticas (MAT), variando entre a púrpura trombocitopénica trombótica (PTT), o síndrome hemolítico urémico atípico (SHUa), o síndrome de HELLP (Hemolysis, Elevated Liver enzymes, Low Platelet count), o fígado gordo da gravidez, a pré-eclâmpsia, o síndrome antifosfolipídico (SAF) ou o lúpus eritematoso sistémico (LES). A gravidade é variável podendo tornar-se uma situação potencialmente fatal.
A PTT é uma entidade rara, que pode afectar cerca de 0,004% das grávidas ou mulheres no pós-parto imediato.2 As características principais são a trombocitopénia e a anemia hemolítica microangiopática de pequenos vasos, com formação de trombos ricos em plaquetas ou fibrina. O espetro de sintomas irá depender do grau de trombose microvascular, sendo uma doença multisistémica.3Resulta de um défice da metaloprotease ADAMTS13 (desintegrina e metaloproteínase com trombospondina tipo 1 modificada, membro 13), necessária à clivagem dos multímeros do Fator de von Willebrand (FvW)4. É uma condição adquirida em 90% dos casos, apresentando-se sobretudo no 3º trimestre ou pós-parto imediado, com presença de autoanticorpos IgG contra ADAMTS13, que levam a níveis de atividade ADAMTS13 < 10%.3 As formas congénitas de PTT manifestam-se habitualmente no início da gravidez com níveis de atividade ADAMTS13 < 10% e ausência de autoanticorpos.1
Em caso de suspeita clínica, e, sobretudo, quando os valores plaquetários são inferiores a < 50 x 109/L3 não se deve aguardar pelos resultados de ADAMTS13, sendo impreterível o início de plasmaférese, visto que os benefícios suplantam em larga escala os riscos. É também aconselhada a utilização de corticoides sistémicos. Quando se recupera um valor plaquetário > 50 x 109/L devem ser introduzidas aspirina e heparina de baixo peso molecular profiláticas3 pelo elevado risco trombótico.3
Caso clínico
Puérpera de 31 anos, com parto eutócico às 40 semanas e 4 dias de gestação, G1P1. História de 3 episódios de bacteriúria assintomática, com uroculturas positivas paraEscherichia coli durante a gravidez tratadas com fosfomicina. Fez suplementação oral com ácido fólico e ferro durante a gravidez. Restantes antecedentes pessoais sem relevo no presente contexto.
Ao 3º dia de pós-parto foi realizada visita de Ginecologia para decisão de alta clínica. À observação apresentava-se hemodinamicamente estável e apirética, pálida com escleróticas ligeiramente ictéricas. Lóquios normais, mamas tensas e períneo com cicatriz de episiorrafia sem sinais inflamatórios. Foram realizadas análises de controlo, representadas na tabela 1, que revelaram anemia normocítica normocrómica e trombocitopénia grave, tendo sido pedida consultadoria de urgência de Medicina Interna (MI).
À avaliação por MI referia apenas cansaço e cefaleia holocraniana que atribuiu ao pós-parto e à privação de sono. Negou hematúria, rectorragia, gengivorragia ou outras perdas hemorrágicas. Exame físico sem hematomas, petéquias ou equimoses. Sem outras manifestações neurológicas. Análises complementares (tabela 1) com sinais evidentes de anemia hemolítica com elevação da LDH, haptoglobina indoseável e elevação da bilirrubina à custa da indireta, com Coombs direto e indireto negativos. Sem consumo de complemento. A lâmina com esfregaço de sangue periférico revelou anisocitose, policromatofilia, 1,2% de esquizócitos, 1 eritroblasto por cada 100 leucocitos, raras plaquetas grandes. Foi solicitada ecografia abdominal que excluiu esplenomegália ou outras alterações.
As serologias virais foram negativas, bem como a pesquisa de marcadores de autoimunidade. A titulação de anticorpo anti-ADAMTS13 deu resultado positivo fraco com um valor de 17 UI/mL (negativo < 13 UI/mL) e a atividade ADAMTS13 foi de 6% (positivo < 10%).
Iniciou plasmaférese cerca de 6 horas após o início da suspeita clínica e completou 5 sessões, em dias consecutivos. Realizou ainda 3 dias de metilprednisolona 1g/dia. Apresentou melhoria analítica progressiva e estabilização dos valores de hemograma e resolução dos sintomas neurológicos. Até à atualidade não apresentou recidiva.
Discussão
Perante o quadro de anemia hemolítica microangiopática e trombocitopénia grave no pós-parto imediato foi necessário estabelecer um diagnótico diferencial entre as formas de MAT relacionadas com a gravidez. Transaminases hepáticas e pressão arterial dentro de valores normais afastam a hipótese de se tratar de Síndrome de HELLP - caso particular da pré-eclâmpsia. O LES é uma doença autoimune definida por um conjunto de critérios clínicos e imunológicos que cursa habitualmente com manifestações clínicas sistémicas, musculo-esqueléticas, dermatológicas, neurológicas, pulmonares, entre outras. Analiticamente podemos encontrar consumo de complemento, teste de Coombs direto positivo (na ausência de anemia hemolítica), leucopenia ou anemia hemolítica. Posteriormente, uma titulação positiva de anticorpos antinucleares suporta o diagnóstico. No caso apresentado não houve alteração do número de leucócitos em circulação nem consumo de complemento. O SAF corresponde a um estado de hipercoagulabilidade autoimune primário ou secundário (associado ao LES, por exemplo) provocado por anticorpos antifosfolípidos. Tanto o LES como o SAF não podem ser completamente excluídos numa fase inicial do quadro pela morosidade da imunologia clínica. No entanto, a ausência de outros critérios clínicos e imunológicos torna-os hipóteses mais remotas.
A hipótese de SHUa/PTT foi colocada pelos autores como a mais provável dada a gravidade, início súbito do quadro clínico e presença de anemia hemolítica microangiopática e trombocitopénia grave. É também a que apresenta mortalidade mais elevada quando não tratada atempadamente. O SHUa ocorre em qualquer fase da gravidez ou pós-parto. Contudo a lesão renal é mais expressiva levando a que 80% das puérperas necessitem de diálise à apresentação.3 O consumo de complemento - frequentemente presente no SHUa - estava ausente neste caso.
A PTT adquirida manifesta-se habitualmente no 3º trimestre de gravidez e pós-parto imediado com sintomas neurológicos que poderão ser frustres. Está recomendado o início de plasmaférese perante a suspeita clínica, mesmo na ausência da pêntade. A negatividade das restantes serologias e estudo da autoimunidade apoiaram a hipótese diagnóstica. A presença de uma actividade ADAMTS13 de 6% (inferior a 10%) e de autoanticorpo (ainda que fraco positivo) suportam o diagnóstico de PTT adquirida. No SHUa, pré-eclâmpsia e HELLP a actividade ADAMTS13 é habitualmente >15%. A salientar um doseamento positivo de anticoagulante lúpico após a primeira sessão de plasmaferese, provavelmente relacionado com o plasma dador, tendo normalizado nas avaliações seguintes.
Inicialmente descrita por Moschowitz em 19245, a patogénese e fisiopatologia da PTT tem melhorado dramaticamente ao longo dos últimos 15 anos6. O défice de ADAMTS13 é a característica central que leva às manifestações clínicas deste distúrbio e que deve ser diferenciada das outras formas de MAT associadas à gravidez ou ao pós-parto imediato. As MAT correspondem a um espetro de doenças com características clínicas semelhantes: a anemia hemolítica microangiopática com trombocitopénia e presença de esquizócitos no esfregaço de sangue periférico. Enquanto que a plasmaférese é eficaz para tratar a PTT e o SHUa, não é adequada para os outros tipos de MAT.
A PTT foi caracterizada em 1996, por Amorosi and Ultmann, pela presença da pêntade: trombocitopénia, anemia hemolítica microangiopática, sinais neurológicos flutuantes, lesão renal aguda e febre, habitualmente de evolução paulatina.7 No entanto, podemos estar perante um caso de PTT sem a pêntade completa.6 Até 35% das mulheres podem não apresentar alterações neurológicas, lesão renal aguda ou febre. Desta forma, na presença de uma anemia hemolítica microangiopática e trombocitopénia grave deverá ser colocada a hipótese de se tratar de uma PTT.
Dado o elevado consumo de plaquetas a trombocitopenia varia habitualmente entre 10-30 x 10^9/L no início da apresentação clínica. Os eritrócitos sofrem fragmentação mecânica nos vasos parcialmente ocluídos devido ao fluxo turbulento. Os valores de hemoglobina médios à apresentação são de 80-100 g/L com presença esquizócitos no esfregaço de sangue periférico, níveis baixos de haptoglobina e aumento da contagem de reticulócitos. O teste de Coombs direto é negativo. A combinação da hemólise com a isquémia dos tecidos leva a um aumento da LDH.8
Durante a gravidez normal ocorrem alterações hemostáticas hormonomediadas que conferem proteção durante o parto, favorecendo um estado pró-coagulante. O Fator VIII e FvW aumentam em paralelo na primeira metade da gravidez, com aumento significativo do FvW no restante período da gravidez e até à 6ª semana de puerpério.9 A relação entre o FvW e a ADAMTS13 é inversamente proporcional, com reduções da sua atividade até ao puerpério8, o que favorece o aparecimento de PTT no 2º e 3º trimestre de gravidez ou no pós-parto imediato.
A plasmaférese é a primeira linha de tratamento com reduções na mortalidade de 90% para 10-20%.6 Permite a remoção do autoanticorpo e normaliza os níveis de ADAMTS13. Está recomendada a continuação da plasmaférese até ao mínimo de 2 dias após contagem de plaquetas > 150 x 10^9/L.6Na PTT adquirida está ainda recomendada a utilização de elevada dose de corticoides associada à plasmaférese.
Estão a ser devolvidos novos scores de avaliação como ferramenta de predição para a PTT de forma a estabelecer o diagnóstico e iniciar tratamento atempado. Estas ferramentas serão úteis como alternativa em centros que não disponham de doseamentos de ADAMTS13.10
Conclusão
A diferenciação das diversas MAT associadas à gravidez é um grande desafio clínico. O tratamento estabelecido para a PTT é a plasmaférese que deve ser iniciada quando diagnóstico é ainda presumptivo pela presença de anemia hemolítica microangiopática e trombocitopénia. A determinação da atividade e presença de autoanticorpos ADAMTS13 é determinante para o diagnóstico definitivo e diferenciação entre as formas adquiridas e as congénitas. Deve estabelecer-se uma abordagem multidisciplinar entre medicina interna, ginecologia e obstetrícia, hematologia clínica e a medicina intensiva para garantir um desfecho clínico favorável.
Quadro I
Tabela
| 3º Dia puerpério | 3º Dia puerpério | 4ºDia puerpério | 4ºDia puerpério | 6ºDia puerpério | 8ºDia puerpério | 1 anos episódio | |
| 13h00min | 20h00min | 01h00min | 9h:00min | 9h:00min | 9h:00min | 9h:00min | |
| Hematócrito % (36-46) | 20 | 22 | - | 21 | 23 | 25 | 42 |
| VGM fL (83-101) | 84 | 84,4 | - | 83,6 | 85,3 | 86,2 | 82,8 |
| HGM pg (27-32) | 30 | 29,7 | - | 29,8 | 30,4 | 29,7 | 28,7 |
| CHGM g/L (315-345) | 357 | 351 | - | 357 | 356 | 345 | 340 |
| RDW % (11.6-14) | 14 | 14 | - | 14,1 | 14,6 | 15,5 | 12,6 |
| Leucocitos x10^9/L (4.0-10.0) | 9 | 11,1 | - | 16,2 | 10,2 | 13,6 | 5,7 |
| Plaquetas x10^9/L (150-400) | 12 | 9 | - | 26 | 112 | 330 | 322 |
| aPTT (razão) | - | 1 | - | - | - | - | 1,1 |
| PCR mg/dL <5 | 23 | - | - | - | - | - | <3 |
| Reticulócitos % | - | 4,3 | - | - | - | - | 0,9 |
| VS mm/h | - | 20 | - | - | - | - | - |
| INR (razão) | - | 0,9 | - | - | - | - | - |
| Fibrinogénio g/L (1,8-4,8) | - | 5,8 | - | - | - | - | 3,1 |
| Proteína S % (53-109) | - | 65,3 | - | - | - | - | - |
| Proteína C % (70-140) | - | 131 | - | - | - | - | - |
| Ac Lúpico (<1,2) | - | - | - | Positivo* | - | - | Negativo |
| Haptoglobina mg/dL (30-200) | - | <7 | - | - | - | 149 | 122 |
| AST UI/L (5-34) | - | 51 | - | - | - | - | 19 |
| ALT UI/L (<55) | - | 23 | - | - | - | - | 19 |
| Fosfatase alcalina U/L (40-150) | - | 123 | - | - | - | - | - |
| LDH UI/L (125-243) | - | 888 | - | 441 | 272 | 248 | 156 |
| Sódio mmol/L (136-144) | - | 141 | - | - | - | - | - |
| Potássio mmol/L (3,3-5,1) | - | 4,3 | - | - | - | - | - |
| Cloro mmol/L (101-111) | - | 107 | - | - | - | - | - |
| BUN mg/dL (7-18,7) | - | 12 | - | - | - | - | 9 |
| Creatinina mg/dL (0,6-1,1) | - | 0,6 | - | - | - | - | 0,6 |
| Bilirrubina total mg/dL (0,2-1,2) | - | 1,9 | - | - | - | - | 0,7 |
| Bilirrubina directa mg/dL (<0,2) | - | 0,5 | - | - | - | - | 0,3 |
| Complemento C3 g/L (0,79-1,52) | - | 1,29 | - | - | - | - | - |
| Complemento C4 g/L (0,16-0,38) | - | 0,228 | - | - | - | - | - |
| TSH µIU/mL (0,35-4,94) | - | 0,81 | - | - | - | - | - |
| fT4 ng/dL (0,52-3,88) | - | 1,1 | - | - | - | - | - |
| IgG g/L (7,51-15,60) | - | 7,6 | - | - | - | - | - |
| IgA g/L (0,82-4,53) | - | 1,92 | - | - | - | - | - |
| IgM g/L (0,46-3,04) | - | 1,2 | - | - | - | - | - |
| ANA’s | - | Negativo | - | - | - | - | - |
| ANCA-proteinase 3 UA/mL (<15) | - | <1,4 | - | - | - | - | - |
| ANCA-mieloperoxidase UA/mL (<15) | - | <1,4 | - | - | - | - | - |
| Anti-dsDNA U/mL (<20) | - | 7 | - | - | - | - | - |
| Crioglobulinas | - | Negativo | - | - | - | - | - |
| Anti Beta2-gp1,IgM UA/mL (<15) | - | 3,14 | - | - | - | - | - |
| CMV IgG/IgM UA/mL | - | 26/Negativo | - | - | - | - | - |
| EBV IgG/IgM UA/mL | - | 15,9/73,8/Negativo | - | - | - | - | - |
| Herpes simplex | - | Negativo | - | - | - | - | - |
| Urocultura | - | - | Negativo | - | - | - | - |
| Hemoculturas | - | - | Hemoculturas | - | - | - | - |
| Hemoglobina g/L (120-150) | 70 | 77 | - | 74 | 81 | 87 | 144 |
Evolução analítica da doente; * Após 1ª sessão de plasmaférese
Figura I
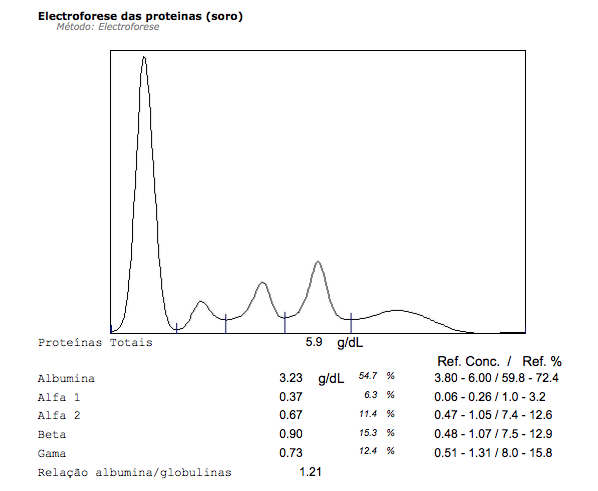
Electroforese de proteínas da doente antes do início de plasmaférese
BIBLIOGRAFIA
1)Cines DB, Levine LD, Thrombocytopenia in pregnancy, Hematology Am Soc Hematol Educ Program, 2017 Dec 8;2017(1):144-151
2)Martin JN Jr, Bailey AP, Rehberg JF, Owens MT, Keiser SD, May WL. Thrombotic thrombocytopenic purpura in 166 pregnancies: 1955–2006. Am J Obstet Gynecol 2008; 199: 98– 104
3)Marie Scully, MD, Thrombotic Thrombocytopenic Purpura and Atypical Hemolytic Uremic Syndrome Microangiopathy in Pregnancy, Semin Thromb Hemost, 2016 Oct;42(7):774-779
4)Furlan M, Robles R, Solenthaler M, Wassmer M, Sandoz P, Lämmle B. Deficient activity of von Willebrand factor-cleaving protease in chronic relapsing thrombotic thrombocytopenic purpura. Blood 1997 May 1;89(9):3097-103
5)Moschowitz E., Hyaline thrombosis of the terminal arterioles and capillaries: a hitherto undescribed disease. Proc NY Pathol Soc. 1924;24:21–24
6)Scully M,Hunt BJ,Benjamin S,et al. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. Br J Haematol. 2012 Aug;158(3):323-35
7)Amorosi E, Ultmann J. Thrombotic thrombocytopenic pur- pura: report of 16 cases and review of the literature. Medicine. March 1966 - Volume 45 - Issue 2 - ppg 139-160
8)Mannucci PM, Canciani MT, Forza I, Lussana F, Lattuada A, Rossi E. Changes in health and disease of the metalloprotease that cleaves von Willebrand factor. Blood 2001;98(9):2730–5
9)Mari R. Thomas, Susan Robinson and Marie A. Scully, How we manage thrombotic microangiopathies in pregnancy, British Journal of Haematology, 2016, 173, 821–830
10)Bendapudi PK, Hurwitz S, Fry A, Marques MB, Waldo SW, Li A, Sun L, Upadhyay V, Hamdan A, Brunner AM, Gansner JM, Viswanathan S, Kaufman RM, Uhl L, Stowell CP,Dzik WH, Makar RS. Derivation and external validation of the PLASMIC score for rapid assessment of adults with thrombotic microangiopathies: a cohort study. Lancet Haematol 2017; 302

