Introdução:
A Paniculite Mesentérica (PM) corresponde a um processo inflamatório asséptico inespecífico, que envolve predominantemente o mesentério do intestino delgado e menos frequentemente (~20%) o mesentério cólico.1 Em casos raros pode envolver o retroperitoneu, a gordura pélvica ou peripancreática. É um achado mais frequente em homens (rácio homem:mulher de 2-3:1) e em caucasianos.1,2
O seu diagnóstico foi feito pela primeira vez em 1942, por Juraz, mas manteve-se um achado raro até à massificação das técnicas de imagem abdominal, principalmente a tomografia computorizada (TC). Em algumas séries a prevalência da PM pode ir até 7.8% nas TC abdominais. Num estudo retrospectivo de Daskalogiannaki et al., 91,8% dos diagnósticos de PM foram incidentais.2-4
Os achados tomográficos para o diagnóstico de PM são baseados nos 5 critérios de Coulier. Para um diagnóstico seguro devem estar presentes pelo menos 3: aumento da gordura mesentérica, hiperatenuação adiposa, gânglios infracentimétricos na gordura mesentérica, sinal do halo (reforço periférico dos gânglios e vasos mesentéricos) e sinal da pseudocápsula. No entanto, apesar de cada vez menos requisitados, a biópsia e histologia permanecem o gold-standard para o diagnóstico definitivo, até porque o sinal do “halo” pode igualmente estar presente em doentes com linfoma mesentérico e o sinal da pseudocápsula também pode acompanhar tumores lipomatosos mesentéricos (benignos e malignos).4-6
As manifestações da PM são inespecíficas e altamente variáveis: incluem doentes assintomáticos, distensão/dor abdominal (o sintoma mais frequente - 54,3%), febre sem foco, náusea, perda ponderal, obstipação ou massa abdominal palpável (até 50% dos doentes).4
Analiticamente as características mais frequentemente associadas são elevação dos marcadores inflamatórios de fase aguda (até metade dos doentes).7
Apesar de não haver um algoritmo claro de abordagem ao doente com PM, deve ser estratificado em forma primária/idiopática (40-51% dos casos) ou secundária. A PM secundária pode associar-se a: causa isquémica, infecciosa, autoimune ou neoplásica.
A associação de PM com neoplasias é particularmente frequente – ocorre 40-69,4% dos casos – sendo mais prevalente em doentes mais velhos. Além disso, segundo Putte-Katier, et al. a PM aumenta o risco de desenvolvimento de neoplasias num período de follow-up de 5 anos, comparado com o grupo controlo (14,6% Vs 6.9%). No entanto a correlação PM e neoplasias não é consensual e as opiniões divergem no que diz respeito à visão da PM enquanto síndrome paraneoplásico. Actualmente, na ausência de uma resposta clara, é aconselhado o estudo etiológico sistemático de forma a excluir a coexistência de uma neoplasia.2,7-10Dentro do universo da patologia oncológica, os tumores mais frequentemente associados à PM são: linfoma (28%), melanoma (18%), colorrectal (15%) e próstata (13%).8
Relativamente ao tratamento da PM, deve ser dirigido à doença de base (na PM secundária). Contudo, nos doentes com sintomas agudos, o tratamento eficaz inclui corticoterapia (1ª linha) e outros agentes imunossupressores, nomeadamente talidomida, ciclofosfamida, azatioprina, com diferentes graus de sucesso – pelo que se sugere a individualização do tratamento. Também a radioterapia, colchicina e tamoxifeno parecem ter alguma resposta. A cirurgia é reservada aos casos refractários ao tratamento médico ou perante complicações como quadros oclusivos ou perfuração intestinal.10,12
Caso Clínico:
Apresentamos o caso de um homem, residente em Matosinhos, com antecedentes de hipertrofia benigna da próstata, hipertensão arterial e tabagismo prévio (20 Unidades maço/ano).
Recorreu ao serviço de urgência (SU) em Abril de 2018, por febre com 48 horas de evolução de predomínio vespertino (máximo de 38.4ºC) e sudorese nocturna. Adicionalmente referia dor cervical e lombar sem ritmo claramente mecânico ou inflamatório, com duas semanas de evolução, para a qual já teria sido avaliado e medicado com anti-inflamatórios não esteróides (AINEs), sem resposta, o que motivou a realização de ressonância magnética que apenas documentou alterações degenerativas em C3-C5.
No SU, referia dor moderada na região trapezóide bilateral. Objectivamente encontrava-se apirético e hipotenso (pressão arterial média de 70 mmHg), sem alterações no exame cardiopulmonar ou abdominal. De positivo a salientar adenomegalia na região supraclavicular esquerda (cerca de 2 cm de diâmetro), com consistência fibroelástica e móvel. O achado clínico foi confirmado ecograficamente, onde se observaram múltiplas adenopatias na região laterocervical esquerda e supraclavicular a maior com 24 mm.
Analiticamente a destacar: anemia normocítica, normocrómica (Hb 11,2g/dl), leucocitose discreta com monocitose, creatinina 1,6 mg/dl, Proteína C Reactiva 244 mg/L e velocidade de sedimentação de 101mm/h.Sem alterações na radiografia simples do tórax ou no exame sumário de urina tipo II. No estudo imagiológico abdominal, ecograficamente com aumento da ecogenecidade da gordura mesentérica, e TC abdominopélvica a confirmar hiperatenuação da gordura mesentérica, com gânglios infracentimétricos, alguns com evidente reforço periférico – achados altamente sugestivos de PM (Figura 1).
Após exclusão de aparente foco infeccioso activo, iniciou prednisolona (1mg/Kg/dia) e foi internado para estudo etiológico. A estratificação etiológica foi feita tendo por base as quatro categorias mais frequentemente associadas à PM: isquémica, infecciosa, autoimune ou neoplásica.
A causa isquémica foi rapidamente posta de lado dada a inexistência de antecedentes cirúrgicos relevantes, ou clínica compatível com trombose venosa ou arteriopatia mesentérica.
A causa infecciosa tinha alguma plausibilidade clínica pelo que, além de hemoculturas (HC) e urocultura (UC) foi feito um estudo de doenças infecciosas que incluíram serologias (VHB, VHC, VIH1 e 2, CMV, EBV), reacção de Wright, pesquisa de Borrellia spp, VDRL e TPHA. Apesar de plausível, a resposta clínica ao tratamento com prednisolona e a procalcitonina (0,06 ng/ml), tornaram a causa infecciosa pouco provável, mesmo antes da disponibilidade dos resultados, que entretanto foram todos negativos, incluindo HC e UC. De salientar apenas positividade do anticorpo Hbc total, cuja carga vírica, pedida posteriormente, foi negativa.
No que diz respeito à etiologia autoimune, as queixas de dor articular/óssea de difícil caracterização, com resposta clínica à corticoterapia, tornaram mandatória a exclusão desta causa. Contudo, o estudo analítico efectuado demonstrou-se negativo (Tabela 1).
Por fim, relativamente à causa neoplásica, considerando a idade do doente, a febre, a sudorese, e as adenomegalias cervicais, cedo se direccionou a atenção para esta etiologia.Das neoplasias mais vezes associadas a PM, o cancro colorrectal e prostático pareciam pouco prováveis, dada a existência de colonoscopia de 2014 sem alterações, TC actual sem evidência de tumor intestinal, e ecografia prostática sem alterações e antigénio específico da próstata estável 3 meses antes do quadro actual.A orientação do estudo foi ditada pelos achados no exame objectivo, com realização de biópsia aspirativa por agulha fina da adenopatia supraclavicular esquerda. Ao exame citológico observou-se uma população de células linfóides constituída por linfócitos pequenos e intermédios, com aspectos sugestivos de doença linfoproliferativa. O estudo foi complementado com imunofenotipagem, que revelou características fenotípicas de linfoma folicular (CD19+, CD20+, CD10+, cadeias leves kappa+) com hiperexpressão de BCL-2.
Para estadiamento realizou TC do tórax, Tomografia de Emissão de Positrões (PET-FDG) e biópsia da medula óssea (MO). Apresentava desidrogenase láctica normal (261 U/L) e B2-microglobulina aumentada (3.73 mg/L). A TC excluiu a existência de massas ou adenopatias nos mediastínicas/pulmonares. A PET-FDG confirmou doença linfoproliferativa metabolicamente activa com envolvimento supra-diafragmático, medula óssea e mesentério (Figura 2). A biópsia de MO demonstrou medula hipercelular, com representação das três linhas celulares hematopoiéticas e linfócitos pequenos e intermédios dispostos difusamente e o estudo imunohistoquímico mostrou positividade forte para CD20 no componente linfóide difuso e nas células fantasmas na zona de necrose, com CD10+ e Bcl2+, confirmando-se, assim, o envolvimento da medula óssea por linfoma não Hodgkin de células B de centro folicular.
Relativamente à evolução, durante o internamento, após instituição da corticoterapia, verificou-se apirexia sustentada desde o segundo dia de internamento, embora com recrudescimento após diminuição da dose de corticosteróide para doses inferiores a 0,25 mg/Kg/dia. Analiticamente houve igualmente boa resposta, com recuperação da hemoglobina e normalização da função renal. As queixas álgicas referidas à região cervical e lombar foram mais persistentes, mas controladas com corticoterapia e AINE associadamente.
O doente foi apresentado em consulta de grupo oncológico, tendo iniciado quimioterapia 2 semanas após a alta com Rituximab, Ciclofosfamida, Vincristina e Prednisolona. Considerando a serologias do VHB optou-se pelo início de lamivudina, previamente ao início da quimioterapia, pelo risco de reactivação de hepatite B oculta.
Conclusão:
Apesar de descrita como uma condição rara, a massificação das técnicas de imagem têm vindo a fazer aumentar consideravelmente o diagnóstico de PM, que é muitas vezes incidental. Actualmente pode entender-se a PM como um diagnóstico sobretudo imagiológico, de etiologia variável e cuja estratificação é fundamental.2-3
Embora não exista um algoritmo claro da abordagem diagnóstica da PM, considerando a possibilidade de se entender esta condição enquanto síndrome paraneoplásica, reforça a importância do seu estudo aprofundado e sistematizado.2,7Assim, conforme exposto neste caso clínico propõe-se a consideração das causas secundárias, em 4 categorias: isquémica, infecciosa, autoimune e neoplásica, que devem sempre ser pesquisadas. Se todo o estudo for negativo, a PM será classificada como idiopática, o que, mesmo assim, não dispensa a vigilância subsequente, pois a existência de PM parece aumentar o risco de desenvolvimento de neoplasias.
Com este caso clínico pretendeu-se exemplificar a marcha diagnóstica nos casos de PM, reforçando ainda a importância de um exame objectivo minucioso na orientação clínica, sem o qual o diagnóstico de linfoma poderia ter passado despercebido ou ser alcançado mais tardiamente.
Quadro I
Resultado analíticos efectuados para exclusão de causa autoimune.
| Exame Laboratorial | Resultado |
| | |
| Factor Reumatóide | Negativo |
| Anticorpos Anti-nucleares | Negativo |
| Anticorpos Anti-mitocondriais | Negativo |
| HLA-B27 | Negativo |
| Enzima Conversora da Angiotensina | Normal |
Figura I
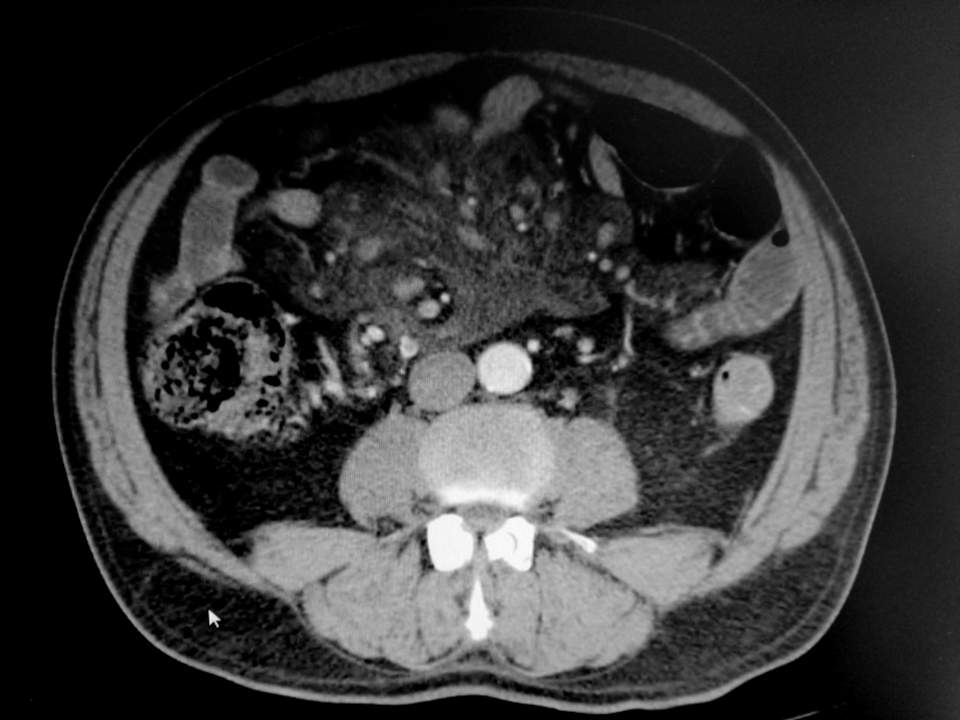
TC abdominopélvica a confirmar hiperatenuação da gordura mesentérica, com gânglios infracentimétricos, alguns com evidente reforço periférico – achados altamente sugestivos de PM.
Figura IV
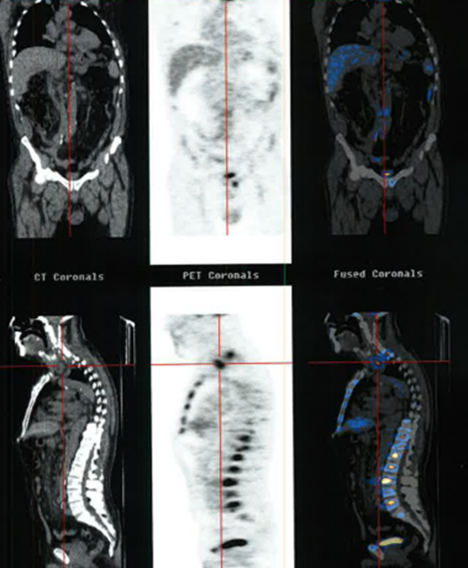
PET de estadiamento: Doença linfoproliferativa metabolicamente activa e significativamente ávida para FDG em actividade, com envolvimento linfomatoso ganglionar supra-diafragmático, medular/ósseo e do mesentério.
BIBLIOGRAFIA
1.Kgmo M, Elnager A, Mashoshoe K. Mesenteric Panniculitis.BMJ Case Rep. 2017 Sep 4;2017
2.DaskalogiannakiM, Voloudaki A, Prassopoulos P, Magkanas E, Stefanaki K, Apostolaki E, Gourtsoyiannis N. CT evaluation of mesenteric panniculitis: prevalence and associated diseases.AJR Am J Roentgenol. 2000 Feb;174(2):427-31.
3. Waleed S. Mahafza, Karam A. et al. Diagnosis of mesenteric panniculitis in the multi-detector computed tomography era. Association with malignancy and surgical history. Saudi Med J. 2017 Oct; 38(10): 1013–101
4.Laughlin P, Filippone A, Maher M. The “Misty Mesentery”: Mesenteric Panniculitis ant Its Mimics.AJR Am J Roentgenol. 2013, Feb;200(2):W116-23.
5. Coulier B. Mesenteric panniculitis. Part 1: MDCT--pictorial review. JBR-BTR. 2011 Sep-Oct;94(5):229-40
6.Seo BK, Ha HK, Kim AY et al Segmental misty mesentery: analysis of CT features and primary causes. Radiology 2003, 226:86–94
7.Putte-Katier N, Bommel EF, Elgersma OE, Hendriksz TR Mesenteric panniculitis: prevalence, clinicoradiological presentation and 5-year follow-up. Br J Radiol 2014, 87(1044):20140451
8.Badet N, Sailley N,Briquez C, Paquette B, Vuitton L, Delabrousse É.Mesenteric panniculitis: Stil an ambiguous condition; Diagn Interv Imaging.2015 Mar;96(3):251-7.
9.Issa I and Baudoun H. Mesenteric panniculitis: Various presentations and treatment regimens.World J Gastroenterol. 2009 Aug 14;15(30):3827-30.
10.Akram S, Pardi DS, Schaffner JA, Smyrk TC. Sclerosing mesenteritis: clinical features, treatment, and outcome in ninety-two patients. Clin Gastroenterol Hepatol. 2007 May;5(5):589-96;
11. Steve Halligan, Andrew Plumb, and Stuart Taylor. Mesenteric panniculitis: systematic review of cross-sectional imaging findings and risk of subsequent malignancy. Eur Radiol. 2016; 26(12): 4531–4537
12 .Roginsky G, Mazulis A, Ecanow J,Ehrenpreis ED. Mesenteric Panniculitis Associated With Vibrio cholera Infection.ACG Case Rep J.2015 Oct 9;3(1):39-41



