INTRODUÇÃO
A lesão hepática idiossincrática induzida por fármacos é uma reação adversa rara com uma apresentação clínica e graus de gravidade muito distintos, podendo manifestar-se por icterícia, insuficiência hepática aguda e morte.
Devido à diversidade de apresentações clínicas, à ausência de exames complementares de diagnóstico específicos e de terapêutica dirigida, esta entidade é um desafio clínico, tanto no estabelecimento atempado do diagnóstico, como na abordagem terapêutica.
A lesão hepática induzida por fármacos é um diagnóstico de exclusão, necessitando de uma história clínica detalhada e pesquisa exaustiva de outras etiologias que justifiquem o quadro clínico.
Na classificação da lesão hepática induzida por fármacos é útil dividi-la em intrínseca e idiossincrásica. A primeira refere-se aos fármacos que são capazes de causar lesão hepática previsível em humanos ou modelos animais quando expostos a doses suficientemente elevadas. O paracetamol é o paradigma deste tipo de lesão. A lesão hepática idiossincrásica induzida por fármacos é menos frequente e menos previsível, afetando apenas indivíduos susceptíveis, sem relação com a dose e tem uma apresentação muito variável.1
Existem vários critérios a considerar no diagnóstico de lesão hepática induzida por fármacos. A primeira proposta foi feita num consenso de 1990
2 e tinha em conta a elevação de ALT ou Bilirrubina conjugada mais de duas vezes relativamente ao limite superior do normal (LSN). Desde então os critérios sofreram várias actualizações até às mais recentes publicadas em 2011
3 que definem a lesão hepática induzida por fármacos com o aumento de ALT > 3x LSN e aumento concomitante de bilirrubina total > 2 x LSN acompanhados de aumento de fosfatase alcalina > 2x LSN e aumento de GGT na ausência de doença óssea.
Quando estamos perante uma lesão hepática aguda, e em particular naquela induzida por fármacos, é útil classificar o padrão de lesão hepática em hepato-celular ou colestático, através da relação entre a ALT e a Fosfatase alcalina. Para tal, é importante calcular o valor R1:
VALOR R: ALT / LSN* ÷ FA/LSN*.
Hepatocelular (R > 5), misto (R=2 – 5) ou colestático (R < 2).
*LSN = limite superior do normal
A importância do cálculo do valor R prende-se com o estudo etiológico mais indicado a seguir no caso de uma lesão induzida por fármacos com um ou outro padrão.
Outra classificação relevante nos doentes com lesões hepáticas induzidas por fármacos é a aplicação da escala de mortalidade associada a esta lesão proposta por Hyman Zimmerman (Hy’s Law), que prevê uma mortalidade de 10% em doentes que cumpram os seguintes critérios: 1. ALT ou AST > 3 × LSN; 2. Bilirrubina total > 2 × LSN, sem colestase associada (elevação da fosfatase alcalina)1. É essencial a exclusão de outras causas para a elevação das transaminases e bilirrubina como hepatites víricas ou doença hepática concomitante.
Após a identificação do padrão de lesão hepática e a sua respectiva classificação é importante avaliar a relação causal entre a exposição ao fármaco e a lesão hepática. O fármaco tem, necessariamente, que ter sido administrado antes da lesão hepática, deve haver melhoria com a suspensão do mesmo e a nova exposição leva a novo agravamento.4
O tempo entre a administração do fármaco e o desenvolvimento de lesão hepática é muito variável, podendo ir de alguns dias até mais de um ano, tornando o estabelecimento de relação causal mais difícil. Para contornar este obstáculo é importante a consulta da literatura acerca dos fármacos potencialmente implicados, procurando-se descrição de lesão hepática associada ao consumo destes. 1,4
Para facilitar o diagnóstico de lesão hepática induzida por fármacos, na ausência de exames específicos, tornam-se úteis ferramentas de avaliação da probabilidade de lesão induzida por fármacos, como é o caso do score de causalidade RUCAM e o score de Maria & Victorino.5,6 Recentemente têm sido desenvolvidos novos biomarcadores de lesão hepática induzida por fármacos, mas ainda se encontram em fase de ensaios clínico. 7
Apesar de uma incidência reduzida (7,6:1 000 000 habitantes/ano), as hepatites tóxicas são uma causa frequente (até 25%) de falência hepática aguda com prognóstico reservado – estima-se em cerca de 12% a taxa de mortalidade por novos casos/ano.8
Alguns fatores podem estar associados a prognósticos desfavoráveis como o género feminino, doença hepática prévia, abuso de álcool, padrão de citólise predominante e alguns determinantes genéticos 4
CASO CLÍNICO
Apresenta-se o caso de uma doente do sexo feminino, de 48 anos, caucasiana, natural da Ucrânia com história pessoal de dor crónica lombo-sagrada em contexto de traumatismo, medicada com etoricoxib 60 mg em SOS. Sem outros antecedentes de relevo, sem hábitos tabágicos ou toxicofílicos, sem viagens recentes, transfusões sanguíneas, consumo recente de produtos de ervanária ou ingesta de cogumelos.
A doente apresentava-se assintomática até cerca de 3 dias antes do internamento, altura em que inicia quadro de mal-estar geral, náuseas e vómitos alimentares. No dia do internamento a doente refere icterícia cutânea e das escleróticas e colúria, motivo pelo qual recorre ao serviço de urgência.
A doente referia que havia tomado etoricoxib diariamente na dose de 60 mg durante uma semana cerca de 1 mês antes.
Na admissão ao exame objetivo a doente apresentava-se vigil, colaborante, orientada no espaço e no tempo, discurso coerente, hemodinamicamente estável, apirética (TT 37,1ºC), eupneica, com icterícia da pele e escleróticas, sem alterações à auscultação cardiopulmonar, abdómen com hepatomegália dolorosa à palpação profunda 3 cm abaixo do rebordo costal direito, superfície lisa, contornos regulares, sem esplenomegalia, Murphy vesicular negativo, membros inferiores sem alterações.
Analiticamente à admissão a doente apresentava alteração marcada das provas hepáticas com predomínio da citólise hepática (AST 2433 UI/L, ALT 4238 UI/L, LDH 691 UI/L, FA 208 UI/L, GGT 166 UI/L) e com um grau ligeiro de insuficiência hepática com INR 1,63, albumina 3,3 g/dL e hiperbilirrubinémia à custa da bilirrubina conjugada (Bilirrubina total 7,86 mg/dL), sem encefalopatia.
Calculando o valor R este é indicativo de padrão hepato-celular (> 5).
Ainda no Serviço de Urgência a realizaram-se serologias de hepatites virais A, B, C e E e VIH (negativas) e ecografia abdominal, que não mostrou alterações morfológicas hepato-biliares ou pancreáticas, nomeadamente sinais de patologia obstrutiva da via biliar.
A doente foi internada no serviço de Medicina Interna para estudo complementar do quadro de hepatite aguda com insuficiência hepática ligeira.
Do estudo laboratorial complementar para investigação etiológica da lesão hepática, destaca-se: eletroforese de proteínas séricas com ligeiro aumento das gama-globulinas (1,7%) mas com doseamento de imunoglobulinas normal; anticorpo antinuclear, anti-mitocondrial, anti-músculo liso, anti-citoplasma dos neutrófilos (PR3 e MPO), SLA/LP negativos; ceruloplasmina normal, cicatriz serológica de infecção a citomegalovírus, serologias para parvovírus B19, Epstein-Barr, Herpes simplex 1, herpes Varicela Zoster negativas.
Assim, foi excluída a etiologia vírica, autoimune e as doenças infiltrativas hepáticas, como a doença de Wilson.
Repetiu ecografia abdominal completada com estudo angio-tomografia computorizada que excluiu trombose do sistema porta ou outras lesões isquémicas hepáticas, excluindo-se assim, etiologia vascular.
Perante exclusão de outras causas de hepatite aguda, admitiu-se lesão hepática aguda tóxica tardia hepatocelular induzida pelo etoricoxib. Aplicando-se o score de causalidade RUCAM, obteve-se uma classificação de 7 pontos (anexo 1), e a aplicação do Score de Maria & Victorino de 9 pontos (anexo 2). Aplicando ainda o score prognóstico de Zimmerman, a doente apresentava uma probabilidade de morte de, pelo menos, 10%.
Durante o internamento a doente permaneceu clinicamente estável, sem agravamento do quadro de insuficiência hepática, nomeadamente sem sinais de encefalopatia hepática, com melhoria progressiva das alterações analíticas, principalmente dos parâmetros de citólise, sendo os valores máximos aqueles apresentados na admissão, motivo pelo qual não foi realizada biópsia hepática, (Tabela 1)
A evolução analítica dos valores de citólise hepática (AST e ALT) e dos parâmetros de função hepática (Bilirrubina total e INR) estão representados nos gráficos 1 e 2.
Tabela 1: evolução analítica de acordo com o tempo de internamento e tempo após suspensão do fármaco
Gráfico 1: evolução dos valores de AST e ALT durante o internamento e três meses após a alta (D90)
Gráfico 2: Evolução dos valores de bilirrubina total e INR durante o internamento e três meses após a alta (D90)
À data de alta, cerca de 6 semanas após a interrupção do fármaco, a doente apresentava os valores analíticos especificados na tabela 1.
Como se pode observar a doente apresentou uma evolução muito favorável da citólise hepática no período relativamente curto (7 dias), tornando assim mais claro o diagnóstico de lesão hepática induzida pelo Etoricoxib.
A doente manteve seguimento em consulta de Medicina Interna, tendo-se verificado uma normalização das provas hepáticas dois meses após o internamento (120 dias após a suspensão do fármaco). Os valores analíticos um mês após a alta estão representados na tabela 2.
Tabela 2: Valores analíticos um mês após a alta
DISCUSSÃO
A lesão hepática aguda induzida por fármacos, não sendo frequente, é uma causa importante de lesão hepática aguda, que deve ser sempre tida em conta em doentes que se apresentam com hepatite aguda, fazendo parte das etiologias a excluir no estudo da mesma. Assim, o seu diagnóstico exige um elevado índice de suspeição, que pode evitar a realização de exames complementares de diagnóstico desnecessários e invasivos em busca de diagnósticos mais raros.
Para o diagnóstico correto da lesão hepática induzida por fármacos é importante realizar uma história clínica detalhada de todos os fármacos com que o doente possa ter estado em contacto até um ano antes da instalação do quadro agudo.
A apresentação clínica da lesão hepática induzida por fármacos é semelhante à apresentação clínica das hepatites agudas de outras etiologias, podendo apresentar-se com cansaço, anorexia, astenia, icterícia, náuseas e vómitos, dor abdominal, febre ou ser assintomática, manifestando-se por alteração das provas hepáticas que pode ir desde uma ligeira elevação das transaminases até hepatites agudas fulminantes com insuficiência hepática grave e necessidade de transplante hepático.
O diagnóstico de lesão induzida por fármacos não apresenta testes específicos, sendo por isso essencial existir uma suspeita clínica, podendo esta ser auxiliada com os scores de probabilidade já apresentados no presente artigo. No nosso caso clínico, aplicando a escala de causalidade RUCAM obtivemos uma pontuação de 7, o que indica uma elevada probabilidade de o fármaco ser causador da lesão hepática (sendo que valores acima de 8 dariam uma probabilidade máxima).6
Quando aplicada a escala de Maria e Victorino, a pontuação é de 9 pontos, o que indica uma improbabilidade de ser o fármaco o causador da lesão hepática. No entanto, o principal fator que influencia a baixa pontuação na escala de Maria e Victorino é o facto de não existir descrição prévia de lesão hepática ao etoricoxib, mas existem casos descritos de lesão hepática ao celecoxib e ao rofecoxib, ambos da mesma classe farmacológica.5
A apresentação da lesão hepática induzida por fármacos é muito variável, bem como a sua gravidade. Agentes que tipicamente provocam hepatite aguda semelhante a hepatite vírica incluem isoniazida, pirazinamida, fenofibrato ou chás, nomeadamente chá verde.
O aspeto chave no diagnóstico de hepatite tóxica é a exclusão de outras causas, sendo que o padrão de lesão hepática pode ajudar nesta diferenciação.
No caso apresentado, após a exclusão de todas as causas de hepatite aguda (através de serologias virais, estudo auto-imune e exclusão de patologia das vias biliares), e existindo uma associação clara de consumo de um fármaco potencialmente hepato-tóxico e dada a melhoria clínica observada durante o internamento, optou-se por não realizarbiópsia hepática.
Não existe terapêutica dirigida para a lesão hepática induzida por fármacos, sendo sobretudo uma terapêutica de suporte e vigilância de eventuais complicações nomeadamente insuficiência hepática grave com encefalopatia hepática associada e por vezes com necessidade de transplante hepático.
Está bem documentada a associação entre os anti-inflamatórios não esteróides (AINE) e a lesão hepática, sendo que quase todos os fármacos desta classe apresentam casos reportados de lesão hepática, tipicamente hepato-celular e idiossincrásica, paradigmática da lesão induzida pelo Diclofenac.8
Os fármacos mais recentes desta classe, inibidores selectivos da ciclooxigenase-2 (COX-2) apresentam um perfil de segurança hepática superior aos AINE não selectivos. 9,10
Estão descritos na literatura, e referidos na base de dados livertox.com, casos de hepatotoxicidade com inibidores seletivos da COX-2 como o Celecoxib e o Rofecoxib.
11,12,13 De acordo com os casos descritos, a toxicidade hepática destes fármacos é tipicamente hepato-celular com histologia com necrose em ponte e hepatite de interface, que levam a concluir que o mecanismo de lesão é provavelmente imuno-mediado, sendo uma reação do tipo alérgico. Estas reações são tipicamente do tipo tardio (> 90 dias), como decorreu no nosso caso e são idiossincráticas, não sendo dose dependentes.
14 Embora a alteração das provas hepáticas seja um dos efeitos adversos descritos para o etoricoxib no Resumo das Características do Medicamento (RCM), não existem na base de dados
Livertox descrição de casos de hepatotoxicidade ao Etoricoxib. Da revisão das bases de dados da Pubmed (Medline) e SCIELO estão presentes apenas dois estudos com referência a efeitos adversos hepáticos do Etoricoxib e nenhum caso reportado de lesão hepática induzida pelo mesmo. O estudo MEDAL, desenhado para comparar os efeitos adversos do diclofenac comparados com os do Etoricoxib, incluiu 17412 doentes sob terapêutica com etoricoxib. Neste estudo observou-se apenas um caso lesão hepática com ALT ou AST > 3xN e bilirrubina >2xN com exclusão de outras causas que justificassem o quadro clínico, sem necessidade de internamento.
16 O estudo EDGE teve como objectivo a avaliar os efeitos adversos gastrintestinais em doentes sob diclofenac e compará-los com doentes sob etoricoxib. Foram incluídos 7111 doentes, 3593 sob etoricoxib. Foram identificados 35 casos de elevação da ALT em doentes sob etoricoxib, todos com bilirrubina normal, não cumprindo critérios de lesão hepática induzida por fármacos.
17 Relativamente aos outros fármacos desta classe, nomeadamente o Celecoxib, uma análise de 41 estudos randomizados demonstrou uma toxicidade hepática sobreponível ao placebo e inferior a outros anti-inflamatórios como o diclofenac. Nesta análise foram referidas apenas alterações ligeiras das provas hepáticas e sem insuficiência hepática associada.
18 No entanto, existem casos descritos na literatura de lesão hepática induzida por Celecoxib.
11,12,13O inibidor COX-2 Rofecoxib foi retirado do mercado por toxicidade cardíaca, mas existem também casos reportados de toxicidade hepática com este fármaco.
12,14Em conclusão podemos assumir a baixa toxicidade hepática dos AINE selectivos para a COX-2. No entanto, esta classe não é isenta de risco hepático. Este caso reflecte a toxicidade hepática ao etoricoxib, ainda não descrita desta forma na literatura e que vai ao encontro da toxicidade que, apesar de rara, está descrita para os outros elementos desta classe farmacológica.
Quadro I
Evolução analítica de acordo com o tempo de internamento e tempo após suspensão do fármaco
| | | | | |
| Dia de internamento | Tempo após suspensão do fármaco | ALT (UI/L) | Fosfatase Alcalina (UI/L) | Bilirubina (mg/dL) |
| 1 | 4 semanas | 3645 | 71 | 7.6 |
| 3 | 4 semanas | 2637 | 114 | 10.3 |
| 4 | 4 semanas | 2490 | 137 | 7.3 |
| 5 | 4 semanas | 1339 | 113 | 4.2 |
| 7 | 5 semanas | 821 | 104 | 2.1 |
| 15 | 6 semanas | 108 | 80 | 1.6 |
| 90 | 4 meses | 18 | 64 | 1.0 |
Quadro II
Avaliação analítica um mês após a alta
| | |
| | |
| INR | 1.0 |
| Bilirrubina total | 0.25 mg/dL |
| GGT | 30 UI/L |
| Fosfatase alcalina | 100 UI/L |
| AST / ALT | 18 / 10 mg/dL |
Figura I
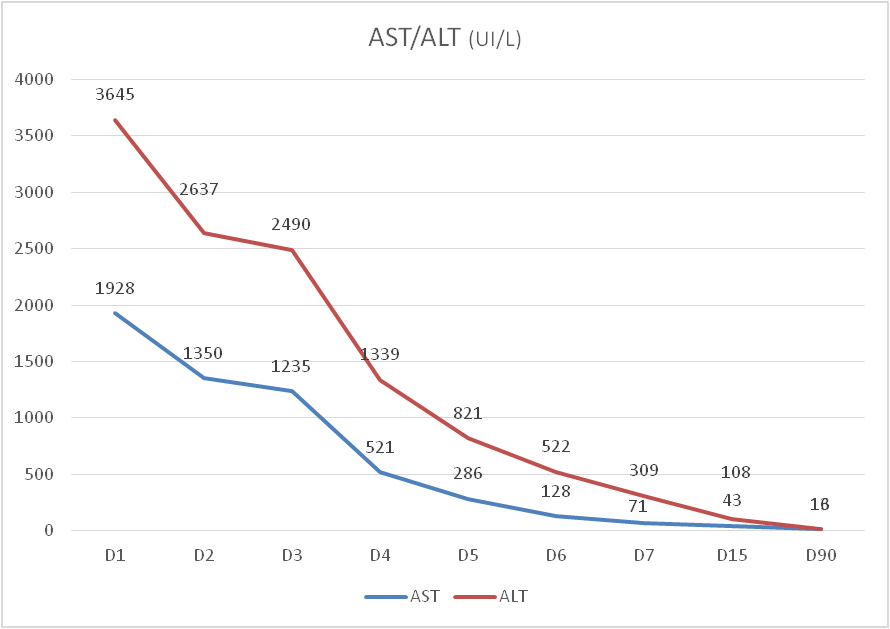
Gráfico 1: evolução dos valores de AST e ALT durante o internamento e três meses após a alta (D90)
Figura II
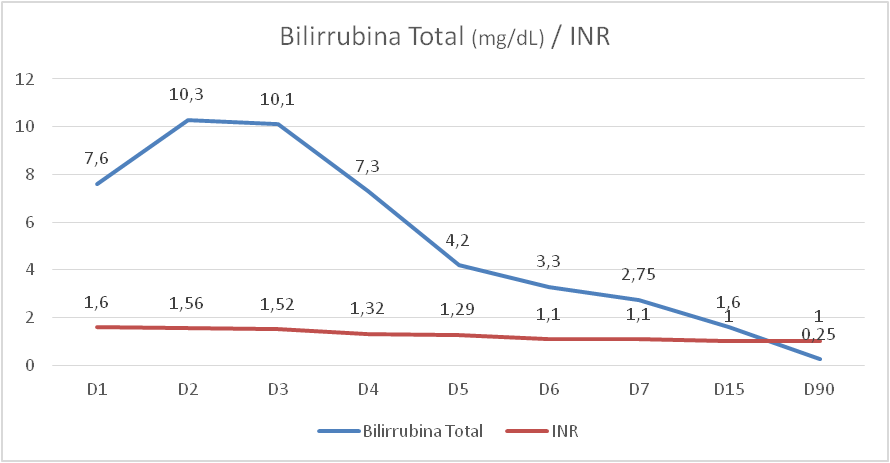
Gráfico 2: Evolução dos valores de bilirrubina total e INR durante o internamento e três meses após a alta (D90)
BIBLIOGRAFIA
1- Chalasani, Naga P., et al. ´ACG Clinical Guideline: The Diagnosis and Management of Idiosyncratic Drug-Induced Liver Injury.´ The American journal of gastroenterology 109.7 (2014): 950-966.
2 - Benichou, C. ´Criteria of drug-induced liver disorders. Report of an international consensus meeting.´ Journal of hepatology 11.2 (1990): 272-276.
3 – Aithal, G. P., et al. ´Case definition and phenotype standardization in drug‐induced liver injury.´ Clinical Pharmacology & Therapeutics 89.6 (2011): 806-815.
4- Marrone G, Vaccaro F. G, Biolato M, Miele L, Liguori A, Araneo C, Grieco A. Drug-induced liver injury 2017: the diagnosis is not easy but always to keep in mind. Eur Rev Med Pharmacol (2017) Sci, 21(1 Suppl), 122-134.
8 - Matos, Luís Costa, and Borges Martins. ´Hepatites tóxicas: revisão da literatura Toxic hepatitis: literature review´ Revista Portuguesa de Medicina Interna (2005) Vol.12, Nº 4.
5- Maria VA , Victorino RM . Development and validation of a clinical scale for the diagnosis of drug-induced hepatitis . Hepatology 1997 ; 26 : 664 – 9
6- Danan G , Benichou C . Causality assessment of adverse reactions to drugs — I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries . J Clin Epidemiol 1993 ; 46 : 1323 – 30
7 - Ozer, Josef, et al. ´The current state of serum biomarkers of hepatotoxicity.´ Toxicology 245.3 (2008): 194-205.
8 - Agúndez, José AG, et al. ´Assessment of nonsteroidal anti-inflammatory drug-induced hepatotoxicity.´ Expert opinion on drug metabolism & toxicology 7.7 (2011): 817-828.
9 - Bessone, Fernando. ´Non-steroidal anti-inflammatory drugs: What is the actual risk of liver damage?.´ World Journal of Gastroenterology: WJG 16.45 (2010): 5651.
10 - Bessone, Fernando, et al. ´Hepatotoxicity induced by coxibs: how concerned should we be?.´ Expert opinion on drug safety 15.11 (2016): 1463-1475.
11- Galan, Mark V., Stuart C. Gordon, and Ann L. Silverman. ´Celecoxib-induced cholestatic hepatitis.´ Annals of internal medicine 134.3 (2001): 254-254.
12 – Papachristou, Georgios I., Anthony J. Demetris, and Mordechai Rabinovitz. ´CASE REPORT: Acute Cholestatic Hepatitis Associated with Long-Term Use of Rofecoxib´ Digestive diseases and sciences 49.3 (2004): 459-461.
13 - Grieco, Antonio, et al. ´Acute cholestatic hepatitis associated with celecoxib.´ Annals of Pharmacotherapy 36.12 (2002): 1887-1889.
14 - Yan, Brian, et al. ´Rofecoxib-induced hepatotoxicity: a forgotten complication of the coxibs.´ Canadian Journal of Gastroenterology and Hepatology 20.5 (2006): 351-355.
15 - Pandit, Aashish, Tarun Sachdeva, and Pallavi Bafna. ´Drug-induced hepatotoxicity: a review.´ J Appl Pharm Sci 2.5 (2012): 233-243.
16 - Laine, Loren, et al. ´How Common Is Diclofenac-Associated Liver Injury? Analysis of 17,289 Arthritis Patients in a Long-Term Prospective Clinical Trial.´ The American journal of gastroenterology 104.2 (2009): 356-362.
17 - Baraf, Herbert SB, et al. ´Gastrointestinal side effects of etoricoxib in patients with osteoarthritis: results of the Etoricoxib versus Diclofenac Sodium Gastrointestinal Tolerability and Effectiveness (EDGE) trial.´ The Journal of rheumatology 34.2 (2007): 408-420.
18 - Soni, Paresh, et al. ´The hepatic safety and tolerability of the cyclooxygenase-2 selective NSAID celecoxib: pooled analysis of 41 randomized controlled trials.´ Current medical research and opinion 25.8 (2009): 1841-1851.



