INTRODUÇÃO:
Segundo as últimas recomendações da Neurocritical Care Society, o estado de mal epilético pode ser definido como presença de mais de 5 minutos de atividade epilética clínica e/ou eletrográfica contínua ou de atividade epilética recorrente sem recuperação entre crises. Pode ser considerado refratário quando não há resposta eficaz após administração de uma benzodiazepina seguida de um segundo fármaco anticonvulsivante1.
O estado de mal é relativamente frequente não só a nível do Serviço de Urgência (SU) mas também em Unidade de Cuidados Intensivos (UCI). É uma entidade emergente e, portanto, determinante a sua identificação e rápido tratamento pelo impacto na morbilidade e mortalidade do doente. As possibilidades etiológicas são variadas, sendo um verdadeiro desafio em termos de marcha diagnóstica e terapêutica. Apenas em metade dos doentes com estado de mal é possível identificar a sua etiologia, predominando a encefalite de causa autoimune2.
No presente artigo descreve-se o caso de uma doente internada numa UCI por quadro de estado de mal epilético refratário, com necessidade de sedoanalgesia em perfusão contínua. Do estudo concluiu tratar-se de Encefalopatia de Hashimoto, uma entidade autoimune rara e frequentemente subdiagnosticada, caraterizada por encefalopatia aguda ou subaguda com alterações cognitivas ou psiquiátricas e frequentemente associada a atividade epilética, mas que muito raramente se manifesta na forma de mal epilético3. Além do quadro clínico sugestivo carateriza-se ainda pela presença de anticorpos anti-tiroideus e resposta geralmente favorável à instituição de corticoterapia4.
CASO CLÍNICO:
Mulher de 70 anos, previamente autónoma, com história de hipertensão essencial e depressão. Admitida no SU após síncope presenciada, sem pródromos ou outra sintomatologia. Durante o período que permaneceu no SU constataram-se múltiplos episódios de ausência, com afasia e mioclonias palpebrais. O estudo analítico e a TC-crânio-encefálica não revelaram alterações. Após observação por Neurologia, realizou punção lombar que mostrou pleiocitose (6,4 células/mm3) e proteinorráquia (73mg/dl) com glicorráquia normal, e efetuou eletroencefalograma (EEG) que documentou crise eletroclínica com início fronto-temporal direito, abundante e prolongada, traduzida por alteração da relação com o meio, não verbalização e pestanejo (Fig. 1). Iniciou aciclovir para cobertura de eventual meningite herpética e instituiu-se de forma seriada fenitoína, valproato de sódio e levetiracetam mantendo, contudo, mioclonias palpebrais. Admitiu-se estado de mal epilético parcial refratário, sendo transferida para a UCI para melhor monitorização. À admissão na UCI, apresentava-se apirética e hemodinamicamente estável, desorientada e confusa, e com persistência das mioclonias. Repetiu EEG que se revelou sobreponível. Neste contexto iniciou sedoanalgesia com midazolam e propofol, com cedência das crises, e procedeu-se a entubação orotraqueal para proteção da via aérea, ficando conectada ao ventilador. Com a colaboração de Neurologia, ajustou-se a terapêutica anticonvulsivante e suspendeu-se gradualmente a sedação, e procedeu-se ao estudo etiológico do estado de mal.
Dos exames efetuados salienta-se:
- Analiticamente sem alterações, nomeadamente sem elevação dos parâmetros inflamatórios, distúrbios eletrolíticos ou alterações metabólicas, designadamente da glicémia, funções renal e tiroideia; o screening toxicológico foi negativo;
- Etiologia estrutural: realizou TC-CE, sem alterações, bem como RM-CE que revelou alterações inespecíficas, com múltiplos focos de hipersinal da substância branca periventricular, coroas radiárias e subcortical bilateralmente;
- Etiologia infeciosa: o estudo sérico foi negativo para pesquisa de PCR de herpesvírus (HSV1, HSV2, CMV, EBV), bem como VDRL e serologias para hepatites virais, VIH e Borrelia. O estudo do líquor foi negativo para exame cultural, micológico, micobacteriológico e pesquisa de herpesvírus (HSV1, HSV2, HZV, EBV, CMV, HHV6, HHV8);
- Etiologia paraneoplásica: marcadores tumorais negativos (B2-microglobulina, alfa-fetoproteína, CEA, CA 125, CA 15.3, CA 19.9, CA 72.4); realizou TC-toraco-abdomino-pélvica que não mostrou lesões ocultas nem adenopatias patológicas;
- Etiologia autoimune (Tabela 1): pedido doseamento de anticorpos séricos e no líquor, salientando-se positividade para anticorpos anti-tiroideus - anti-tiroglobulina 289,78 UI/ml (referência<4,1) e anti-peroxidase 10,42 UI/ml (referência<5,6). O anticorpo anti-células parietais foi também positivo.
Admitindo-se diagnóstico de Encefalopatia de Hashimoto a doente iniciou corticoterapia (pulsos de metilprednisolona 1g IV durante 5 dias, e manutenção com metilprednisolona IV 1mg/kg/dia), com visível recuperação neurológica em 24-48h e que possibilitou a extubação após 5 dias de terapêutica. Realizou ecografia tiroideia que mostrou parênquima difusamente heterogéneo compatível com tiroidite, e EEG de controlo que revelou lentificação difusa da eletrogénese ligeira a moderada, com atividade lenta fronto-temporal direita mas sem caráter rítmico nem atividade paroxística (Fig. 2). Após 21 dias de internamento, complicado por intercorrências infeciosas, foi transferida para o hospital da área de residência sob terapêutica com fenitoína e prednisolona 40mg 12-12h. A doente manteve seguimento em consulta e o follow-up aos 6 meses mostrou evolução clínica favorável, com recuperação do estado habitual, tendo iniciado desmame de corticoterapia.
DISCUSSÃO:
A Encefalopatia de Hashimoto (também designada por encefalopatia responsiva a corticoides associada a tiroidite autoimune, SREAT, ou meningoencefalite inflamatória autoimune não-vasculítica) é uma entidade clínica rara, relatada pela primeira vez em 19664 e com um número diminuto de casos descritos desde então5-10. Carateriza-se por uma encefalopatia com início agudo ou subagudo associada a alteração do estado de consciência e confusão. Embora a sua etiologia não esteja completamente esclarecida, acredita-se que o mecanismo seja autoimune, com provável deposição de complexos imunes e processos de vasculite com consequente disrupção da microvasculatura cerebral5,8. Para o diagnóstico a presença de anticorpos anti-tiroideus é necessária, contudo, uma eventual relação com a tiroidite de Hashimoto ainda não está estabelecida5,6.
Esta patologia é extremamente rara, com uma prevalência de 2,1:100.000 indivíduos, mas que se admite poder estar subdiagnosticada. O sexo feminino é o mais afetado (relação de 4:1) e, embora a faixa etária seja variável, a maioria dos doentes apresenta idades compreendidas entre os 45-55 anos aquando do diagnóstico5,8,10.
A Encefalopatia de Hashimoto pode apresentar uma evolução progressiva, ser auto-limitada ou alternar entre períodos de doença e remissão. Como referido, carateriza-se essencialmente por confusão e alteração do estado de consciência, podendo assumir 2 formas de apresentação: aguda, com episódios recorrentes e frequentes, “stroke-like” e com défices neurológicos focais, ou apresentação mais progressiva e insidiosa, com deterioração cognitiva e evolução para demência5,8,10. É de salientar que está frequentemente associada a atividade convulsiva, sobretudo crises tónico-clónicas generalizadas (2/3 dos casos) ou mioclonias, porém, mais raramente, pode manifestar-se na forma de estado de mal (12%)5,6, tal como sucedeu com a doente do caso descrito.
O diagnóstico de Encefalopatia de Hashimoto é geralmente feito quando, além da presença de quadro sugestivo, existe elevação de anticorpos anti-tiroideus e resposta favorável à instituição de corticoterapia. A exclusão de outras etiologias deve ser igualmente considerada aquando da marcha diagnóstica5,8,10. Ainda que a positividade dos anticorpos anti-tiroideus seja necessária, o seu papel não está claro e a sua presença não determina necessariamente o desenvolvimento desta patologia. Curiosamente, e ao contrário da Tiroidite de Hashimoto, a sua concentração não se correlaciona com a gravidade da doença nem com a resposta à terapêutica5,10. Poderá ser útil determinar a coexistência de outras patologias autoimunes, tal como a anemia perniciosa, sugerida neste caso pela presença de anticorpos anti-células parietais.
O doseamento das hormonas tiroideias deve ser efetuado, embora a maioria dos doentes se encontre em eutiroidismo5,8-10. Outros exames são tipicamente pouco informativos, destinando-se essencialmente a excluir outras etiologias. O líquor apresenta-se alterado em cerca de 80% dos casos, com alterações inflamatórias inespecíficas, sobretudo pleiocitose e hiperproteinorráquia5. O EEG deve ser requisitado, evidenciando frequentemente atividade basal lenta e atividade epilética transitória. A RM-CE ocasionalmente pode revelar atrofia cerebral e alterações inespecíficas subcorticais5,6,9,10.
A terapêutica da Encefalopatia de Hashimoto assenta essencialmente na administração de corticoterapia, eficaz na grande maioria dos casos9. Pela escassez de casos relatados, a dosagem e tipo de corticóide preferencial ainda não estão bem estabelecidos, contudo, tem sido descrita a administração de metilprednisolona ev (500-1000mg/dia) e de prednisolona oral (1-2mg/kg/dia) com resultados favoráveis7-9,11. Geralmente a resposta é rápida e ocorre em poucos dias a semanas após início da terapêutica. A duração e desmame não estão bem definidos, devendo ser equacionados consoante a resposta clínica e podendo prolongar-se por meses ou anos5,7-9. Como alternativa à corticoterapia, em situações refratárias ou de intolerância, podem ser utilizados imunossupressores, como a azatioprina, ciclofosfamida ou metotrexato. Também parece haver benefício na utilização de imunoglobulina IV mas, no que concerne à plasmaferese, os estudos são contraditórios11. Finalmente, deve considerar-se terapêutica anticonvulsivante se houver presença de atividade epilética electroclínica, embora a sua resolução ocorra frequentemente após introdução da corticoterapia5,7,8,10.
O prognóstico dos doentes é globalmente favorável, mesmo naqueles em que o diagnóstico é efetuado tardiamente, sendo que nestes a recuperação cognitiva pode ficar comprometida. Na maioria dos doentes é possível proceder ao desmame e suspensão da corticoterapia, com remissão da doença. Mais raramente poderá ser necessário manter ou reiniciar corticoterapia ou associar terapêutica imunossupressora5,8-10.
Embora rara e com uma evolução frequentemente favorável, a Encefalopatia de Hashimoto pode ser um diagnóstico desafiante e cursar com apresentações graves. Num estudo retrospetivo, por Chaigne et al, verificou-se que, durante 12 anos, foram admitidos apenas 8 casos de Encefalopatia de Hashimoto numa UCI francesa, contudo, 5 dos quais com estado de mal epilético e 6 que necessitaram de ventilação invasiva12. Assim, pode-se concluir que estes doentes podem ocasionalmente necessitar de cuidados mais diferenciados prestados numa UCI, pelo que é fundamental que o intensivista e internista estejam alertas para esta entidade, de forma a reconhecê-la rapidamente e abordá-la de forma eficaz.Quadro I
Resultados do estudo de etiologia autoimune.
| RESULTADO | REFERÊNCIA | |
| 1- ANTICORPOS ANTI-TIROIDEUS (séricos) | ||
| - Anti-peroxidase (TPO) | POSITIVO 10,4 UI/ml | <5,61 UI/ml |
| - Anti-tiroglobulina (ATG) | POSITIVO 289,78 UI/ml | <4,11 UI/ml |
| - Anti-receptor TSH (TRABs) | Negativo | - |
| 2- ANTICORPOS ASSOCIADOS A ENCEFALITE | ||
| - Contra antigénios da superfície celular - líquor (anti-NMDA, AMPA, GABA-B, LGI1, Caspr2) | Negativos | - |
| - Anti-neuronais/ proteínas intracelulares - séricos (anti-Hu, Yo, Ri, anfifisina, CV2.1, PNMA2) | Negativos | - |
| 3- ANTICORPOS ASSOCIADOS A NEUROPATIAS/NEURITE | ||
| - Anti-gangliosídeos e anti-sulfatídeos (séricos) | Negativos | - |
| - Anti-MAG (sérico) | Negativo | - |
| - Anti-NMO/aquaporina 4 (sérico e líquor) | Negativos | - |
| 4- OUTROS ANTICORPOS (séricos) | ||
| - Anti-células parietais | POSITIVO | - |
| - ANA, anti-dsDNA | Negativos | - |
| - Anti-SSA, anti-SSB | Negativos | - |
| - Anti-RNP, anti-Sm | Negativos | - |
| - Fator reumatóide | Negativo | - |
| - Anti-mitocôndria (AMA) | Negativo | - |
| - Anti-citosol 1 | Negativo | - |
TPO- antiperoxidase; ATG- antitiroglobulina; TSH- tiroestimulina; TRAB- anti-receptor TSH; NMDA- N-metil D-Aspartato; AMPA- Ácido alfa-Amino-3-hidroxi-5-metil-4-isoxazolpropiónico; GABA- Ácido gama-aminobutírico; LGI1- proteína inativada 1 de glioma rico em leucina; Caspr2- proteína 2 associada à contactina; CV2.1- proteína 2 mediadora da resposta à colapsina; PNMA2- antigénio paraneoplásico Ma; MAG- glicoproteína associada à mielina; NMO- neuromielite optica; ANA- anticorpo antinuclear; Anti-SSA- anticorpo anti-síndrome Sjögren tipo A; anti-SSB- anticorpo anti-síndrome Sjögren tipo B.
Figura I
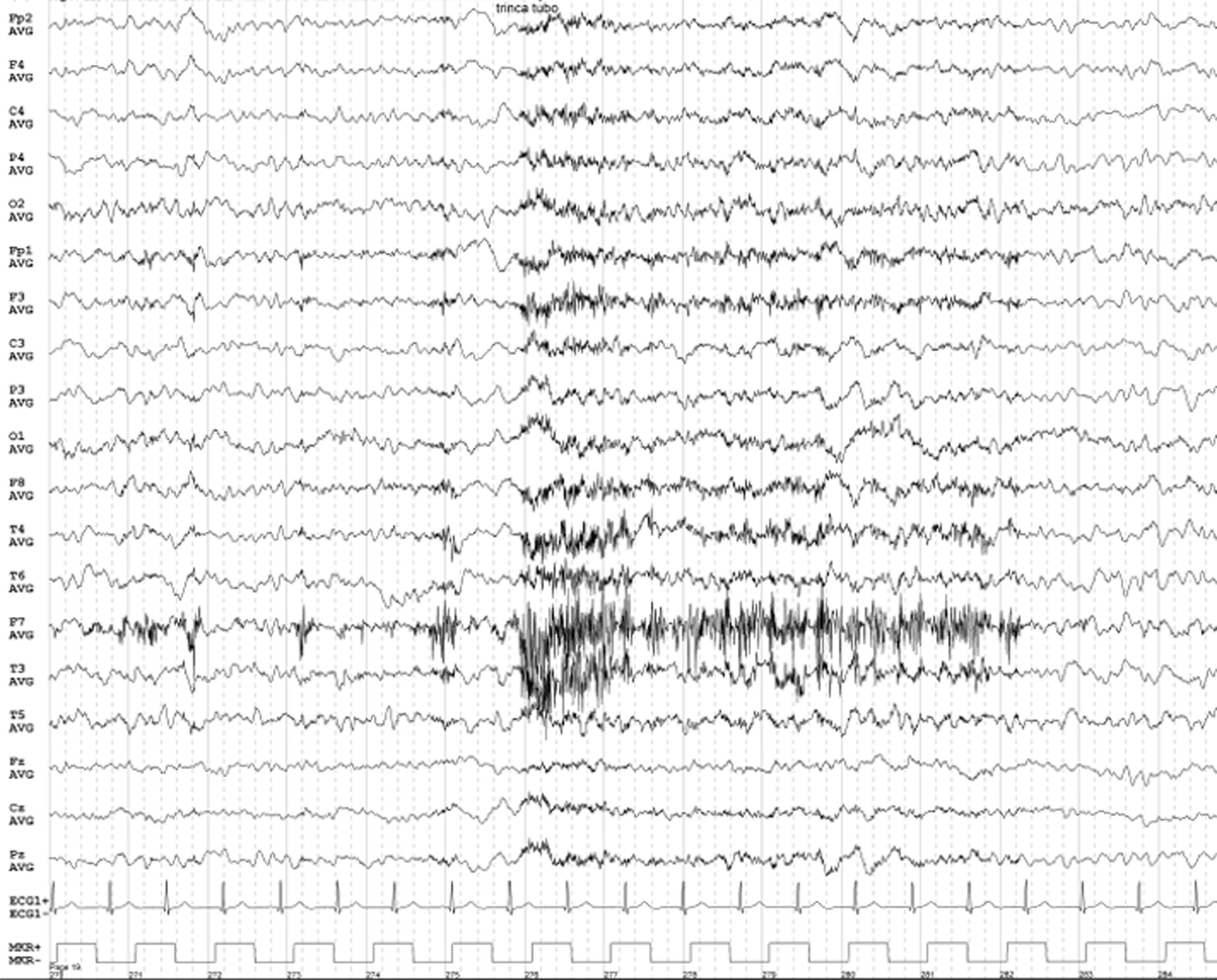
Segmento do eletroencefalograma realizado antes da corticoterapia, revelando crise electroclínica com início frontotemporal direita, prolongada e autolimitada, compatível com estado de mal epilético.
Figura II
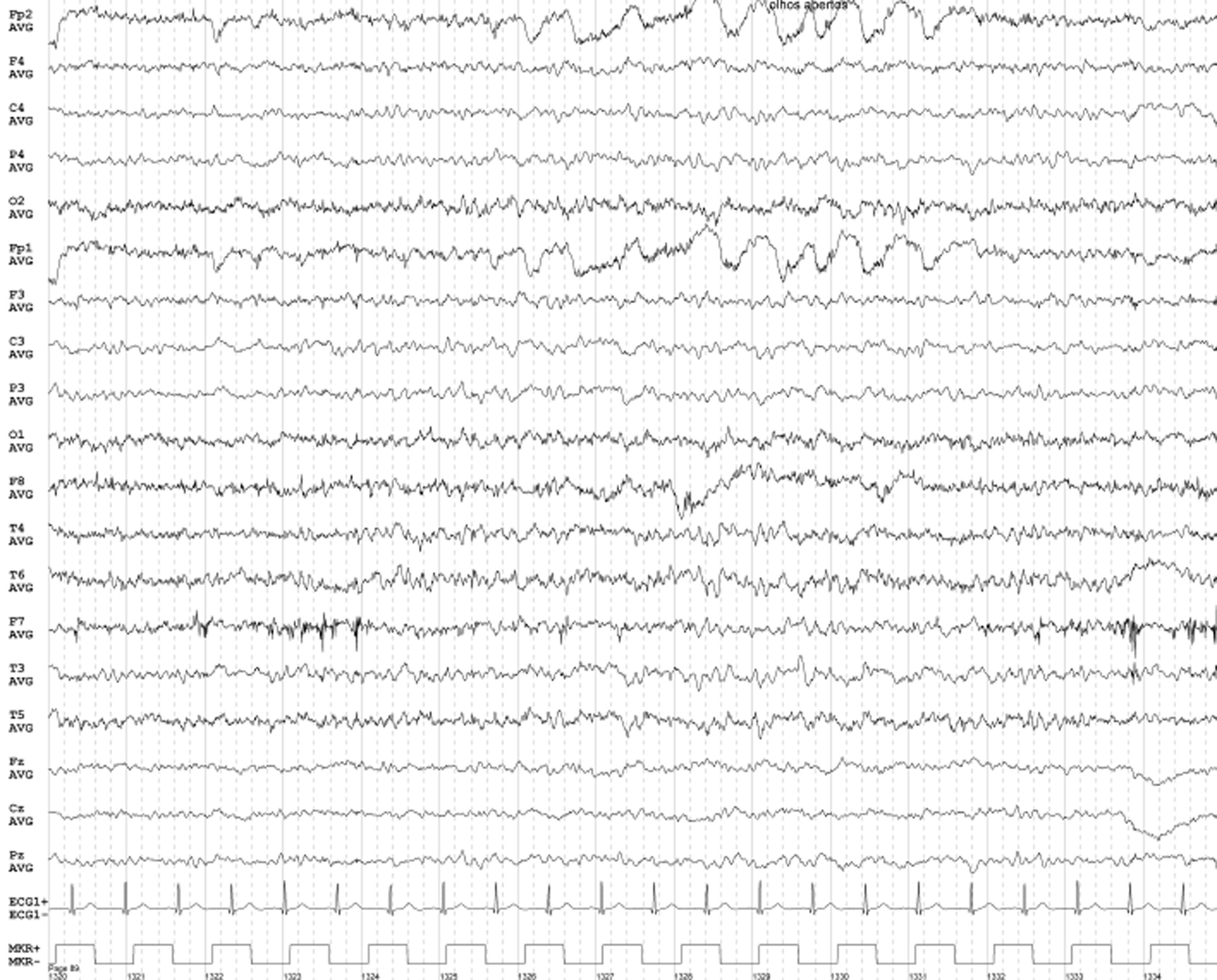
Segmento do eletroencefalograma realizado após corticoterapia, revelando lentificação difusa da eletrogénese com atividade lenta pouco frequente frontotemporal direita sem caráter rítmico ou atividade paroxística.
BIBLIOGRAFIA
1- Brophy GM, Bell R, Claassen J, Alldredge B, Bleck TP, Glauser T, et al. Guidelines for the evaluation and management of status epilepticus. Neurocrit Care. 2012;17(1):3–23.
2- Gaspard N, Foreman BP, Alvarez V, Cabrera Kang C, Probasco JC, Jongeling Emma Meyers AC, et al. New-onset refractory status epilepticus: Etiology, clinical features, and outcome. Neurology. 2015;85(18):1604–13.
3- Doe De Maindreville A, Gombert C, Thiriaux A, Chaunu M, Bakchine S. Encéphalopathie de Hashimoto: Une cause rare d’état de mal épileptique. Rev Neurol (Paris). 2013;169(4):345–9.
4- Brain L,Jellinek EH, Ball K. Hashimoto´s disease and encephalopathy. Lancet. 1966;2(7462):512-14.
5- Rubin DI. Hashimoto encephalopathy [Internet]. 2017 [cited 2018 Sep 30]. Available from: https://www.uptodate.com/contents/hashimoto-encephalopathy?source=search _result&search =encefalopatia hashimoto&selectedTitle=1~13
6- Chong JY, Rowland LP, Utiger RD. Hashimoto Encephalopathy: Syndrome or Myth? Arch Neurol. 2003;60(2):164–171
7- Olmez I, Moses H, Sriram S, Kirshner H, Lagrange AH, Pawate S. Diagnostic and therapeutic aspects of Hashimoto’s encephalopathy. J Neurol Sci. 2013;331(1–2):67–71.
8- Montagna G, Imperiali M, Agazzi P, D’Aurizio F, Tozzoli R, Feldt-Rasmussen U, et al. Hashimoto’s encephalopathy: A rare proteiform disorder. Autoimmun Rev. 2016;15(5):466–76.
9- Laurent C, Capron J, Quillerou B, Thomas G, Alamowitch S, Fain O, et al. Steroid-responsive encephalopathy associated with autoimmune thyroiditis (SREAT): Characteristics, treatment and outcome in 251 cases from the literature. Autoimmun Rev. 2016;15(12):1129–33.
10- Zhou JY, Xu B, Lopes J, Blamoun J, Li L. Hashimoto encephalopathy: literature review. Acta Neurol Scand. 2017;135(3):285–90.
11- Cook MK, Malkin M, Karafin MS. The use of plasma exchange in Hashimoto’s encephalopathy: A case report and review of the literature. J Clin Apher. 2015;30(3):188–92.
12- Chaigne B, Mercier E, Garot D, Legras A, Dequin PF, Perrotin D. Hashimoto’s encephalopathy in the intensive care unit. Neurocrit Care. 2013;18(3):386–90.
