Introdução:
O ateroembolismo ou doença ateroembólica consiste na embolização sistémica, através da circulação arterial, de cristais de colesterol, após rotura de placas de ateroma1-5. O trauma intravascular secundário a procedimentos endovasculares é a principal causa. Menos frequentemente, resulta do uso de fibrinolíticos ou anticoagulantes, na medida em que estas terapêuticas podem limitar a regeneração das placas de ateroma ulceradas1-4,6,7. As manifestações clínicas dependem dos órgãos lesados, podendo cursar com disfunção renal, por oclusão das artérias, arteríolas e capilares glomerulares renais por placas de ateroma e êmbolos de colesterol. A lesão renal ateroembólica apresenta tipicamente instalação aguda ou subaguda, alternando entre períodos de estabilização e de agravamento, e o diagnóstico é sugerido pela presença da tríade clássica (evento precipitante, lesão renal aguda/subaguda e alterações cutâneas), sendo a confirmação definitiva obtida por biópsia renal1-2. Embora raro, o ateroembolismo é mais provável em doentes idosos, com aterosclerose difusa e múltiplas comorbilidades que, por si só, podem justificar a insuficiência renal, tornando-a uma patologia subdiagnosticada1,3,4,6,7.
A fibrinólise, quando possível, é a abordagem preferencial no acidente vascular cerebral (AVC) isquémico. Ainda que a sua utilização seja comum em contexto hospitalar, não está completamente isenta de riscos, sendo o ateroembolismo uma consequência rara e que pode ocorrer de poucas horas até 2 meses após esta terapêutica8,9.
Caso Clínico:
Apresentamos o caso de um homem de 79 anos, caucasiano, com antecedentes de doença aterosclerótica generalizada, submetido previamente a bypass aortofemoral esquerdo e endarterectomia carotídea esquerda, e múltiplos fatores de risco cardiovascular não medicados (hipertensão, dislipidémia e tabagismo ativo). Foi admitido no Serviço de Urgência por quadro com instalação súbita de hemiparésia esquerda, parésia facial central homolateral e disartria. Após ativação da via verde de AVC realizou estudo imagiológico que documentou enfarte agudo da coroa radiária e núcleo caudado direito, múltiplos enfartes não recentes e infiltração ateromatosa dos troncos supra-aórticos e estenose aterosclerótica da artéria basilar. Foi submetido a fibrinólise (rt-PA 0,9mg/Kg para peso estimado de 75Kg), sem complicações, e foi admitido na Unidade Cérebro-Vascular, sendo medicado com estatina, antiagregação e enoxaparina profilática (40mg/dia). Não apresentava alterações analíticas de relevo, incluindo função renal normal (creatinina sérica-0,98mg/dL; taxa de filtração glomerular>60ml/min/1.732). Do estudo etiológico salientou-se apenas, no eco-doppler, presença de infiltração ateromatosa e múltiplas placas de ateroma regulares das artérias carotídeas. O doente foi posteriormente transferido para a enfermaria de Medicina Interna, tendo-se o internamento prolongado por múltiplas intercorrências:
- Infeções respiratórias, a condicionar vários ciclos de antibioterapia (amoxicilina/clavulanato, piperacilina/tazobactam, meropenem, linezolide) e, por duas vezes, a necessitar de ventilação mecânica e passagem por Unidade de Cuidados Intensivos;
- Episódios de fibrilhação auricular, que motivaram ajuste de enoxaparina para dose terapêutica (80mg 12-12h) e cardioversão química, mantendo-se em ritmo sinusal;
- Derrame pleural esquerdo, drenado por duas ocasiões, com líquido compatível com transudado e exames microbiológico e citológico negativos; salienta-se a presença de abundantes eritrócitos (punção não traumática) e de colesterol (66mg/dL; referência<60);
Durante o internamento assistiu-se ainda à instalação de insuficiência renal subaguda, com agravamento progressivo a partir da segunda semana, alternando entre períodos de estabilização com outros de maior agravamento, até creatinina de 5,8mg/dL (Fig.1).
Para o estudo da lesão renal realçamos:
- Analiticamente - eosinofilia autolimitada durante a terceira semana de internamento (entre 620 e 980/µL; referência: 0-600/µL). O restante estudo não revelou alterações: serologias infeciosas (vírus da imunodeficiência humana e Ebstein-Barr, hepatites virais B e C, citomegalovírus); anticorpos antinucleares (ANA), anti-citoplasma de neutrófilo (ANCA) e anti-membrana basal (GBM); complemento C3 e C4, crioglobulinas, imunoglobulinas, cadeias leves e imunofixação;
- Sedimento urinário - proteinúria (50mg/dL), leucocitúria (41células/campo), eritrocitúria (251/campo), escassas células epiteliais e cilindros. Urina-24h com proteinúria 450mg. Urocultura estéril;
- Ecografia renal - rins normodimensionados, de contornos regulares e ligeira redução da diferenciação parênquimo-sinusal. Estudo Doppler revelou artérias renais patentes;
- Biópsia renal - amostra constituída por 20 glomérulos, metade dos quais globalmente esclerosados por isquémia e os restantes com alterações isquémicas moderadas (Fig.2). 70% dos túbulos apresentavam-se atróficos e 30% em necrose tubular aguda (Fig.3). Todas as artérias estavam gravemente lesadas. As de pequeno calibre apresentavam espessamento da íntima e as de médio calibre exibiam duplicação da lâmina elástica interna e hipertrofia fibrótica da íntima (Fig.4). Observou-se uma fenda de cristais de colesterol no lúmen de uma artéria interlobular, sem eritrócitos ou fibrina (Fig.5). A imunofluorescência foi negativa. As alterações foram compatíveis com necrose tubular aguda e doença ateroembólica renal.
O doente apresentou escassa resposta à instituição de fluidoterapia e, mesmo com otimização dos fatores de risco cardiovascular e suspensão da anticoagulação, manteve deterioração renal, culminando na necessidade de terapêutica dialítica. À data da alta clínica, após 3 meses de internamento, o doente apresentava hemiparésia esquerda ligeira com necessidade de assistência pontual (grau 2 na Escala de Rankin modificada) e foi encaminhado para programa de hemodiálise em ambulatório. À reavaliação, 6 meses depois, mantinha dependência dialítica.
Discussão:
Neste doente verificou-se instalação progressiva de lesão renal, que admitimos ser de etiologia multifatorial. Além das intercorrências infeciosas, ciclos de antibioterapia, exames de imagem contrastados e hipertensão arterial, que provavelmente tiveram contributo na disfunção renal, consideramos que a doença ateroembólica renal surge como a principal etiologia deste caso.
A necrose tubular aguda, confirmada na biópsia, e que provavelmente resultou do contexto de sépsis, contraste e fármacos nefrotóxicos, apresenta tipicamente instalação mais aguda e associa-se à recuperação ou melhoria da função renal após suspensão do fator precipitante, geralmente após 4-21 dias2. A doença ateroembólica renal, por outro lado, apresenta instalação frequentemente subaguda, é uma causa provável a considerar num doente com aterosclerose difusa, fatores de risco cardiovascular e que foi submetido a terapêutica fibrinolítica e anticoagulante1,6,7. Este diagnóstico foi igualmente confirmado na biópsia pela presença de êmbolos de colesterol nas artérias renais e explica o mau prognóstico renal do doente, com dependência dialítica.
A doença ateroembólica predomina em homens idosos, caucasianos e com aterosclerose grave e tem incidência desconhecida, sendo frequentemente subdiagnosticada1-4,6,7. Ocorre por embolização sistémica de cristais de colesterol após rotura de placas de ateroma; ao contrário dos trombos, os êmbolos de colesterol são pouco distensíveis e originam oclusão parcial dos pequenos vasos, cursando com atrofia isquémica com inflamação, reação tipo “corpo estranho” e fibrose e, portanto, com manifestações essencialmente subagudas2-6. Os fatores que precipitam a rotura das placas de ateroma são maioritariamente iatrogénicos, sobretudo por lesão mecânica durante procedimentos endovasculares, como angiografia ou cirurgia cardiovascular. Mais ocasionalmente decorre da realização de fibrinólise e/ou de anticoagulação, que podem provocar a hemorragia, rotura e limitar a regeneração da placa de ateroma ulcerada1-7. É de referir que, durante o internamento, a anticoagulação deste doente foi ajustada para dose terapêutica, o que pode ter facilitado a progressão do ateroembolismo.
As manifestações clínicas da doença ateroembólica são variadas atendendo ao potencial embólico sistémico dos cristais de colesterol. São frequentes as manifestações cutâneas (75-96%), gastrointestinais e/ou neurológicas, e pode haver envolvimento renal em cerca de 50% dos casos1-5. A lesão renal ateroembólica é geralmente subaguda, com instalação em semanas após o fator desencadeante e com padrão stepwise (em “escada”), alternando entre períodos de estabilização e de agravamento1,2,7. Este padrão verificou-se neste doente, ainda que tenha havido influência de outros fatores, como referido. Menos frequentemente, a lesão renal pode ainda ter uma apresentação aguda (por embolização massiva) ou crónica (semelhante à nefropatia isquémica e nefroesclerose)1,2. É de salientar que o ateroembolismo poupa tipicamente a circulação pulmonar, pelo que as manifestações pulmonares ocorrem por lesão indireta ou embolia da circulação pleural, culminando com aparecimento de derrame pleural, abundante em eritrócitos e colesterol10; este pode ter sido um dos motivos para desenvolvimento de derrame pleural neste doente.
O ateroembolismo renal, além de resultar na elevação da ureia e creatinina, é frequentemente acompanhado de eosinofilia e hipocomplementémia na fase aguda, por ativação imunológica na superfície da placa ulcerada1-5. Ao contrário da eosinofilia, a diminuição do complemento não foi documentada neste doente, embora o seu doseamento não tenha sido realizado na fase aguda. O sedimento urinário revela poucas alterações, com poucas células e cilindros, proteinúria escassa, e eosinofilúria (visível apenas com coloração de Hansel na fase aguda2, não disponível no nosso centro hospitalar). Ainda que a eosinofilia e as alterações inespecíficas na urina pudessem levantar a suspeita de processo de vasculite/glomerulonefrite, admite-se que esta hipótese seja menos provável, perante o contexto clínico e restante estudo sem alterações (serologias infeciosas, anticorpos ANCA e GBM, crioglobulinas e complemento).
Sendo necessário elevado índice de suspeição, o diagnóstico pode ser feito pela presença da tríade clínica (presença de fatores precipitantes + disfunção renal subaguda/aguda + sinais extrarrenais, geralmente cutâneos) ou por biópsia (renal, cutânea ou gastrointestinal)1,2. A biópsia permite o diagnóstico definitivo, sendo patognomónica a presença de êmbolos de colesterol, tipicamente com aspeto “em fenda”2,3,11. Ao contrário da fase aguda em que as lesões se encontram circundadas por fibrina e eritrócitos, as lesões crónicas apresentam fibrose da íntima em torno do êmbolo de colesterol11. Nem sempre a biópsia é necessária, reservando-se para situações crónicas ou em que a tríade clínica não esteja presente1,2.
A terapêutica é essencialmente de suporte, através do controlo dos fatores de risco cardiovascular, suspensão de anticoagulação e evicção de procedimentos vasculares1-7,12. O papel de outras terapêuticas, como as estatinas, corticoterapia e a LDL-aferese, ainda não está bem estabelecido, podendo haver benefício na sua utilização1,3,4,13.
O prognóstico destes doentes é pobre, sendo significativas a mortalidade e a percentagem que desenvolve doença renal terminal e necessita de terapêutica dialítica2-4,7. Um estudo revelou que, do follow-up aos 2 anos, 33% destes doentes apresentavam doença renal crónica terminal e foi verificado o óbito em 28% dos casos2,14.
Assim, não só por ser uma entidade rara mas também por ser necessário elevado índice de suspeição para o diagnóstico e pela importante morbimortalidade que lhe está associada, é importante que o internista esteja alerta para a possibilidade de ateroembolismo renal, sobretudo num doente com patologia aterosclerótica grave, submetido a terapêutica fibrinolítica e/ou anticoagulante, e que desenvolve lesão renal aguda ou subaguda.
Figura I
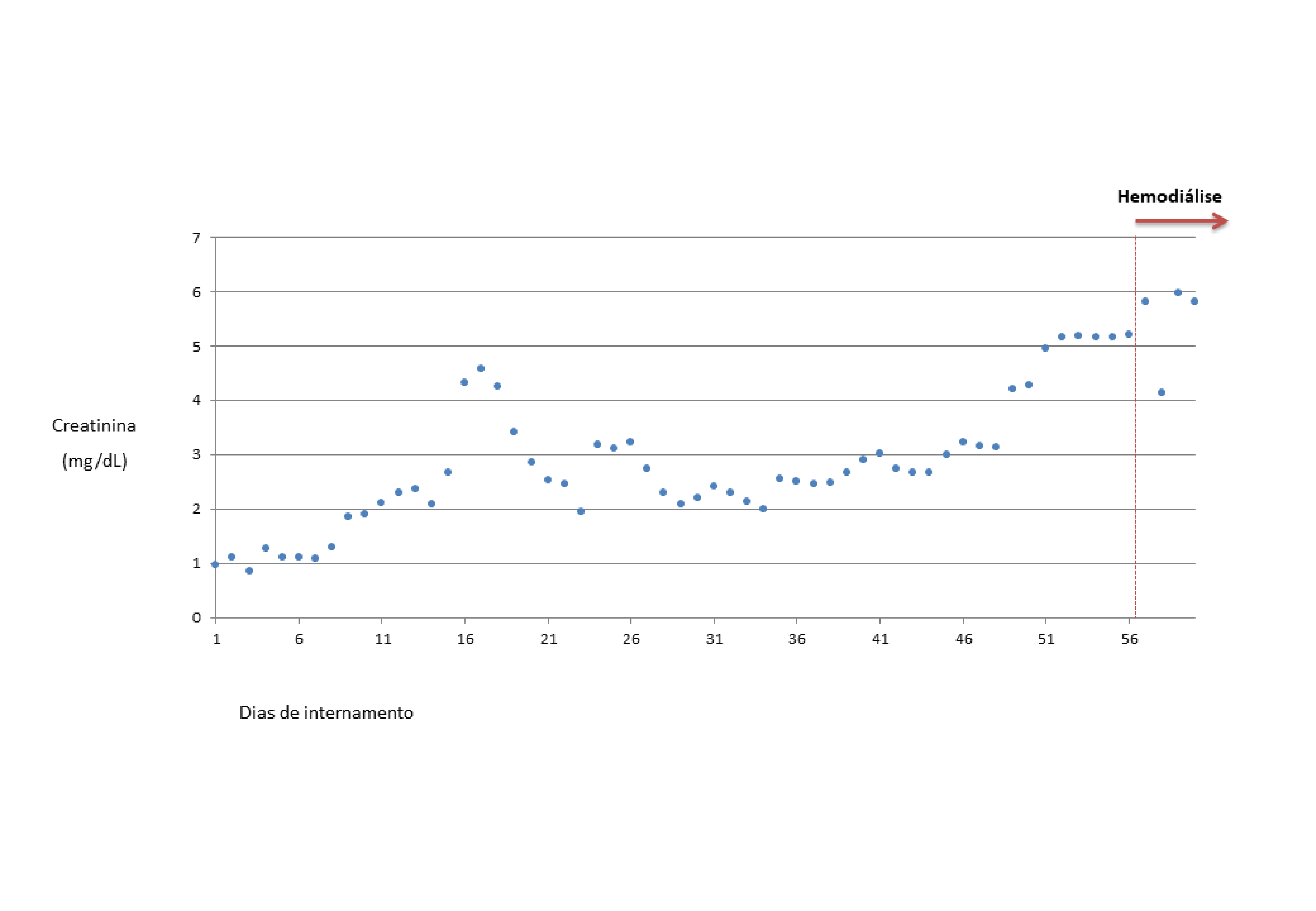
Progressão da creatinina do doente, com instalação de lesão renal subaguda ao longo do internamento; após período inicial verifica-se grosseiramente padrão stepwise ou “em escada”, alternando entre períodos de estabilização e de agravamento, culminando na necessidade de diálise a partir do 57º dia de internamento.
Figura II
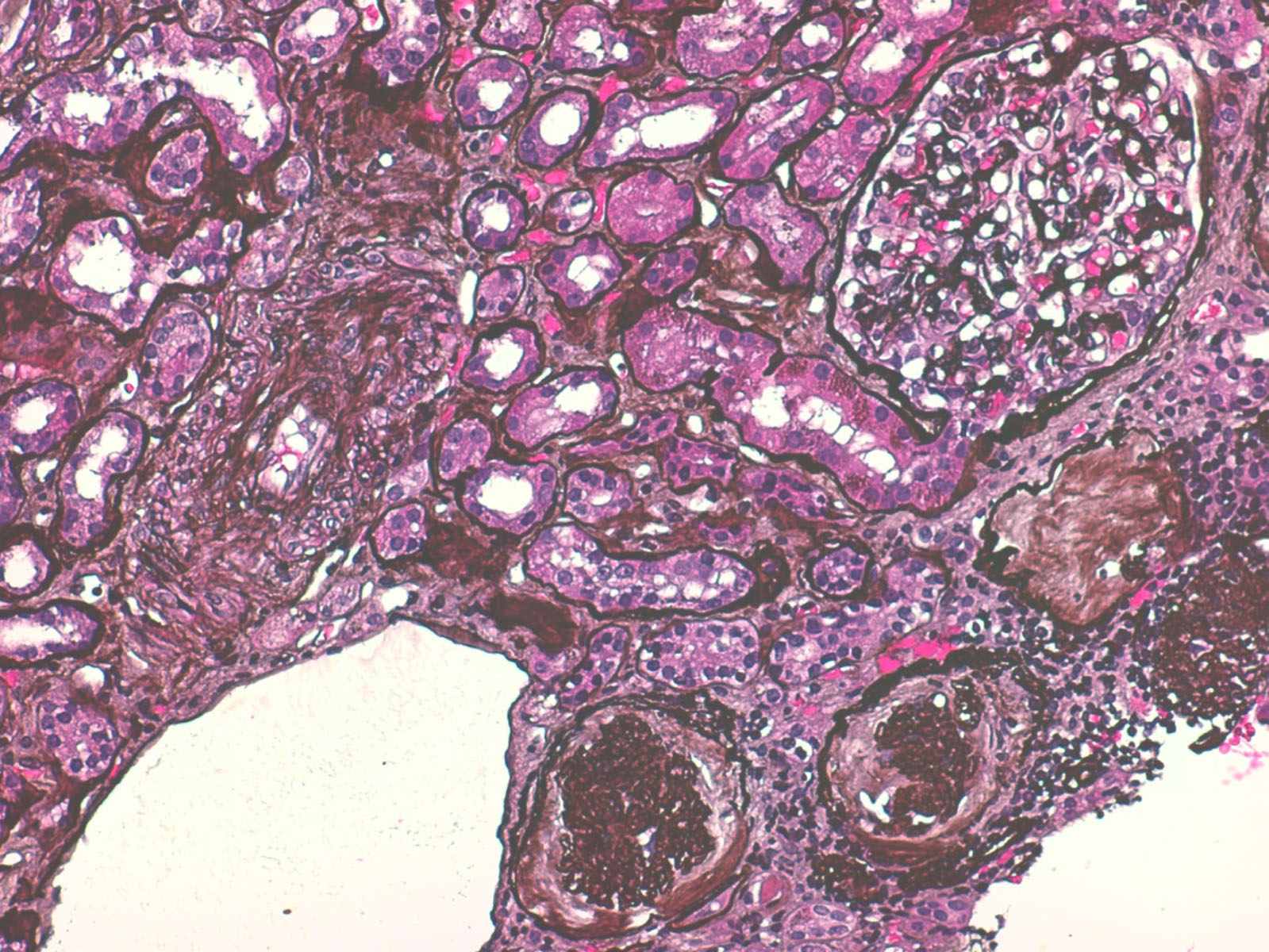
Biópsia renal, microscopia ótica, coloração com prata; X200. Todos os glomérulos da amostra apresentavam alterações isquémicas, 50% dos quais com esclerose global.
Figura III
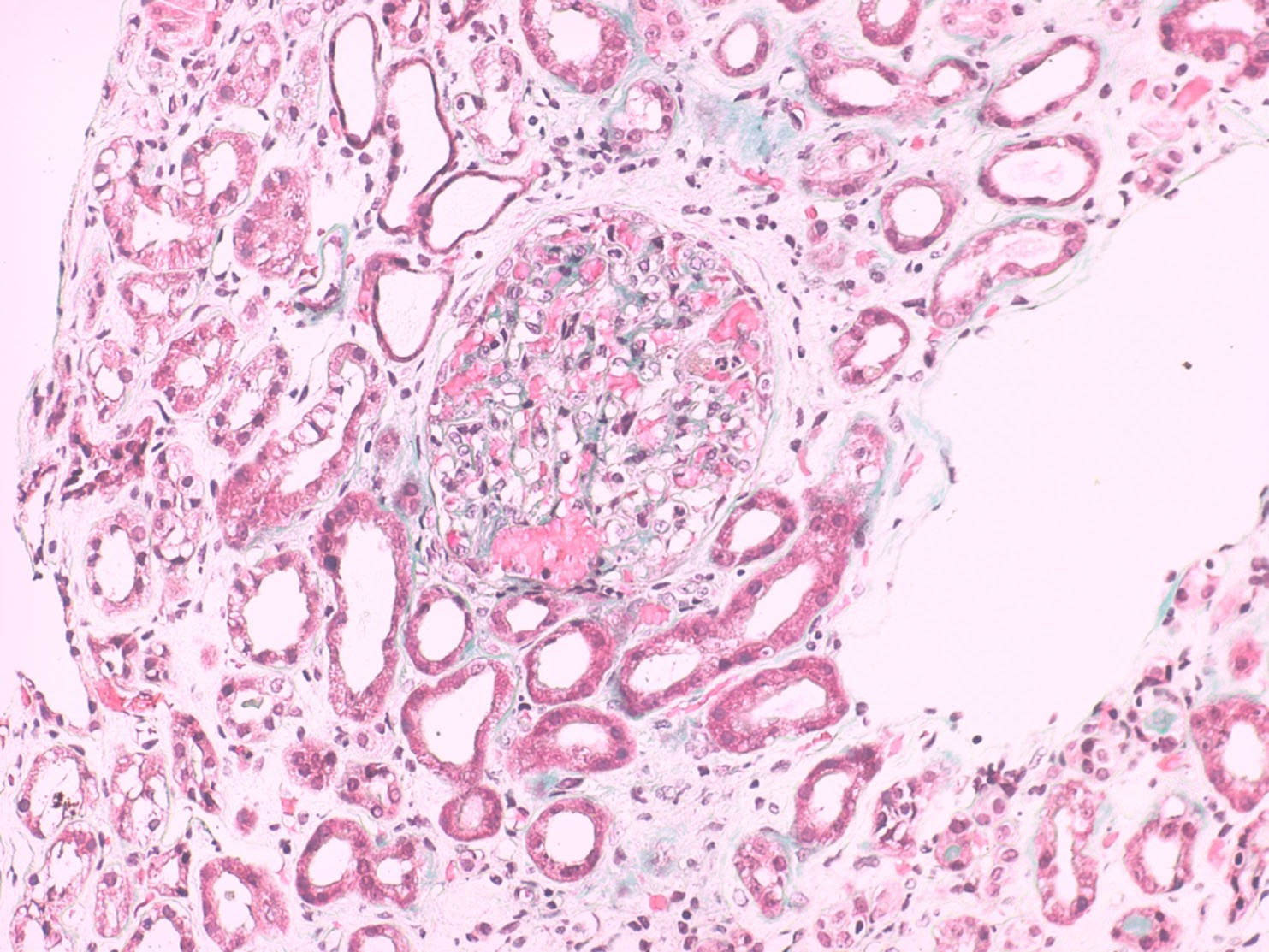
Biópsia renal, microscopia ótica, coloração com tricrómio de Masson; X200. A amostra continha 70% de atrofia tubular e 30% de necrose tubular aguda.
Figura IV
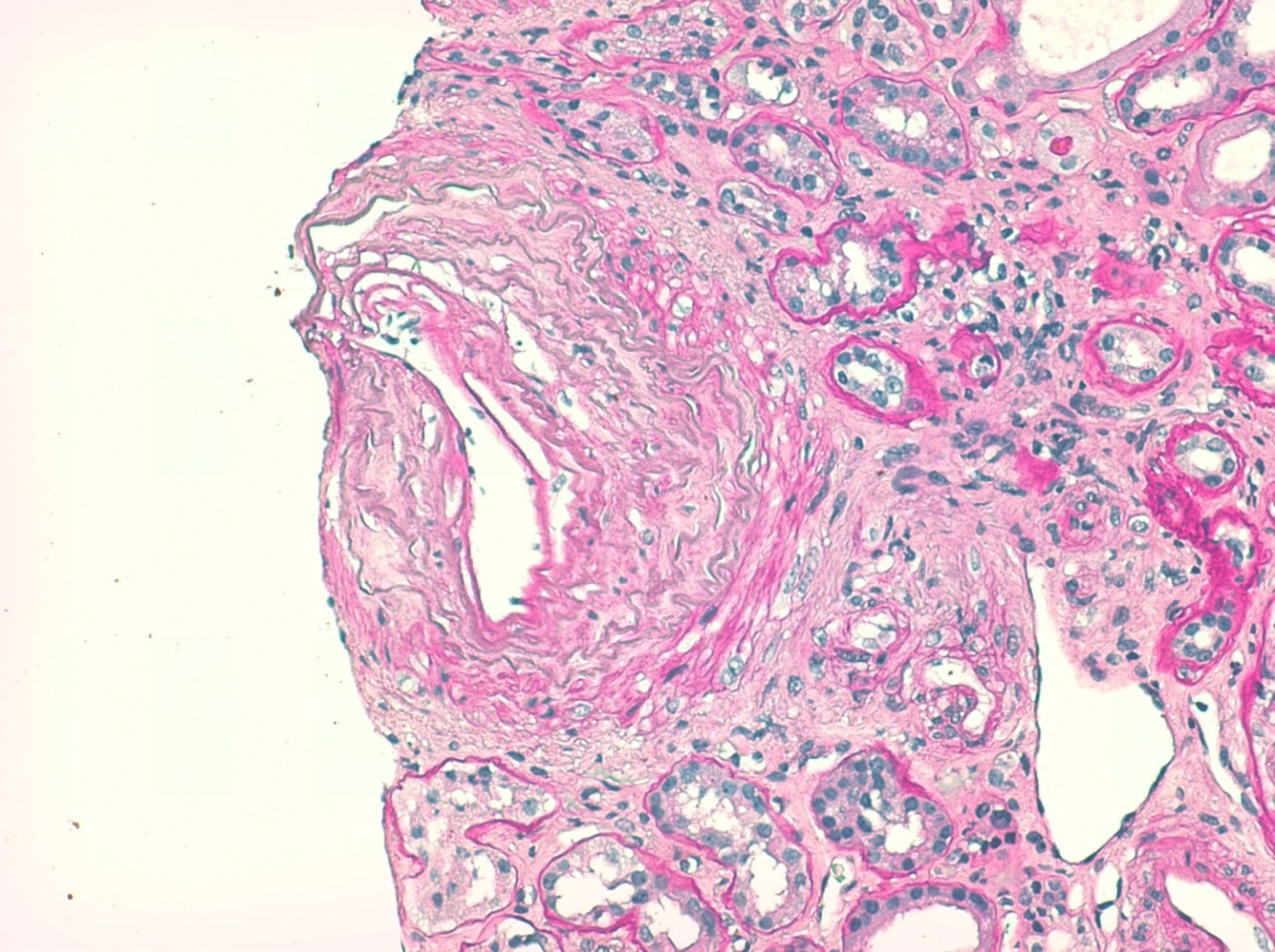
Biópsia renal, microscopia ótica, coloração com ácido periódico de Schiff; X200. As artérias de médio calibre apresentavam duplicação da lâmina elástica interna e hipertrofia fibrótica da íntima.
Figura V
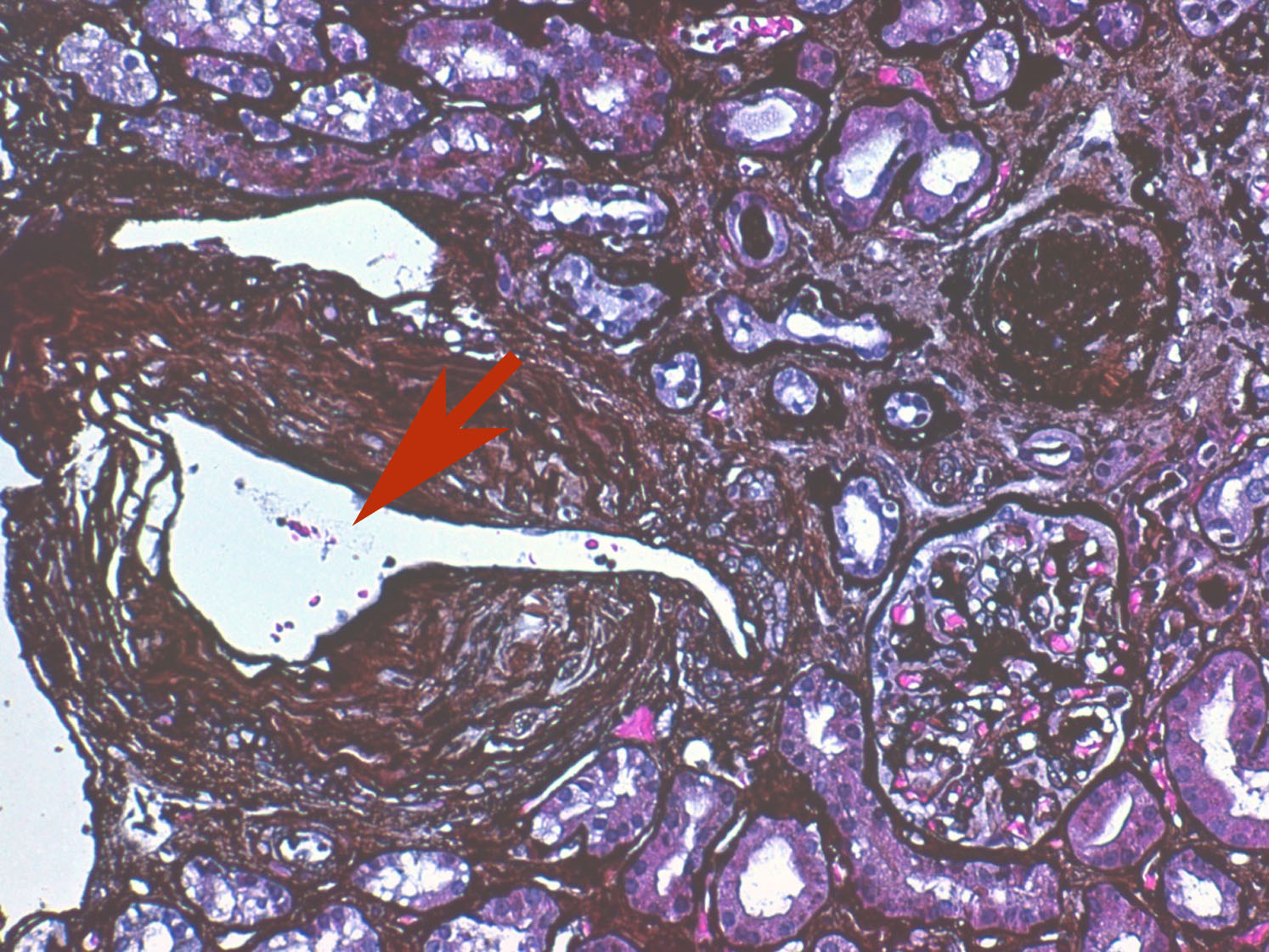
Biópsia renal, microscopia ótica, coloração com prata; X200. Presença de fenda alongada numa artéria interlobular da amostra, que representa o local onde originalmente estiveram alojados os êmbolos de cristais de colesterol; estes são geralmente reconhecidos como fendas biconvexas, em forma de agulha, vazias, devido à dissolução dos êmbolos durante o processamento da amostra.
BIBLIOGRAFIA
1. Scolari F, Ravani P. Atheroembolic renal disease. Lancet. 2010;375(9726):1650–60.
2. Scolari F. UpToDate [Internet]. Clinical presentation, evaluation, and treatment of renal atheroemboli. [cited 2018 Oct 20]. Available from: https://www.uptodate.com/contents/clinical-presentation-evaluation-and-treatment-of-renal-atheroemboli
3. Li X, Bayliss G, Zhuang S. Cholesterol crystal embolism and chronic kidney disease. Int J Mol Sci. 2017;18(6):1120.
4. Ghanem F, Vodnala D, Kalavakunta JK, Durga S, Thormeier N, Subramaniyam P, et al. Cholesterol crystal embolization following plaque rupture: a systemic disease with unusual features. J Biomed Res. 2017;31(2):82–94.
5. Saric M, Kronzon I. Cholesterol embolization syndrome. Curr Opin Cardiol. 2011;26(6):472–9.
6. Quinones A, Saric M. The cholesterol emboli syndrome in atherosclerosis. Curr Atheroscler Rep. 2013;15(4):315.
7. Faria B, Vidinha J, Pêgo C, Garrido J, Lemos S, Lima C, et al. Atheroembolic renal disease with rapid progression and fatal outcome. Clin Exp Nephrol. 2011;15(1):159–63.
8. Hitti W, Wali R, Weinman E, Drachenberg C, Briglia A. Cholesterol embolization syndrome induced by thrombolytic therapy. Am J Cardiovasc Drugs. 2008;8(1):27–34.
9. Oe K, Araki T, Nakashima A, Sato K, Konno T, Yamagishi M. Late Onset of Cholesterol Crystal Embolism after Thrombolysis for Cerebral Infarction. Intern Med. 2010;49(9):833–6.
10. Kollef MH, McCormack MT, Kristo DA, Reddy VVB. Pleural Effusion in Patients With Systemic Cholesterol Embolization. Chest. 1993;103(3):792–5.
11. Lusco MA, Fogo AB, Najafian B, Alpers CE. AJKD Atlas of Renal Pathology: Cholesterol emboli. Am J Kidney Dis. 2018;67(4):e1–2.
12. Igarashi Y, Akimoto T, Kobayashi T, Iwazu Y, Miki T, Otani-Takei N, et al. Performing Anticoagulation: A Puzzling Case of Cholesterol Embolization Syndrome. Clin Med Insights Case Reports. 2017;10:1–5.
13. Ishiyama K, Sato T, Yamaguchi T, Taguma Y. Efficacy of low-density lipoprotein apheresis combined with corticosteroids for cholesterol crystal embolism. Clin Exp Nephrol. 2017;21(2):228–35.
14. Scolari F, Ravani P, Gaggi R, Santostefano M, Rollino C, Stabellini N, et al. The challenge of diagnosing atheroembolic renal disease: Clinical features and prognostic factors. Circulation. 2007;116(3):298–304.
