INTRODUÇÃO
A Leishmaniose Visceral, também denominada Kala-azar ou Febre Negra, é transmitida por fêmeas dos mosquitos Lutzomyia e Phlebotomus, devendo suspeitar-se da doença em contexto clínico sugestivo, aquando de contacto com meio propício ao seu desenvolvimento (ex: proximidade de rios)2-4. Esta patologia deve o seu nome ao patologista escocês Wiiliam Boog Leishman, responsável pela descoberta do parasita, numa biópsia esplénica post-mortem, em Novembro de 19005. Tem um amplo diagnóstico diferencial, que inclui neoplasias hematológicas e múltiplas infeções, virais e bacterianas6. O diagnóstico e o tratamento devem ser céleres, de modo a evitar as consequências nefastas associadas.
CASO CLÍNICO
Mulher de 21 anos, caucasiana, estudante, saudável, sem hábitos toxicofílicos.
Admitida no Serviço de Urgência por febre e sensação de enfartamento com 2 semanas de evolução, sem outra sintomatologia focalizadora de órgão. Do contexto epidemiológico, apurou-se estadia num campo de férias próximo a um rio, 2 anos antes, referindo astenia desde então.
À admissão encontrava-se vigil, orientada, colaborante, sem sinais meníngeos, com palidez mucocutânea, apirética, hemodinamicamente estável, eupneica em ar ambiente, orofaringe sem hiperémia ou exsudados, auscultatoriamente sem alterações, sem adenopatias palpáveis, sem lesões cutâneas, abdómen não distendido e indolor, com palpação do baço 8 cm abaixo da grelha costal (Figura I).
Laboratorialmente destacava-se pancitopénia (hemoglobina 8.9g/dL normocítica e normocrómica, leucócitos 2200/uL e plaquetas 76000/uL), elevação da proteína-C-reativa (8.47mg/dL), elevação da velocidade de sedimentação (117mm/h), sem alteração da enzimologia hepática, função renal ou ionograma, com teste sumário de urina não patológico.
A telerradiografia torácica não documentou alterações pleuroparenquimatosas agudas.
Foi internada para estudo etiológico, tendo iniciado antibioterapia empírica com claritromicina, após colheita de uro e hemoculturas.
Efetuou-se ecografia abdominal, que revelou esplenomegália franca (21 cm de diâmetro crânio-caudal) e fígado com dimensão no limite superior do normal, ambos com ecoestrutura homogénea.
Prosseguiu-se o estudo com tomografia computorizada abdomino-pélvica, que confirmou a esplenomegália e excluiu adenomegálias nesta localização (Figura II).
Durante o internamento, a doente manteve febre que cedia apenas temporariamente a terapêutica anti-pirética, e houve agravamento da pancitopénia (valores mínimos: hemoglobina 6.8g/dL, leucócitos 1400/uL e plaquetas 68000/uL). Colheram-se novamente hemoculturas e alterou-se a antibioterapia para piperacilina/tazobactam e metronidazol, sem melhoria. Realizou-se transfusão de 1 unidade de concentrado eritrocitário, com bom rendimento.
Dada a febre mantida, efetuou-se ecocardiograma transtorácico, que não documentou vegetações.
O estudo analítico efetuado documentou cinética marcial a favor de doença inflamatória/crónica, ECA normal, autoimunidade negativa, uro, copro e hemoculturas (bacteriológico e micobacteriológico) negativas, serologias de Vírus da Imunodeficiência Humana, Hepatite B e C, Citomegalovírus, Epstein-Barr vírus, Parvovírus B19, Herpes simplex vírus, VDRL, Brucella, Borrelia, Bartonella, Leptospira, Mycoplasma pneumoniae e Chlamydia psittaci negativas, pesquisa de hematozoários no sangue negativa, exceto IgG anti-Leishmania, que foi positiva em título de 1/640, com IgM negativa.
O mielograma documentou alterações compatíveis com anemia de causa mista (ferropénia e processo inflamatório), com bacteriológico e pesquisa de Leishmania negativos.
Apesar da ausência de visualização do parasita na medula óssea, pela suspeita mantida de leishmaniose, iniciou-se terapêutica com anfotericina B lipossómica 3 mg/kg/dia. Desde então, a partir do 4º dia, apresentou evolução favorável, com apirexia mantida e melhoria da pancitopénia, com possibilidade de alta, clinicamente melhorada e com redução da esplenomegália (Figura III). A reavaliação ecográfica após 1 mês documentou normalização da esplenomegália.
DISCUSSÃO
A Leishmaniose é uma parasitose que ocorre predominantemente em regiões tropicais e temperadas, maioritariamente no Sudeste Asiático, África Oriental e América Latina, sendo também endémica em alguns países do Mediterrâneo, incluindo Portugal4, 6. Em todo o mundo, estima-se que ocorram, anualmente, 50000 a 90000 novos casos de doença7, 8.
Tem 3 formas de apresentação: cutânea, muco-cutânea e visceral, sendo a última a forma mais severa. O período de incubação é variável e as manifestações de leishmaniose visceral podem ocorrer de 10 dias a mais de 1 ano após a exposição4, 9, 10. Os sintomas comumente presentes são febre, astenia, anorexia, perda ponderal, desconforto e/ou distensão abdominal, hepatoesplenomegália, associados a anemia, trombocitopénia e leucopénia4, 11.
O diagnóstico da doença baseia-se na conjugação de sinais e sintomas com testes serológicos. É, maioritariamente, estabelecido através da visualização do parasita intracelular (macrófagos) em aspirados ou biópsias tecidulares, incluindo na medula óssea (porém, com uma sensibilidade associada de 50-85%), o que não foi possível no caso apresentado12.
Relativamente ao tratamento, a anfotericina B lipossómica detém elevada eficácia e o melhor perfil de segurança, sendo a arma terapêutica preferida na Europa. Associa-se o tratamento de suporte, dirigido a complicações da doença, nomeadamente hemorragia secundária a trombocitopénia e infeções secundárias13.
Na ausência de tratamento, a Leishmaniose visceral pode evoluir para disfunção multi-orgânica e morte dentro de 2 a 3 anos. Além disso, apesar da terapêutica apropriada, pode ocorrer recidiva da doença após 6 a 12 meses14, 15.
Este caso clínico demonstra uma maneira indireta de diagnosticar leishmaniose visceral, através da imunidade tardia e da resposta à terapêutica.
CONCLUSÃO
Apesar da Leishmaniose Visceral ser uma patologia relativamente infrequente na Europa, devemos estar cientes da mesma, por forma a diagnosticá-la e tratá-la atempadamente, devido à sua repercussão sistémica e a elevada morbi-mortalidade na ausência de tratamento.
Figura I
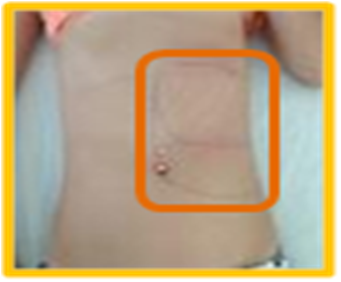
Delineação da área compatível com as dimensões do baço, antes do tratamento.
Figura II
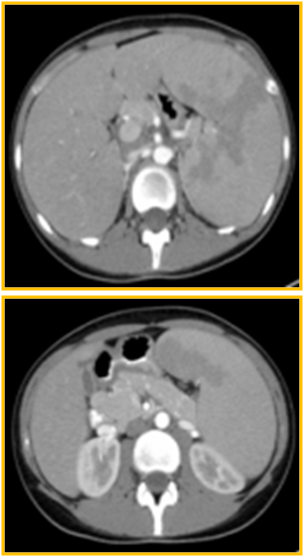
Tomografia computorizada a documentar extensa esplenomegália.
Figura III
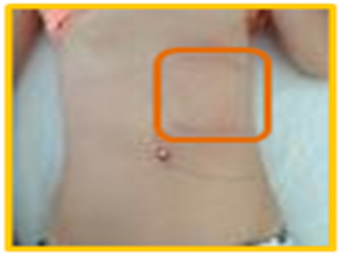
Delineação da área compatível com as dimensões do baço, após o tratamento.
BIBLIOGRAFIA
1. R. Leishmaniasis. 2005. http://www.emedicine.com/emerg/topic296.htm.
2. Mandell GL, Bennett JE, Dolin R. Mandell, Douglas and Bennett’s principles and practice of infectious diseases, 6th edn. Philadelphia, PA: Elsevier Churchill Livingstone, 2005:2428–42.
3. Maroli M, Feliciangeli MD, Bichaud L, Charrel RN, Gradoni L. Phlebotomine sandflies and the spreading of leishmaniasis and other diseases of public health concern. Med Vet Entomol. 2013;27:123–47.
4. Torres-Guerrero E, Quintanilla-Cedillo MR, Ruiz-Esmenjaud J, Arenas R. Leishmaniasis: a review [version 1; referees: 2 approved]. F1000Research 2017, 6(F1000 Faculty Rev):750 (doi: 10.12688/f1000research.11120.1).
5. Leishman WB. On the possibility of the occurrence of trypanosomiasis in India. Br Med J. 1903;1:1252–4.
6. Pace D, Leishmaniasis, J Infect (2014), http://dx.doi.org/10.1016/j.jinf.2014.07.016.
7. Alvar J, Velez ID, Bern C, et al. Leishmaniasis worldwide and global estimates of its incidence. PLoS One 2012; 7: e35671.
8. WHO. Leishmaniasis. Geneva: World Health Organization. http://www.who.int/mediacentre/factsheets/fs375/en/
9. De Alencar JE, Neves J. Leishmaniose visceral (calazar). In: Veronesi R, ed. Doencas Infecciosas e Parasitarias, 7th edn. Rio de Janeiro: Editora Guanabara Koogan SA, 1982:724.
10. Manson-Bahr PEC, Southgate BA, Harvey AEC. Development of kala-azar in man after inoculation with a leishmania from a Kenyo sandfly. BMJ 1963;1:1208–10.
11. Zijlstra EE, El-Hassan AM. Visceral leishmaniasis. Trans R Soc Trop Med Hyg 2001;95(Suppl 1):S27–58.
12. Burza S, Croft SL, Boelaert M. Leishmaniasis. The Lancet 2018;392:951-970. http://dx.doi.org/10.1016/S0140-6736(18)31204-2.
13. Sundar S, Sinha PK, Rai M, Verma DK, Nawin K, Alam S, et al. Comparison of short-course multidrug treatment with standard therapy for visceral leishmaniasis in India: an openlabel, non-inferiority, randomised controlled trial. Lancet 2011; 377:477–86.
14. Collin S, Davidson R, Ritmeijer K, Keus K, Melaku Y, Kipngetich S, et al. Conflict and kala-azar among patients in southern Sudan. Clin Infect Dis 2004 Mar 1;38(5):612-9.
15. Ready PD. Epidemiology of visceral leishmaniasis. Clin Epidemiol 2014; 6: 147–54.




