Introdução
A demência rapidamente progressiva carateriza-se pela instalação em dias/semanas e progressão rápida.1Existem múltiplas etiologias, cujas categorias podem ser agrupadas no acrónimo “VITAMIN D” (Vascular, Infeciosa, Traumática, Autoimune, Metabólica, Iatrogénica, Neoplásica, Degenerativa).2Contudo, cerca de 1/3 dos casos permanece sem etiologia.2
O objetivo deste trabalho é alertar para uma causa rara e tratável de demência rapidamente progressiva: encefalopatia responsiva a corticóide associada a tiroidite autoimune (ERCATA).3Apesar das dúvidas quanto à fisiopatologia e terapêutica, é fundamental reconhecer esta entidade, já que o tratamento pode mudar radicalmente o curso da doença.3
Caso Clínico
Mulher de 68 anos, com hipertensão arterial e perturbação afetiva bipolar há dezasseis anos (sob valproato de sódio 500mgbid, olanzapina 10mgbid, lorazepam 2,5mgid; medicada com lítio no passado), bem controlada até há dois anos. Apresentou descompensação da doença psiquiátrica, com vários episódios de psicose com necessidade de 3 internamentos em hospital psiquiátrico. Autónoma até há 6 meses, quando começa a necessitar de ajuda na higiene pessoal e perde progressivamente autonomia nas atividades de vida diária. Paralelamente notados deterioração cognitiva (défice cognitivo ligeiro, comMini Mental State Examinationde 23), episódios de confusão, tremor e marcha de pequenos passos. O quadro culminou com novo internamento, durante o qual apresentou uma crise tónico-clónica generalizada. A doente evoluiu em mutismo acinético e Escala de Coma de Glasgow de 9 (O3V1M5), com a seguinte terapêutica: levodopa/carbidopa 100/25mg4id, risperidona 3mgbid, aripiprazole 15mgid, tri-hexifenidilo 10mgid, lorazepam 2,5mgid, valproato de sódio 500mg 2id. Foi transferida para hospital geral. Apresentava tremor mentoniano e dos membros superiores de baixa frequência em repouso, rigidez axial e apendicular simétrica e acinésia; sem outras alterações relevantes no exame objetivo. Documentada elevação da proteína C reativa (PCR) de 46,5mg/L, velocidade de sedimentação (VS) de 100mm/1ªh e anemia normocítica/normocrómica (hemoglobina=9,4g/dL). A ressonância magnética cerebral mostrou lesões isquémicas antigas bilaterais e atrofia cortico-subcortical (Fig. 1). Punção lombar com proteinorráquia em duas ocasiões (27 e 33 mg/dL). Eletroencefalograma com traçado de frequência lenta, sem atividade epileptiforme (Fig. 2). Efetuado estudo alargado em que se excluíram causas infeciosas, neoplásicas e metabólicas. Função tiroideia normal, mas título do anticorpo anti-tiroperoxidase (anti-TPO) 10 vezes superior ao normal (57,6 UI/mL), com restante estudo imunológico negativo (incluindo anticorpos anti-canais de potássio, anti-α-enolase, anti-NMDAR, anti-AMPAR, anti-LG1, anti-CASP2 e anti-receptor da TSH). A ecografia revelou tiróide globosa e multinodular e a biópsia foi compatível com tiroidite linfocítica.
Pela possibilidade de ERCATA, foi realizada prova terapêutica com pulso diário de 1g de metilprednisolona, em 5 dias consecutivos, com franca melhoria da vigília, início de discurso e ausência de tremor ao 5º dia de terapêutica. A lentificação, a rigidez e os marcadores inflamatórios melhoraram progressivamente nas semanas seguintes. Seguiu-se terapêutica com prednisolona 1mg/kg/dia, desmame lento até 10 mg/dia e início de azatioprina escalada até 150mg/dia. Três anos depois, mantém cognição e autonomia preservadas, humor controlado (teve episódio único de mania, controlado com valproato de sódio, olanzapina e fluoxetina), ausência de tremor ou rigidez e deambula sem apoio e sem ataxia.
A evolução cronológica do caso está esquematizada na Fig. 3.
Discussão
Casos de demência rapidamente progressiva com apresentação semelhante à descrita são relativamente comuns na prática clínica de internistas, neurologistas e psiquiatras. A “chave” para que este não fizesse parte do “terço” idiopático (e sem tratamento) incluiu uma investigação diagnóstica exaustiva e elevado grau de suspeição.
A ERCATA foi descrita pela primeira vez em 1966.4É uma doença rara (2:100000 de adultos), possivelmente subdiagnosticada, mais frequente em mulheres (4:1), com idade média de aparecimento aos 50 anos.3
Não existe consenso em relação à patofisiologia e nomenclatura. O termo mais utilizado é Encefalopatia deHashimoto, o que nos poderia fazer pensar que a encefalopatia era causada pela tiroidite deHashimoto. Contudo, não existe evidência que o comprove.3O predomínio no sexo feminino, a associação a outras doenças autoimunes (Miastenia gravis, Síndrome deSjögren, Lúpus Eritematoso Sistémico, Sarcoidose, Artrite Psoriática)5e a resposta ao corticóide apoiam a hipótese de etiologia autoimune, possivelmente com base em antigénios partilhados pela glândula tiroideia e o sistema nervoso central. Esta possibilidade é apoiada pela identificação de anticorpos anti-tiroideus no líquor e de antigénios para os anticorpos anti-recetor da TSH em neurónios corticais e vasos cerebrais.6Também foram identificados anticorpos anti-α-enolase no sangue de doentes com ERCATA, tendo o seu antigénio uma elevada expressão no endotélio vascular cerebral e na tiróide.7Assim, consideramos que o termo ERCATA é o mais apropriado para designar o subtipo de encefalopatia responsiva a corticóide de etiologia não-vasculítica descrito neste relato. Acreditamos que a ênfase atribuída à “resposta à corticoterapia” pode ajudar no seu diagnóstico e tratamento.
Segundo a maior revisão do tema, a forma de apresentação mais típica inclui confusão, convulsões ou mioclonias (52-66%) e alteração do nível de consciência (36-85%).3 Estão descritos diferentes fenótipos da doença, desde presença de alterações neurológicas inespecíficas nos meses que precedem o quadro mais exuberante (forma insidiosa, mais frequente), à ausência de sintomatologia prévia ao quadro súbito (forma aguda).8 O curso pode ser progressivo (11-40%) ou por surtos (50-95%). Podem ainda ocorrer alterações do humor (7-20%), psicose (25-36%), disfunção cognitiva (36-100%), tremor (28-84%), afasia transitória (73-80%) e ataxia (28-65%), como neste caso.3
Além do diagnóstico inaugural de tiroidite deHashimoto, a doente não apresentava outros fenómenos autoimunes. Os anticorpos anti-tiroideus (anti-TPO, anti-tiroglobulina ou anti-recetor da TSH) encontram-se elevados em todos os casos, mas os seus níveis não se correlacionam com a gravidade, pelo que a sua presença (mesmo em níveis discretos) deve colocar-nos na pista desta patologia.8,9Apesar da elevada prevalência (86-100%) de anti-TPO nos doentes com ERCATA, não parece haver uma relação causal direta entre este e a encefalopatia, podendo tratar-se apenas de um marcador de autoimunidade.3,9Além disso, na investigação de doentes com encefalopatia e anti-TPO positivos é importante ter em conta que a prevalência destes anticorpos na população geral é elevada (7-17%)10, pelo que a sua presença deve ser valorizada de acordo com este dado.
Foi constatado um aumento da prevalência de anti-TPO e tiroidite autoimune nos doentes com perturbação afetiva bipolar (28-33%), independentemente da exposição a lítio.11, 12Assim, torna-se essencial equacionar a ERCATA em doentes com quadros psiquiátricos atípicos ou refratários.13 Salienta-se que o estado eutiroideu é critério de diagnóstico, uma vez que o hipo/hipertiroidismo podem, por si só, contribuir para algumas das manifestações desta síndrome.9Está descrita a presença de outros anticorpos (anti-tiroglobulina – 73%; anti-recetor da TSH – 10-20%; anti-α-enolase – 65-68%).13 A doente descrita apresentava ainda elevação da PCR e VS (23-38,5% das ERCATA) e proteinorráquia, (presente em 60-90%), habitualmente discreta. Outras alterações no líquor descritas na literatura são pleocitose linfocítica ligeira (6-25%), presença de anticorpos anti-tiroideus (62-75%), imunoglobulina G (IgG) aumentada (14%) e bandas oligoclonais (8-33%).3,9
A maioria destes doentes acaba por realizar electroencefalograma,inespecífico em 85-98% dos casos.3A ressonância magnética cerebral é habitualmente normal ou apresenta alterações inespecíficas, sendo importante para a exclusão de diagnósticos alternativos.3
Em 2006,Castillo et al9propuseram os critérios de diagnóstico (Tabela 1), assumidos porGiacomo et al3como os de maior acuidade. O caso apresentado cumpria todos estes critérios.
O corticóide integra o tratamento e o diagnóstico, servindo como prova terapêutica. Existem ainda dúvidas quanto ao melhor esquema a seguir. O mais frequentemente descrito inicia-se com pulso diário de 0,5-1g de metilprednisolona, em 5 dias consecutivos, seguido de prednisolona oral 1-2mg/kg/dia.3O desmame da corticoterapia é habitualmente de 1-2 anos e a combinação com poupador de corticóide (ex. azatioprina, metotrexato, rituximab, micofenolato de mofetil) é recomendada.3É sugerida a suspensão da terapêutica de manutenção ao fim de 3 anos sem sintomas.14 Se recorrência sugere-se repetição dos pulsos de metilprednisolona e em casos refratários a imunoglobulina endovenosa (2g/Kg/dia) ou plasmaferese.3,14,15
A melhoria verifica-se nos primeiros 10 dias de tratamento.3Cerca de ¾ recuperam o estado neurológico basal e os restantes mantêm algum grau de tremor, ataxia e/ou alterações cognitivas.3O prognóstico a longo prazo é bom, com 90% a manter remissão após desmame de imunossupressor.3A normalização dos testes neuropsicológicos, do EEG e a diminuição da IgG no líquor são apontados como indicadores de resposta ao tratamento.3,14
Como limitações na abordagem deste caso aponta-se o facto de não terem sido doseados no líquor os anticorpos anti-tiroideus (que poderiam ter apoiado ainda mais o diagnóstico) e a IgG (que poderia ser usada na monitorização da resposta ao tratamento), menos relevantes dada a melhoria sustentada da doente.
Os autores recomendam o estudo sistematizado e exaustivo dos doentes com encefalopatia, através do diagnóstico diferencial com as etiologias presentes no acrónimo “VITAMIN D”, incluindo o doseamento de anticorpos anti-tiroideus (independentemente da função tiroideia).
Quadro I
Critérios de diagnóstico de Encefalopatia de Hashimoto elaborados por Castillo et al8
| |
| |
| 1. Encefalopatia manifestada por défice cognitivo e pelo menos um dos seguintes: alterações neuropsiquiátricas, mioclonias, crises tónico-clónicas generalizadas ou parciais, défices neurológicos focais. |
| 2. Presença de anticorpos anti-tiroperoxidase. |
| 3. Status eutiroideu ou hipotiroidismo ligeiro (TSH<20mUI/L) que não contribua para a encefalopatia. |
| 4. Análises de sangue, urina e líquor sem evidência de processos infeciosos, tóxicos, metabólicos ou neoplásicos. |
| 5. Ausência de anticorpos sugestivos de etiologia paraneoplásica. |
| 6. Exames de neuroimagem sem evidência de lesões vasculares, neoplásicas ou outras lesões estruturais que expliquem a encefalopatia. |
| 7. Recuperação completa ou quase completa do estado neurológico basal após a corticoterapia. |
Figura I
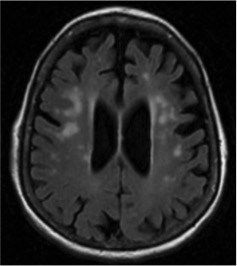
Imagem de ressonância magnética cerebral a evidenciar múltiplos focos de hipersinal na substância branca supratentorial, periventricular e subcortical, bilateralmente e alargamento generalizado dos espaços de líquido cefalorraquidiano.
Figura II
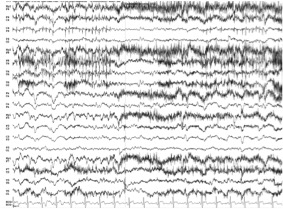
A electrogénese de base é dominada por ritmos alfa irregulares, com frequência de 7-8 Hz, sem assimetrias aparentes.
Figura III
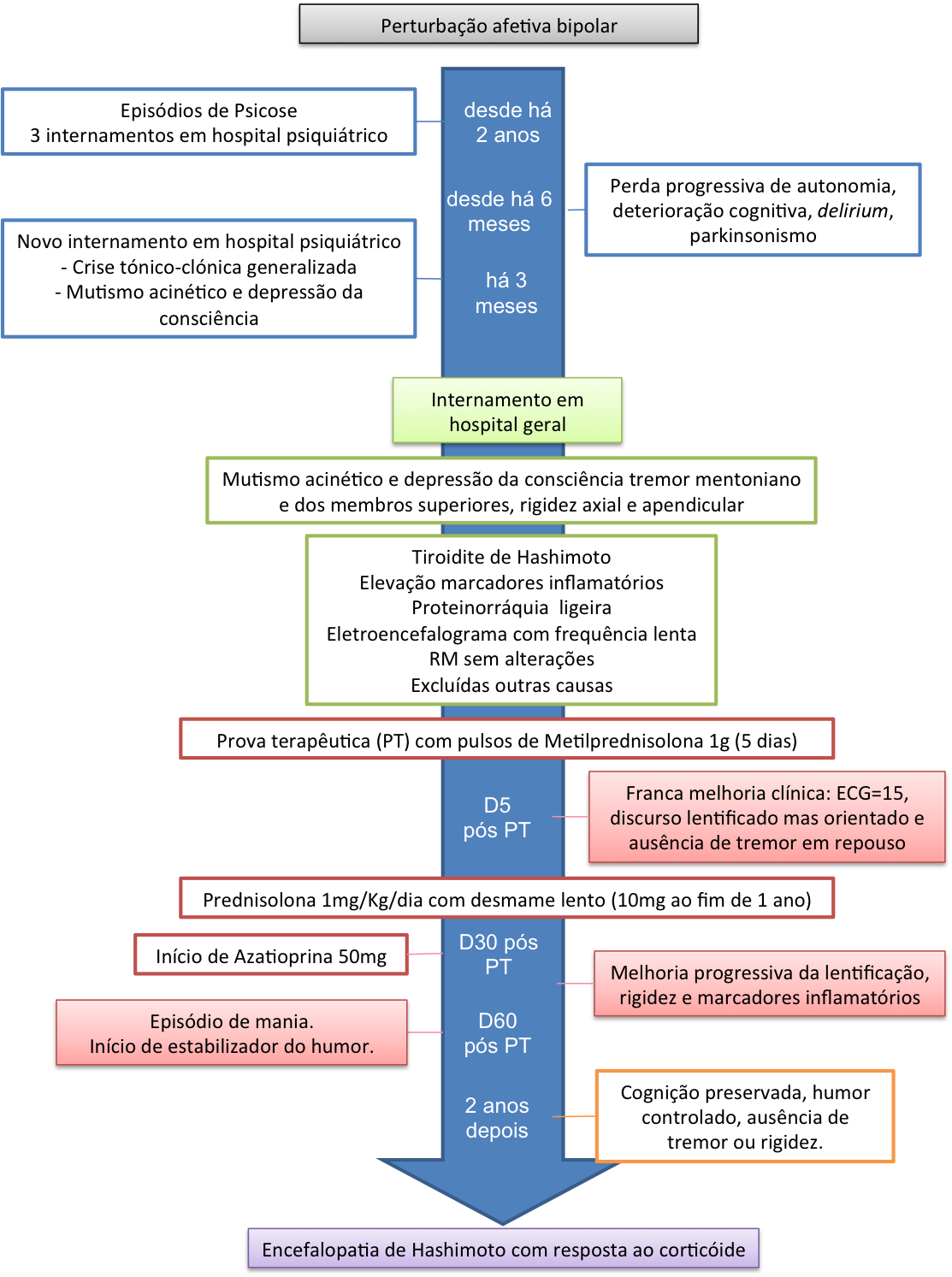
Dados mais importantes do caso por ordem cronológica. Legenda segundo a cor das caixas: preto – antecedentes; azul – história da doença atual; verde – resultados da marcha diagnóstica; vermelho – terapêutica e resposta à mesma; laranja – seguimento; roxo – diagnóstico final. PT - Prova terapêutica.
BIBLIOGRAFIA
1 - Rosenbloom M and Atri A. The Evaluation of Rapidly Progressive Dementia. Neurologist. 2011;17(2):67-74.
2 - Bucelli R and Ances B. Diagnosis and Evaluation of a Patient with Rapidly Progressive Dementia. Mo Med. 2013;110(5):422-428.
3 - Montagna G, Imperiali M, Agazzi P, D´Aurizio F, Tozzoli R, Feldt-Rasmussen U, et al. Hashimoto´s encephalopathy: A rare proteiform disorder. Autoimmun Rev. 2016;15(5):466-476.
4 – Brain L, Jellinek E, Ball K. Hashimoto’s disease and encephalopathy. Lancet. 1966;2(7462):512-514.
5 - Chong J, Rowland L, Utiger R. Hashimoto encephalopathy: syndrome or myth? Arch Neurol. 2003;60(2):164-171.
6 - Moodley K, Botha J, Raidoo D, Naidoo S. Immuno-localization of anti-thyroid antibodies in adult human cerebral cortex. J Neurol Sci. 2011; 302(1-2):114-117.
7 - Yoneda M, Fujii A, Ito A, Yokoyama H, Nakagawa H, Kuriyama M. High prevalence of serum autoantibodies against the amino terminal of alpha-enolase in Hashimoto´s encephalopathy. J Neuroimmunol. 2007;185(1-2):195-200.
8 - Payer J, Petrovic T, Lisy L, Langer P. Hashimoto Encephalopathy: A Rare Intricate Syndrome. Int J Endocrinol Metab. 2012;10(2):506-14.
9 - Castillo P, Woodruff B, Caselli R, Vernino S, Lucchinetti C, Swanson J, et al. Steroid- responsive encephalopathy associated with autoimmune thyroiditis. Arch Neurol. 2006;63(2):197-202.
10 - Amouzegar A, Gharibzadeh S, Kazemian E, Mehran L, Tohidi M, Azizi F. The Prevalence, Incidence and Natural Course of Positive Antithyroperoxidase Antibodies in a Population-Based Study: Tehran Thyroid Study. PLoS ONE, 2017;12(1):e0169283.
11 - Bocchetta A, Traccis F, Mosca E, Serra A, Tamburini G, Loviselli A. Bipolar disorder and antithyroid antibodies: review and case series. Int J Bipolar Disord. 2016;4(1):5.
12 - Kibirige D, Luzinda K, Ssekitoleko R. Spectrum of lithium induced thyroid abnormalities: a current perspective. Thyroid Res. 2013;6(1):3.
13 - Prat S, Jouan Y, Magnant J, Graux J, El-Hage W. Hashimoto encephalopathy diagnosis after 40 years of a schizophrenia-like disorder. Schizophr Res. 2012; 139(1-3):269-270.
14 - Olmez I, Moses H, Sriram S, Kirshner H, Lagrange A, Pawate S. Diagnostic and therapeutic aspects of Hashimoto´s encephalopathy. J Neurol Sci. 2013;331(1-2):67-71.
15 - Boers P, Colebatch J. Hashimoto´s encephalopathy responding to plasmapheresis. J Neurol Neurosurg Psychiatry. 2001;70(1):132.




