INTRODUÇÃO:A doença de Whipple (D.W.) foi descrita por George H. Whipple, em 1907, embora o autor tenha sugerido uma possível etiologia bacteriana para essa patologia, apenas em 19611, com o desenvolvimento da microscopia eletrónica e a deteção de bactérias nos tecidos afetados. Nos anos 90, com recurso a técnicas de polymerase chain reaction (PCR) conseguiu-se estabelecer uma relação filogenética entre a bactéria responsável pela D.W. e os actinomicetos, tendo sido proposto o nome de Tropheryma whipplei (T. whipplei)para essa nova bactéria.1-3
A doença atinge principalmente homens caucasianos, numa razão de 2-3:1 quando comparado com o sexo feminino, com uma mediana de idades de 55 anos.2
A fisiopatologia continua a ser alvo de muitas investigações, porém os autores são concordantes com a existência de uma predisposição subjacente para a infeção por T. whipplei, que condiciona um défice imunológico aparentemente subtil e específico, uma vez que estes pacientes não estão normalmente predispostos a outras infeções.3-8 A imunomodulação deficiente e uma desregulação de expressão de citocinas, com aumento das interleucinas 16 e 10 e diminuição da interleucina 12, entre outras, bem como da relação dos linfócitos Th1/Th2 acarretam prejuízo para a atividade Th1. Uma das consequências é um fenótipo alternativo dos macrófagos, sendo que estes mantêm a capacidade de fagocitose, mas perdem a capacidade de destruição do T. Whipplei. Estes elementos celulares parecem, assim, ter uma importância central no desenvolvimento da doença.2-4, 7,8
Classicamente, os sintomas intestinais são os mais reportados, mas qualquer órgão poderá ser afetado. Há ainda uma grande prevalência de sintomatologia articular, cardíaca, neurológica, muscular e oftalmológica.1 Embora menos comum, está também relatado o envolvimento pulmonar isolado.9
CASO CLÍNICO:
Homem de 60 anos, caucasiano, dependente para atividades da vida diária por défice cognitivo e com antecedentes de varizes dos membros inferiores, medicado com bioflavonoides. Seguido nos últimos 2 anos em consulta externa de Infeciologia por quadro crónico e intermitente de diarreia e vómitos, associado a uma perda ponderal insidiosa e progressiva, de aproximadamente 15 Kg (19% do seu peso corporal). Esteve internado no Serviço de Infeciologia (SI) por agravamento do quadro diarreico com hematoquézia associada, anemia com 6,9 g/dL de hemoglobina, hipocrómica, microcítica e trombocitopenia de 77000/uL. Nessa altura, a investigação clínica associou o quadro à possível iatrogenia do uso de flavonoides. Um mês após da alta, recorreu ao Serviço de Urgência (SU) com quadro de diarreia sanguinolenta, recusa alimentar, prostração, anemia e hemoglobina de 7.9 g/dL, hipocrómica, microcítica e trombocitopenia com 56000/uL plaquetas. Ao exame objetivo destacava-se apenas a palidez cutânea e dor abdominal difusa à palpação profunda. Foi internado para investigação. Evoluiu, nos primeiros dias, com rápida deterioração do estado geral por diarreia com hematoquézias abundantes. Após a realização de uma endoscopia digestiva alta e 2 colonoscopias inconclusivas, e com consequente perfuração do sigmoide, foi submetido a cirurgia emergente com realização de biópsia do duodeno. Ao 5º dia do pós-operatório, apresentou quadro de choque distributivo, iniciou terapêutica empírica com piperacilina/tazobactam e foi transferido para Unidade de Cuidados Intensivos (UCI), por deterioração neurológica e necessidade de suporte ventilatório mecânico. O teste histoquímico com coloração por ácido periódico de schiff (PAS) da biópsia do intestino delgado, que mostrou marcação em macrófagos da lâmina própria e o estudo imuno-histoquímico para Ck8/18, foram sugestivos e compatíveis com infeção por T. whipplei. Assim, iniciou terapêutica com trimetoprim/sulfametoxazol (TMP-SMX) 80-480 mg de 6 em 6 horas, por via endovenosa (ev). Apesar da terapêutica instituída, o doente agravou o estado geral, com deterioração ventilatória por pneumonia intersticial associada a hemorragia alveolar, demonstrada em tomografia axial computorizada e em radiografia de tórax (Fig. 1). Foi realizada broncofibroscopia, com pesquisa positiva para ADN deTropheryma whipplei no aspirado brônquico. Optou-se por dupla antibioticoterapia, associando meropenem 1g de 8 em 8 horas e corticoterapia com metilprednisolona 40 mg, de 12 em 12 horas, ev. Após dois dias desta terapêutica, o doente apresentou melhoria clínica, analítica e imagiológica (Fig. 2) significativas.
Após recuperar a autonomia ventilatória, foi transferido para o SI para continuidade terapêutica. Fez 14 dias de indução terapêutica com a associação de meropenem e TMP-SMX, e corticoterapia decrescente com metilpredinisolona durante 30 dias. Teve alta melhorado, para seguimento ambulatorial, onde cumpriu 12 meses de tratamento, por via oral, com TMP-SMX 160-800 mg, de 12 em 12 horas, sem novas recidivas clínicas ou laboratoriais.
DISCUSSÃO:
A forma clássica da Doença de Whipple representa cerca de 80% dos casos e apresenta, caracteristicamente, um curso bimodal, com uma fase prodrómica e outra progressiva.10 A primeira fase manifesta-se geralmente por sintomas inespecíficos como artralgias, febre, fadiga, adenopatias periféricas e síndrome de má absorção.2 Esta fase tem uma duração média de 6-8 anos, 2 apesar de estarem descritos casos em que as artralgias podem preceder o diagnóstico em 30 anos.1,4 Posteriormente, a doença entra numa fase progressiva caracterizada por sintomas neurológicos e gastrintestinais.
A infeção gastrintestinal provoca sobretudo problemas relacionados com mal-absorção, como anemia ferropénica, hipoalbuminémia e perdas de peso significativas, para além de diarreia aquosa e cólicas abdominais.2,4 A nível neurológico as manifestações vão desde cefaleias, disfunção cognitiva e alterações severas dos movimentos oculares 2 até meningoencefalite e hidrocefalia.5 O envolvimento do sistema nervoso central (SNC), que ocorre em 10-40% dos doentes, representa a manifestação mais severa da D.W.4
Geoffrey et al descrevem9 um caso de envolvimento pulmonar, sem sintomas gastrintestinais, e fazem uma revisão bibliográfica de outros casos similares. Referem que o envolvimento pulmonar na D.W. está estimado em cerca de 30 a 40% e que, embora esse envolvimento geralmente ocorra com o curso da doença, poderá ser uma manifestação inicial, podendo apresentar-se sob diversas formas, como, doença pulmonar intersticial, nódulos pulmonares, derrames pleurais e granulomas.9
O “gold standard” para o diagnóstico da D.W. é o estudo histológico de peças de biópsia do intestino delgado, obtidas através de endoscopia, com coloração PAS. Para além disso, a endoscopia permite ainda a avaliação das alterações macroscópicas associadas a esta patologia, como eritema, edema, hipertrofia das pregas ou grandes linfangiectasias, podendo auxiliar no diagnóstico.2 A presença de macrófagos espumosos, que contêm grandes quantidades de inclusões intracelulares PAS positivas de coloração magenta, e que são negativas para a reação com Ziehl-Neelsen, é um achado diagnóstico claro para a confirmação da D.W.4 Importa, contudo, notar que, nos casos em que não há afetação gastrintestinal esta reação com PAS pode ser negativa sem que possamos excluir a doença. Nessas situações, é fundamental realizar o mesmo estudo em amostras biológicas dos locais afetados.2,4
Tendo em conta as manifestações clínicas variadas, a lista de diagnósticos diferenciais é extensa, e inclui doenças reumatológicas, doenças inflamatórias intestinais, enteropatia da síndrome da imunodeficiência adquirida (SIDA), outros síndromes de mal-absorção, infeção por Mycobacterium Avium Complex, demência, doenças cerebrovasculares, tuberculose, sarcoidose, vasculites sistémicas, endocardite, linfoma, entre outros.5
O tratamento não é consensual, nem na escolha de antibióticos, nem na sua duração, razão pela qual têm sido propostos vários esquemas de antibioticoterapia ao longo do tempo. Desde cedo, o TMP-SMX ocupou lugar de destaque, tendo sido incorporado em vários esquemas terapêuticos, quer em monoterapia com duração de até 1 ano,10 quer precedido de tratamento de indução inicial endovenoso com ceftriaxone, penicilina G, meropenem ou cloranfenicol e com duração de 3 a 12 semanas.4,7,11,12 Contudo, mais recentemente, alguns estudos justificam a alteração do TMP-SMX, por admitirem uma alta taxa de falência do mesmo, e sugerem como alternativa a combinação de doxiciclina com hidroxicloroquina, por um período de 1 ou 2 anos, sendo que há autores que defendem a necessidade de manter posteriormente profilaxia com doxiciclina indefinidamente.6,7 Apesar da antibioticoterapia ter alterado o prognóstico da doença, há algumas situações em que o prognóstico não é tão favorável, como a síndrome inflamatória de reconstituição imune (SIRI), a endocardite infeciosa pelo T. whipplei e sintomas do SNC severos e irreversíveis.4,11
A corticoterapia pode ser necessária no atingimento severo do SNC por lesões cerebrais, para diminuição da inflamação e do edema local, ou caso haja uma SIRI, que se pode manifestar como febre prolongada ou outros processos inflamatórios recorrentes após início da antibioticoterapia.4,7,8 O SIRI trata-se da complicação mais grave e pode estar associado à utilização de medicação imunossupressora previamente ao diagnóstico.4,8 Caso haja recidiva documentada, excluída a SIRI e lesões inflamatórias cerebrais, devem ser considerados regimes alternativos, como o interferão gama (IFN-ɣ). 4,7,8
Os critérios mais importantes para a resposta terapêutica são a melhoria dos sintomas e dos testes laboratoriais, nas primeiras 2 semanas de tratamento.4,7 No seguimento ambulatorial, são recomendadas avaliações clínicas, laboratoriais e invasivas (amostras duodenais, líquor cefalorraquidiano), aos 6, 12, 24 e 36 meses e depois de 3 em 3 anos. Em doentes com manifestações gastrintestinais, devem ser recolhidas amostras duodenais para avaliação histológica pela coloração PAS e PCR. Apesar da PAS poder permanecer positiva durante anos, se fora de contexto clínico, não significa doença ativa ou recidiva. A PCR torna-se rapidamente negativa após a instituição do tratamento e parece ser superior à coloração PAS para avaliação do sucesso terapêutico, com a ressalva de que, à semelhança desta, há pacientes cujas amostras biológicas permanecem PCR positivas após tratamento eficaz, devendo estes serem avaliados individualmente.2,4,8
No caso descrito, o diagnóstico baseou-se nos estudos histoquímicos e imuno-histoquímicos realizados no fragmento intestinal, motivando a escolha incial do TMP-SMX em monoterapia. Posteriormente, dado o agravamento respiratório com a presença do ADN da T. whipplei no aspirado brônquico, optou-se por associar o meropenem e a metilpredinisolona ao TMP-SMX durante 3 semanas. Contudo, dada a rápida melhoria clínica e analítica, foi decidido manter fase de indução por apenas 14 dias, com desmame progressivo da corticoterapia durante 30 dias e prolongamento da monoterapia com TMP-SMX por 12 meses.
Agradecimentos: Os autores agradecem as Dra. Leopoldina Vicente, Dra. Margarida Ascensão, Dra. Cristina Coxo e ao Dr. Vítor Branco, pelos conselhos e ajuda prestada na realização deste trabalho.
Figura I
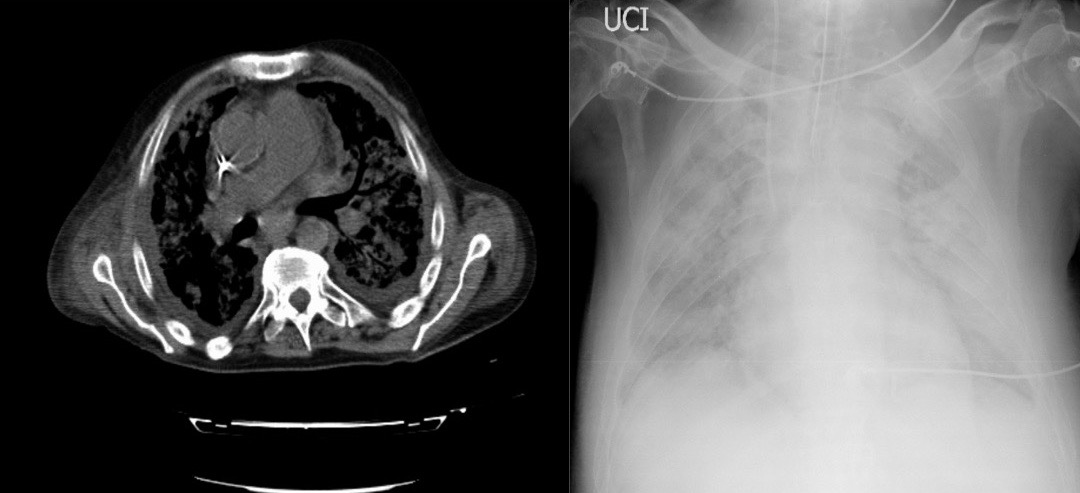
Tomografia axial computorizada do tórax, mostrando imagem compatível com infiltrado inflamatório difuso e bronquiectasias, compatíveis com pneumonia intersticial; radiografia de tórax com infiltrado algodonoso difuso, bilateralmente.
Figura II
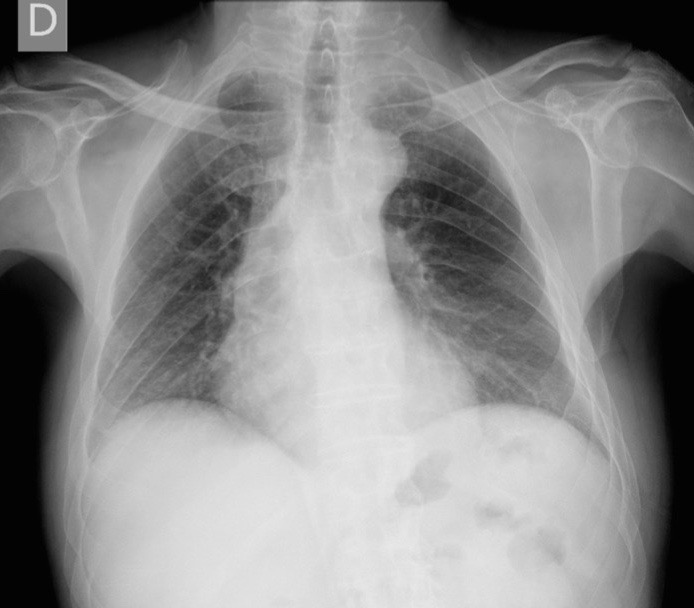
Radiografia de tórax dentro da normalidade, realizada no dia da alta.
BIBLIOGRAFIA
1. Altwegg M. Whipple ’ s Disease and “ Tropheryma whippelii .” Clin Microbiol Rev. 2001;14(3):561–83.
2. Mulroy E, Lynch T. Whipple’s Disease. Encycl Neurol Sci. 2014;757–8.
3. Marth T, Raoult D. Whipple ’ s disease. 2003;361(2):239–47.
4. Moos V, Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei. Eur J Clin Microbiol Infect Dis. 2011;30(10):1151–8.
5. Feurle AGE. Whipple ’ s Disease. 2004;(March 2001):2002–4.
6. Lagier JC, Fenollar F, Lepidi H, Giorgi R, Million M, Raoult D. Treatment of classic Whipple’s disease: From In vitro results to clinical outcome. J Antimicrob Chemother. 2014;69(1):219–27.
7. Schneider T, Moos V, Loddenkemper C, Marth T, Fenollar F, Raoult D. Whipple’s disease: new aspects of pathogenesis and treatment. Lancet Infect Dis. 2008;8(3):179–90.
8. Marth T. Systematic review: Whipple’s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors. Aliment Pharmacol Ther. 2015;41(8):709–24.
9. Urbanski G, Rivereau P, Artru L, Fenollar F, Raoult D, Puéchal X. Whipple disease revealed by lung involvement: A case report and literature review. Chest [Internet]. 2012;141(6):1595–8. Available from: http://dx.doi.org/10.1378/chest.11-1812
10. Keinath RD, Merrell DE, Vlietstra R, Dobbins WO. Antibiotic treatment and relapse in Whipple’s disease. Long-term follow-up of 88 patients. Gastroenterology [Internet]. 1985;88(6):1867–73. Available from: http://dx.doi.org/10.1016/0016-5085(85)90012-5
11. Feurle GE, Junga NS, Marth T. Efficacy of Ceftriaxone or Meropenem as Initial Therapies in Whipple’s Disease. Gastroenterology [Internet]. 2010;138(2):478–86. Available from: http://dx.doi.org/10.1053/j.gastro.2009.10.041
12. Feurle GE, Moos V, Bläker H, Loddenkemper C, Moter A, Stroux A, et al. Intravenous ceftriaxone, followed by 12 or three months of oral treatment with trimethoprim-sulfamethoxazole in Whipple’s disease.J Infect. 2013;66(3):263–70.



